Влияние хорионического гонадотропина на фагоцитарную и окислительную активность моноцитов и нейтрофилов
Автор: Ширшев С.В., Куклина Е.М., Гугович А.М.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 9, 2008 года.
Бесплатный доступ
В ходе исследования было выявлено влияние хорионического гонадотропина (ХГ) в дозах, сопоставимых с концентрацией гормона в крови на I и III триместрах беременности, на окислительную и фагоцитарную активность моноцитов и нейтрофилов женщин in vitro. Установлено, что гормон оказывает супрессивное действие на фагоцитарную активность моноцитов и нейтрофилов. Также гормон угнетает спонтанную окислительную активность нейтрофилов, однако ингибирующее действие гормона на моноциты проявляется только при стимулировании окислительной активности и только высокой дозой гормона. Таким образом, конечный результат воздействия ХГ зависит не только от дозы гормона, но и от активационного статуса исследуемых клеток.
Короткий адрес: https://sciup.org/147204444
IDR: 147204444 | УДК: 612.018:612.017.1:611.018.53
Текст научной статьи Влияние хорионического гонадотропина на фагоцитарную и окислительную активность моноцитов и нейтрофилов
Беременность является иммунологическим феноменом, уникальность которого заключается не только в преодолении трансплантатом иммунных механизмов, но и в становлении новых эндокринных взаимодействий, обеспечивающих на качественно новом уровне нормальное сосуществование и развитие двух организмов (Ширшев, 2002). Геном развивающегося плода в организме матери наполовину заимствован у отца, однако при физиологически протекающей беременности отторжения генетически чужеродного трансплантата не происходит.
Изучение факторов и механизмов, ответственных за изменения, происходящие с организмом матери во время беременности, является актуальной проблемой репродуктивной иммунологии. Важнейшим направлением в рамках данной проблемы является анализ роли репродуктивных гормонов в регуляции процессов иммунитета при беременности.
Основным пептидным гормоном плаценты, проектирующим развитие беременности, является хорионический гонадотропин (ХГ). В крови беременных женщин ХГ обнаруживается сразу после имплантации плодного яйца и далее его уровень интенсивно нарастает, достигая максимума к 7–10-й неделям. Затем концентрация ХГ существенно снижается и держится на таком уровне последующие II–III триместры (Benveniste, Scommegha, 1981).
Показано, что ХГ имеет специфические рецепторы на различных типах иммунокомпетентных клеток и оказывает существенное влияние как на адаптивные, так и на неспецифические защитные реакции организма (Fuchs et al., 1981; Ricketts, Jones, 1985). В период беременности супрессия адаптивного иммунного ответа матери компенсируется активацией системы естественного иммунитета. Основными клетками, которые определяют функционирование данной системы, являются мо-ноциты/макрофаги и нейтрофилы.
Помимо этого, ХГ стимулирует секрецию прогестерона и эстрадиола и свои иммуномодулирующие эффекты реализует в комплексе с этими гормонами. В то же время направленность имму-норегуляторного действия ХГ зависит не только от уровня концентрации половых стероидов, но и от активационного статуса клетки-мишени (Ширшев, Кеворков, 1993).
В силу перечисленных особенностей ХГ является в настоящее время объектом пристального внимания как фактор, тормозящий процессы отторжения плода, и основной претендент на роль антифертильной вакцины.
Целью данного исследования являлось изучение влияния ХГ в дозах, сопоставимых с концентрацией гормона в I и III триместрах беременности, на фагоцитарную и окислительную активность моноцитов и нейтрофилов женщин в крови in vitro.
Материалы и методы исследования
В работе использовали фракционированные лейкоциты периферической крови (моноциты и нейтрофилы) небеременных женщин репродуктивного возраста.
В эксперименте использовали ХГ («Profasi», Италия) в физиологических концентрациях, соответствующих их уровню в периферической крови в I и III триместрах беременности – 100 и 10 МЕ/мл соответственно (Benveniste, Scommegha, 1981). Для стимуляции клеток применяли зимозан (0,5 мг/мл), опсонизированный пулом сывороток. Для проведения люминолзависимой хемилюминесценции (ЛЗХЛ) использовали люминол («Sigma», США) в концентрации 5×10-4М.
Мононуклеарные клетки периферической крови (МНК) и нейтрофилы выделяли из гепаринизированной (25 МЕ/мл) венозной крови центрифугированием в двойном градиенте плотности фиколл-верографина («Pharmacia», Швеция; «Спофа», Чехия) с плотностью верхнего и нижнего градиентов 1,077 и 1,112 г/мл соответственно. С верхней интерфазы собирали МНК, с нижней – нейтрофилы. Затем из МНК путем адгезии выделяли моноциты с двух пассажей на чашки Петри («anumbra», Куба). Чистота выделения для моноцитов составляла 78–85% (по оценке моноклональных антител к CD14 (ICN Ph, США)), для нейтрофилов – 95% (гистологическая оценка).
При культивировании клеток использовалась среда 199 (НПО «Биомед», Россия) с добавлением 5% эмбриональной телячьей сыворотки («Serva», Германия), 0,01М HEPES («Serva», Германия), 300 мкг/мл L-глутамина («Serva», Германия), 100 мкг/мл гентамицина («Pharmacia», Швеция). Клетки (5×106/мл) инкубировали с гормоном в течение 6 часов при 37°С и 5% СО 2 , после чего определяли их фагоцитарную и окислительную активность. Затем вносили стимулятор и также оценивали фагоцитарную (в течение 30 мин) и окислительную (в течение 50 мин) активность клеток. Контроль культуры клеток инкубировали с растворителем гормона (NaCl – 0,9%) при аналогичных условиях. Жизнеспособность клеток оценивалась с помощью 5% эозина, она составила 95–97%.
Фагоцитарная активность оценивалась по степени гашения биолюминесценции лиофилизиро- ванной культуры люминесцентных бактерий генно-инженерного штамма E.coli Lum+ со спонтанным свечением (Патент 2292553 от 27.01.2007). Одну ампулу препарата разводили в 1 мл холодной дистиллированной воды, выдерживали 1 час при 4°С, 30 мин при комнатной температуре, затем еще 30 мин при 37°С и центрифугировали 10 мин (3000 об/мин), после чего доводили физиологическим раствором до 50 мл, получая рабочую концентрацию бактерий 5×106 /мл.
Готовую суспензию бактерий (180 мкл) вносили в лунки 96-луночного планшета, инкубировали в течение 3–5 мин при 37°С и снимали фоновый уровень свечения бактерии, затем, после внесения клеточной культуры в соотношении 1:10, измерялась степень гашения биолюминесценции в течении 30 мин с интервалом в 10 мин., при этом происходило полное поглощение E. coli Lum+ фагоцитирующими клетками. Измерение производилось на люминоскане «Аscent» (Финляндия) в относительных единицах свечения (RLU). Далее рассчитывался индекс фагоцитарной активности клеток (ИФА), отражающий процент гашения биолюминесценции по сравнению с исходным уровнем, по
Х 1 – Х 2
ИФА = -------х 100,
Х1 формуле где Х1 – интенсивность биолюминесценции контрольной пробы;
Х 2 – интенсивность биолюминесценции опытной пробы.
Окислительную активность оценивали по интенсивности ЛЗХЛ клеточной культуры (Dahigren, Sten-dahl, 1984). Для этого в планшет вносили 180 мкл раствора Хенкса без фенолового красного («Биолот», Россия), содержащего люминол (5×10-4М). После инкубации в течение 3-5 мин при 37 ° С и замера фонового свечения добавляли 20 мкл клеточной суспензии (5×106 /мл) и при непрерывном перемешивании измеряли интенсивность спонтанной хемилюминесценции для оценки исходного уровня окислительного метаболизма клеток. Затем в кювету вносили 20 мкл зимозана (0,5 мг/мл), опсонизированного пулом сывороток, и фиксировали интенсивность стимулированной хемилюминесценции в течение 50 мин с интервалом в 10 мин. Измерения производились также на люминоскане «Аscent» (Финляндия) в относительных единицах свечения (RLU).
При статистической обработке результатов вычислялись средняя арифметическая величина и ее стандартная ошибка. Достоверность различий между средними величинами оценивалась с помощью парного t -критерия Стьюдента, достоверными считались данные при р < 0,05.
Результаты исследований и их обсуждение
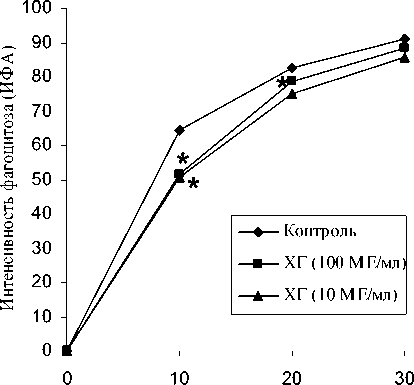
На первом этапе исследований оценивалась способность ХГ влиять на фагоцитарную активность нейтрофилов и моноцитов по степени гашения биолюминесценции.
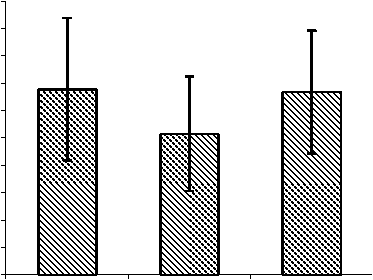
Установлено, что низкая доза гормона, соответствующая ей в крови в III триместре беременности, оказывает статистически значимое угнетающее действие на нейтрофилы на 10 мин инкубации. Высокая же доза ХГ, характерная для крови в I триместре беременности, ингибирует фагоцитарную активность нейтрофилов как на 10, так и на 20 мин инкубации, что говорит о более эффективном действии высокой дозы гормона на нейтрофилы (рис. 1).
Инкубация с E. coli Lum+, мин.
Рис. 1. Изменение индекса фагоцитарной активности нейтрофилов
Примечание: здесь и далее * – р < 0,05 в сопоставлении с контролем
При расчете ИФА для моноцитов были получены статистически значимые данные (рис. 2), причем угнетение низкой дозой ХГ, характерной для крови в III триместре беременности, наблюдалось как на 10, так и на 20 мин инкубации, а ингибирование ХГ-100 МЕ/мл на 10, 20 и 30 мин инкубации моноцитов с E. coli Lum+.
Таким образом установлено, что ХГ в дозах, характерных для крови в I и III триместрах беременности, угнетает фагоцитарную активность нейтрофилов и моноцитов. Учитывая, что угнетение фагоцитарной активности нейтрофилов происходит только высокой дозой ХГ, можно предположить, что нейтрофилы менее чувствительны к действию гормона.
На втором этапе исследования изучалось влияние ХГ на спонтанную и зимозанстимулирован-ную ЛЗХЛ нейтрофилов и моноцитов. Для оценки исходного уровня окислительного метаболизма клеток исследовалась спонтанная ЛЗХЛ.
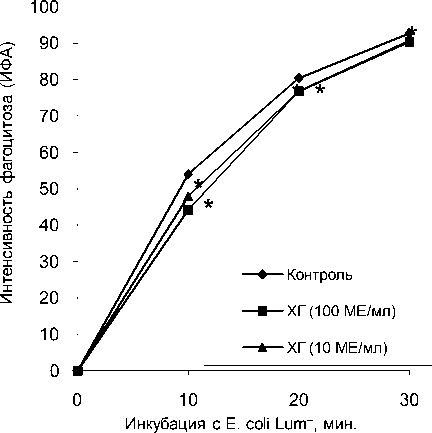
Рис. 2. Изменение индекса фагоцитарной активности моноцитов
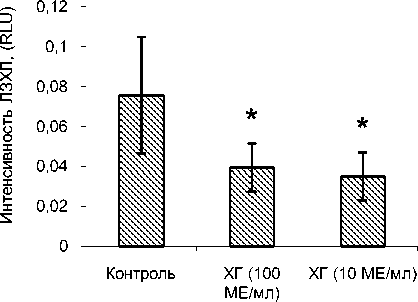
Установлено, что ХГ как в низкой дозе, соответствующей ему в крови в III триместре беременности, так и в высокой дозе оказывает статистически значимое угнетающее действие на спонтанную ЛЗХЛ нейтрофилов (рис. 3).
Экспериментальное воздействие
Рис. 3. Влияние ХГ на спонтанную ЛЗХЛ нейтрофилов
В то же время при оценке зимозанстимулиро-ванной ЛЗХЛ нейтрофилов гормон статистически достоверного влияния не оказывал (рис. 4).
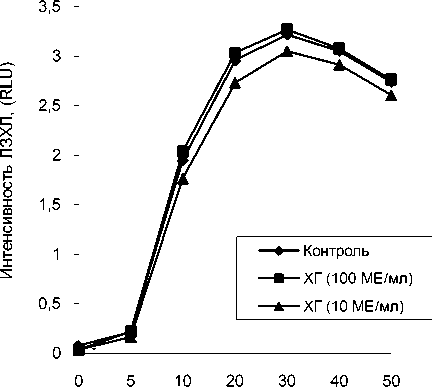
Аналогично исследовались и моноциты, однако был получен противоположный результат. При оценке влияния ХГ на спонтанную ЛЗХЛ моноцитов статистически значимых данных получено не было (рис. 5).
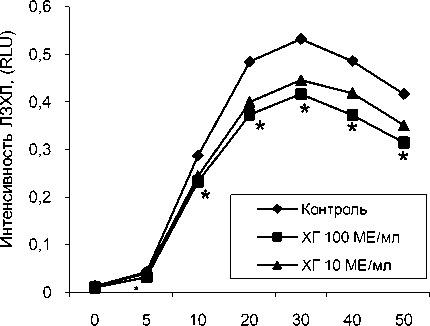
Но при внесении в суспензию, обогащенную моноцитами опсонизированного зимозана, интенсивность ЛЗХЛ достоверно угнеталась высокой дозой ХГ, соответствующей его содержанию в I триместре беременности, на всем протяжении эксперимента (рис. 6).
Продолжительность стимуляции, мин
Рис. 4. Влияние ХГ на динамику зимозанстимули-рованной ЛЗХЛ нейтрофилов
Таким образом, ХГ дифференцированно влияет на ЛЗХЛ нейтрофилов и моноцитов, угнетая спонтанную окислительную активность нейтрофилов, не влияя на стимулированную, а также оказывая ингибирующее действие на стимулированную ЛЗХЛ моноцитов.
0,02 s 0,018 £ 0,016 X 0,014 CO R 0,012 о 0,01
0,008 £ 0,006 = 0,004
0,002 0
Контроль ХГ (100 МЕ/мл) ХГ (10 МЕ/мл)
Экспериментальное воздействие
Рис. 5. Влияние ХГ на спонтанную ЛЗХЛ моноцитов
Представленные данные говорят об эффективном регуляторном действии ХГ на функции нейтрофилов и моноцитов периферической крови. Как правило, ХГ оказывает ингибирующее действие на процессы фагоцитоза и окислительной активности, что, по-видимому, способствует полноценному развитию физиологической беременности. Кроме того, установлено, что гормональная стимуляция окислительного метаболизма как нейтрофилов, так и моноцитов зависит от активационного статуса клетки. Литературные данные по регуляции окислительной активности нейтрофилов в крови во время беременности весьма противоречивы. С од- ной стороны, показано, что в этот период окислительный потенциал клеток повышен, причем данный эффект наблюдается только в III триместре (Selvaraj et al., 1982). С другой стороны, имеются работы, в которых отмечается его снижение (Krause et al., 1987; Crouch et al., 1995), наиболее выраженное также в III триместре (Crouch et al., 1995). Вероятно, такие противоречия можно объяснить разными методическими подходами к оценке окислительной активности клеток.
Продолжительность стимуляции, мин
Рис. 6. Влияние ХГ на динамику зимозанстимули-рованной ЛЗХЛ моноцитов
Таким образом, влияние ХГ на нейтрофилы и моноциты зависит от срока гестации. Так, в I триместре гормон угнетает фагоцитарную активность нейтрофилов и моноцитов и спонтанную окислительную активность нейтрофилов. В III триместре ХГ также оказывает угнетающее действие на фагоцитарную и окислительную активность данных клеток, что, по-видимому, способствует благополучному исходу беременности.
Список литературы Влияние хорионического гонадотропина на фагоцитарную и окислительную активность моноцитов и нейтрофилов
- Ширшев, С.В. Механизмы иммунноэндокринного контроля процессов репродукции: в 2 т./С.В. Ширшев. Екатеринбург: УрО РАН, 2002.
- Ширшев, С.В. Зависимость иммуномодулирующих эффектов хорионического гонадотропина от исходной функциональной активности спленоцитов, реализующих адаптивный иммунный ответ/С.В. Ширшев и Н.Н. Кеворков//Пробл. эндокринологии. 1993. Т. 39, № 1. С. 54-57.
- Пат. 2292553 Российская Федерация, МПК 7 G01N33/53. Способ определения фагоцитарной активности нейтрофилов периферической крови человека по степени гашения биолюминесценции./Ширшев С.В., Куклина Е.М., Заморина С.А., Никитина Н.М., Некрасова И.В. -заявитель и патентообладатель Ин-т экологии и генетики микроорганизмов УрО РАН (RU), Ширшев С.В. (RU) -№ 2005118124/15; заявл. 10.06.05; опубл. 27.01.07, Бюл. № 3.
- Benveniste, R. Human chorionic gonadotropin alphasubunit in pregnancy/R. Benveniste, A. Scommegha//Amer. J. Obstet. Gynecol. 1981. Vol. 141. P. 952-961.
- Crouch, S.P.M. The effect of pregnancy on polymorphonuclear leukocyte function/S.P.M. Crouch, I.P. Crocker, J. Fletcher//J. Immunol. 1995. Vol. 155. P. 5436-5443.
- Dahigren, C. Myeloperoxidase modulates the phagocytic activity of polymorphonuclear neutrophil leukocytes. Studies with cells from a myeloperoxidase deficient patient/C. Dahigren, O. Stendahl//J. Clin. Invest. 1984. Vol. 73. P. 366-373.
- Fuchs, T. In vitro induction of human suppressor Tcells by chorionic gonadotropin preparation/T. Fuchs, L. Hammarstrom, C.I. E. Smith, J. Brundin//J. Reprod. Immunol. 1981. Vol. 3. P. 75-84.
- Krause, P.J. Host defense during pregnancy: neutrophil chemotaxis and adherence/P.J. Krause, C.J. Ingardia, L.T. Pontius [et al.]//Acad. J. Obstet. Gynecol. 1987. Vol. 157. P. 274-281.
- Ricketts, R.M. Differential effect of human chorionic gonadotropin on lymphocyte proliferation induced by mitogens/R.M. Ricketts, D.B. Jones//J. Reprod. Immunol. 1985. Vol. 7. P. 225-232.
- Selvaraj, S.K. Mechanism of monocyte activation and expression of proinflammatory cytochemokines by placenta growth factor./S.K. Selvaraj, R.K. Giri, N.E. Perlman [et al.]//Endocrinol. 1982. Vol. 108. P. 1515.


