Влияние хорионического гонадотропина на продукцию интерлейкина-8 интактными моноцитами. Роль Toll-подобных рецепторов
Автор: Заморина Светлана Анатольевна, Ширшев Сергей Викторович
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 3, 2012 года.
Бесплатный доступ
Изучены эффекты хорионического гонадотропина (ХГ) на продукцию интелейкина-8 (ИЛ-8) интактными моноцитами женщин. Показано, что стимуляция гормоном (100 МЕ/мл) продукции ИЛ-8 осуществляется с вовлечением молекул Toll-подобных протеинов 4 (TLR4), так как блокада этих рецепторов антителами частично отменяла эффект ХГ. Таким образом, установлен новый механизм взаимодействия гормона с моноцитами, опосредованный молекулами TLR4, которые выступают в качестве «альтернативных» рецепторов гормона.
Хорионический гонадотропин, интерлейкин-8, toll-подобные рецепторы 4 типа
Короткий адрес: https://sciup.org/147204901
IDR: 147204901 | УДК: 612.018:612.017.1:611.018.53
Текст научной статьи Влияние хорионического гонадотропина на продукцию интерлейкина-8 интактными моноцитами. Роль Toll-подобных рецепторов
Хорионический гонадотропин (ХГ) - гликопротеиновый гормон, трофобластный аналог лютеинизирующего гормона (ЛГ), активно участвует в контроле иммунных процессов, сопровояедающих беременность [Magnie et al. 1990; Ширшев, 1998; Ширшев, Куклина, Ярилин, 2003; Ширшев, Куклина, 2005; Ширшев, Заморина, 2011]. Согласно концепции H.F. Acevedo (2002 г.), ХГ не имеет своего «истинного» рецептора, реализуя эффекты через гормональный ЛГ-рецептор за счет высокой степени гомологии с ЛГ. Однако в моноцитах периферической крови небеременных женщин обнаружены лишь следовые количества ДНК ЛГ-рецептора [Kosaka et al., 2002], в то время как ХГ эффективно модулирует функциональную активность моноцитов женщин.
Ранее нами было показано, что ХГ вовлекает в реализацию своих эффектов на уровне моноцитов молекулы Toll-подобных протеинов (TLR4), относящихся к паттерн-распознающим рецепторам (ПРР) [Ширшев, Заморина, 2006]. В основе этого взаимодействия лежит структурное сходство внеклеточных доменов ЛГ-рецептора и TLR4-peuen-тора, основанное на высоком содержании лейцина (так называемые leucin rich repeat (LRR)) [Rosemblit, Ascoli, Segaloff, 1988; Bhowmick et al., 1996]. Молекулы TLR могут распознавать ряд эндогенных продуктов, появление которых не связа но с инфицированием [Tsan, Gao, 2004], и, таким образом, ХГ является эндогенным лигандом для TLR.
Известно, что введение ■ ^субъединицы ХГ (или синтетических олигопептидов, родственных по структуре) в критических состояниях, индуцированных присутствием большого количества бактериальных липополисахаридов (ЛИС), способно останавливать воспалительные реакции [van den Berg et al., 2011]. Вероятнее всего, это происходит в силу способности гормона выступать как конформационный антагонист ЛПС. Таким образом, расшифровка молекулярного механизма действия ХГ, связанного с ПРР на уровне клеток иммунной системы, является фундаментальной задачей, связанной с изучением филогенетически древнего механизма реализации гормон-модулирующей активности.
Неоднозначную роль во время беременности играет интерлейкин-8 (ИЛ-8), являясь цитокином, обеспечивающим ангиогенез и защиту плацентарных оболочек. Вызывая направленную миграцию лейкоцитов в очаг воспаления, он повышает внутриклеточную гибель микроорганизмов, активируя освобождение ими коллагеназы и эластазы, ферментов, расщепляющих внеклеточный матрикс, вырабатываемый цервикальными фибробластами, вовлекается в патологический процесс при преждевременных родах [цит. по: Чистякова и др., 2005]. В 2002 г. показана ХГ-индуцируемая продукция ИЛ-8
моноцитами небеременных женщин, авторы исследования предполагают, что ХГ вовлекает в реализацию своих эффектов маннозные рецепторы, относящиеся к ПРР [Kosaka et al., 2002].
Целью работы являлось изучение роли молекул TLR4 в реализации эффектов ХГ на продукцию ИЛ-8 моноцитами небеременных женщин.
Материалы и методы
Объектами исследования являлись фракционированные моноциты небеременных женщин репродуктивного возраста, находящихся в ранней фолликулярной фазе менструального цикла. Мо-нонуклеарные клетки получали центрифугированием в градиенте плотности фиколл-верографина (1.077 г/см3); полученную суспензию после двойной отмывки средой 199 помещали на чашки Петри с 5% ЭТС и инкубировали 45 мин. при 37 W, затем адгезировавшие моноциты снимали механическим способом, дважды отмывали и стабилизировали инкубированием в течение 45 мин. при 42^ [Pertof et al., 1980]. Полученную суспензию (1x106 мл) инкубировали в полной питательной среде (среда 199 с добавлением 10 шМ HEPES; 2 шМ L-глутамина; 100 мкг/мл гентамицина и 10% ЭТС) с гормоном в течение 2 сут. при 372^ в условиях 5% СО2. Продукцию ИЛ-8 в супернатантах культур моноцитов оценивали иммунофер-ментным методом при помощи коммерческого набора («Вектор-Бест», Россия).
Для изучения влияния ХГ на синтез ИЛ-8, гормон («Profasi», Италия) использовали в концентрации 100 МЕ/мл, что соответствует его пику на 9-11 нед. беременности. [Cole, 2012]. Для изучения взаимодействия гормона с TLR4 использовали также запредельную дозу ХГ 1000 МЕ/мл. Экспрессия CD 14 и TLR4 на клетках оценивалась после инкубации с ХГ (100, 1000 МЕ/мл) при помощи моноклональных антител (TLR4(CD284)/PE; CD14/FITC «eBioscience», Канада) на проточном цитофлуриметре «BD Calibur» (США) в разные сроки инкубации (1, 5, 10, 15 мин.). Для «выключения» Toll-зависимого пути реализации гормонального эффекта применяли немеченые антитела к TLR4 (ab TLR4, «eBioscience», Канада; 0,5 мг/мл, изотипический контроль Mouse IgG2a, k), которые вносили в культуру моноцитов до гормона. Учитывая, что взаимодействие ХГ с «классическим» ЛГ/ХГ рецептором приводит к повышению внутриклеточного уровня циклического аденозинмонофосфата (цАМФ), активирующего про-теинкиназу А (ПКА) [Rao, Zhou, Lei, 2004], в исследовании применяли блокатор ПКА Н-89 («ICN Ph», США) в концентрации 10 мкМ/мл [Parvathenani et al., 1998].
Статистическая обработка данных проводилась с помощью парного t-критерия Стьюдента, для малых групп с помощью п-критерия Манна-Уитни.
Результаты и обсуждение
Ранее нами было показано, что в присутствии высоких доз ХГ снижался уровень СО14+-позитив-ных клеток [Ширшев, Заморина, 2004]. Так как молекула CD 14 функционирует как корецептор TLR4, в данном случае речь идет не о регуляции экспрессии, а о детекции этих молекул. Таким образом, ХГ, взаимодействуя с молекулами TLR4, экранирует их от антител против CD 14.
В настоящем исследовании установлено, что в присутствии ХГ (100, 1000 МЕ/мл) снижался и уровень СВ14+ТЕК4+-позитивных клеток на 1-, 5-и 10-й мин. эксперимента (рис. 1).
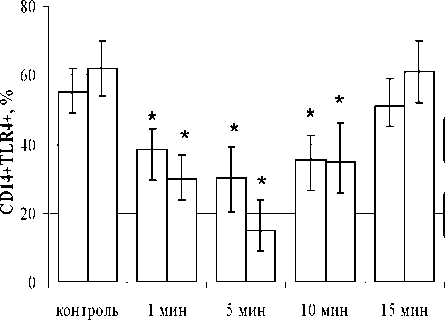
□ ХГ 100 МЕ/мл □ ХГ1000 МЕ/мл
Рис. 1. Влияние ХГ на детекцию CD14+TLR4+-клеток в системе in vitro в динамике (н = 4).
*- достоверные (р < 0.05) по u-критерию Манна-Уитни различия с контролем
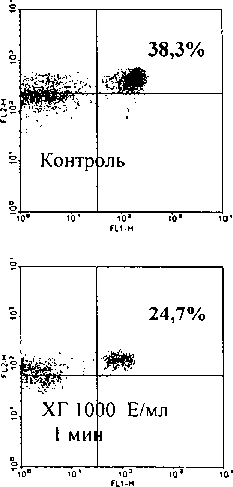
Показано, что наиболее активно ХГ (1000 МЕ/мл) взаимодействует с молекулами TLR4 на 5й мин. инкубации (372^), почти вдвое снижая уровень CD14+TLR4+ (рис. 2). Гейтирование пула моноцитов в экспериментах осуществляли по боковому и прямому светорассеянию, а не по CD 14, в силу экранирования CD 14 молекулами ХГ. Таким образом, показано, что ХГ активно связывается с поверхностью моноцитов, взаимодействуя с молекулами TLR4.
Из литературы известно, что меченый FITС ХГ связывается с более чем 80% СО14+-моноцитов, причем процесс связывания дозозависимо блокируется в присутствии нативного XT [Kosaka et al., 2002]. Как уже было отмечено выше, на поверхности моноцитов небеременных женщин не обнаружен ЛГ-рецептор методом проточной цитофлуори-метрии, а клетки содержат лишь следовые количества ДНК ЛГ-рецептора, то есть, существует несоответствие между связыванием гормона на поверхности моноцитов и отсутствием рецептора. Таким образом, нами установлено, что ХГ связывается с альтернативными рецептору структурами на поверхности моноцитов, которые нами идентифицированы как TLR4.
|
S^S1.'-'. |
19,4% |
|
ХГ100 5 мин |
) МЕ/мл |
^0» 10' ю- 10’ 10*
CD14
Рис. 2. Влияние ХГ на детекцию CD 14ТЕВ4-клсток в системе in vitro.
Гистограммы отражают влияние ХГ (1000 МЕ/мл) на количество CD4+TLR4+-KneroK на примере одного эксперимента. В правом верхнем квадранте указан процент СВ14+ТЕК4+-клеток в гейте моноцитов (по FSS/SS). По оси абсцисс - флуоресценция по каналу FL 1, FITC; по оси ординат - по каналу FL2, РЕ
При изучении влияния гормона на продукцию моноцитами ИЛ-8 показано, что ХГ достоверно стимулировал продукцию этого цитокина, что согласуется с исследованиями К. Kosaka с коллегами [2002]. Мы в аналогичных условиях подтвердили также, что стимулирующий эффект ХГ на уровень ИЛ-8 воспроизводился на фоне блокады ИКА. Однако принципиально важным моментом является то, что ИЛ-8-стимулирующий эффект ХГ воспроизводился и на фоне заблокированных антителами TLR4 (рис. 3). Установлено, что в условиях двойной блокады, когда были «выключены» как ИКА, так и TLR4, стимулирующий эффект гормо на полностью отменялся (рис. 3). Таким образом, можно сделать вывод о том, что в зависимости от доступности рецепторов гормон может связываться и «работать» как через ЛГ/ХГ-рецептор, так и через молекулы TLR4, не исключая взаимодействия с маннозными рецепторами.
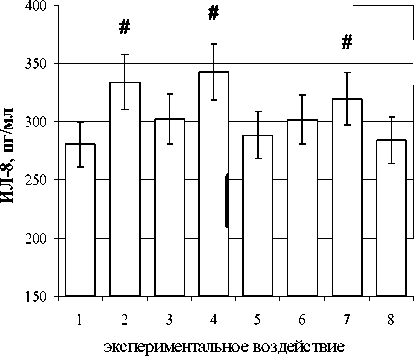
Рис. 3. Влияние ХГ на продукцию ИЛ-8 моноцитами женщин. Роль TLR4 и ПКА (н =
1 - контроль; 2 - ХГ 100 МЕ/мл; 3 - Н-89; 4 - Н-89 + ХГ 100 МЕ/мл; 5 - контроль изотипа; 6 -AbTLR4; 7-ХГ 100МЕ/мл+аЬТЕК4; 8-ХГ100 МЕ/мл+аЬТЕК4+Н-89;#- достоверные (р<0.05) по t-критерию Стьюдента различия с контролем
В 2002 г. К. Kosaka с коллегами предположили, что ХГ на поверхности моноцитов связывается с маннозными рецепторами (C-lectin). Предварительный контакт моноцитов с D-маннозой ослаблял стимулирующий эффект ХГ в отношении синтеза ИЛ-8, однако блокада ПКА не влияла на реализацию гормонального эффекта. Известно, что ПКА вовлекается в транмиссию гормонального сигнала через ЛГ-рецептор. В то же время, в большинстве моноцитов после стимуляции ХГ, наблюдалась транслокация NF-kB в ядро, несмотря на отсутствие рецептора [Kosaka et al., 2002]. Таким образом, очевидно существование альтернативного пути для ХГ, который мы идентифицировали как ТГК4-путь. Подтверждением этого служит также тот факт, что запуск ТЕК4-пути непосредственно вызывает активацию ядерного фактора NF-kB [Tsan, Gao, 2004].
Необходимо отметить, что сама идея так называемой «альтернативной» рецепции актуальна для ряда гормонов. Так, в 1999 г. D.Z. Simpson с коллегами показал, что питуитарные гормоны, такие как ЛГ и ТТГ, способны взаимодействовать с маннозными рецепторами, которые известны, прежде всего, как лектиновые рецепторы для фагоцитоза. Высказано предположение, что клетки иммунной системы участвуют в клиренсе этих гормонов [Simpson et al., 1999]. Эти рецепторы распознают гликозилированные остатки маннозы, фукозы и GlcNA в Са2+-зависимой манере через карбокси-гидратный распознающий домен [Taylor, 2001]. Известно, что маннозные рецепторы появляются на моноцитах в процессе их дифференцировки в макрофаги, и только что выделенные из периферической крови МПК и культивированные 2 сут. МПК не экспрессируют маннозные рецепторы. Однако маннаны и полимерные комплексы, содержащие маннозу, также хорошо усиливают секрецию ИЛ-8 моноцитами [Kosaka et al., 2002]. Таким образом, очевидно наличие неидентифицированных рецепторов, играющих ключевую роль в продукции ИЛ-8 моноцитами, которые нами идентифицированы как TLR4.
Таким образом, нами существенно расширены представления о механизме действия ХГ на уровне моноцитов. Вероятно, возможность подобного взаимодействия могла сложиться в процессе эволюции, так как ХГ и Toll-подобные белки являются филогенетически древними молекулами [Acevedo, 2002]. Можно предположить, что связывание ХГ с TLR4 является одним из фетопротективных механизмов в период беременности, поскольку теоретически способно ограничивать ЛПС-индуциро-ванные патологические реакции, приводящие к самопроизвольным абортам. В пользу этого предположения служит тот факт, что введение Р-субъединицы ХГ (или родственных синтетических олигопептидов) в критических состояниях, индуцированных присутствием большого количества ЛПС, способно останавливать воспалительные реакции [van den Berg et al., 2011]. Показано, что ХГ-зави-симые олигопептиды имеют терапевтический потенциал для ослабления угрожающего жизни воспаления и повреждения органов, ассоциированного с травмой и геморрагическим шоком и in vivo на мышиной модели супрессирует ТЕК4-опосредо-ванное воспаление [van den Berg et al., 2011]. Блокада глюкокортикостероидных рецепторов приводит к отмене этих эффектов. Помимо этого, олигопептид работает и через АКТГ-рецептор, в то время как роль ЛГ-рецептора в этих процессах пока не изучена [van der Zee et al., 2010]. Эти результаты раскрывают новую стратегию поиска потенциальных терапевтических средств. Вероятнее всего, продукты деградации ХГ, а также ХГ-подобные олигопептиды оказывают выраженные противовоспалительные эффекты в силу своей способности выступать как конформационные антагонисты ЛПС. В отношении взаимодействия цельной молекулы ХГ с TLR4 хотелось бы добавить, что активация этих рецепторов также ведет к повышению уровня цАМФ внутри клетки, что снимает существующие противоречия [Song et al., 2007]. Данные, полученные в 2012 г. С. Feng с коллегами, показывают, что сиаловые остатки (а молекула ХГ является высокосиализированной) модулируют
ЛПС-сигналинг через TLR4. Таким образом, предложенная нами концепция «альтернативной» рецепции ХГ находит все больше экспериментальных подтверждений. Существование множественной рецепции для ключевого гормона беременности существенно расширяет существующие представления о фундаментальных основах взаимодействия гормон-рецептор.
Список литературы Влияние хорионического гонадотропина на продукцию интерлейкина-8 интактными моноцитами. Роль Toll-подобных рецепторов
- Чистякова Г.Н. и др. Оценка продукции цитокинов при беременности, осложненной угрозой прерывания в первом триместре//Фундаментальные и прикладные проблемы медицины и биологии. 2005. № 5. С. 96-98.
- Ширшев С.В. Клеточные и молекулярные механизмы иммуно-модулирующего действия хорионического гонадотропина//Успехи совр. биол. 1998. Т. 118. С. 69-85.
- Ширшев С.В., Заморина С.А. Роль Toll-подобных протеинов в реализации эффектов хорионического гонадотропина на функциональную активность моноцитов//Докл. АН. 2006. Т. 409, № 5. С. 699-701.
- Ширшев С.В., Заморина С.А. Роль хорионического гонадотропина в формировании иммуно-логиче-ской толерантности при беременности//Проблемы эндокринологии. 2011. № 5. С. 52-56.
- Ширшев С.В., Куклина Е.М. Регуляция окислительного потенциала нейтрофилов репродуктивными гормонами в зависимости от уровня активации клеток//Докл. АН. 2005. Т. 401, № 6. С. 825-828.
- Ширшев С.В., Куклина Е.М., Ярилин А.А. Роль репродуктивных гормонов в контроле апоптоза Т-лимфоцитов//Биохимия. 2003. Т. 68, № 4. С. 577-583.
- Acevedo H.F. Human chorionic gonadotropin (hCG), the hormone of life and death: a review//J. Exp. Ther. Oncol. 2002. Vol. 2, № 3. P. 133-145.
- Bhowmick N. et al. Determination of residues important in hormone binding to the extracellular domain of the luteinizing hormone/chorionic gonadotropin receptor by site-directed mutagenesis and modeling//Mol. Endocrinol. 1996. Vol. 10, № 9. P. 1147-1159.
- Cole L.A. hCG, the wonder of today's science//Reprod Biol Endocrinol. 2012. Vol. 10. P. 24.
- Kosaka K. et al. Human chorionic gonadotropin (HCG) activates monocytes to produce interleukin-8 via a different pathway from luteinizing hormone/HCG receptor system//J. Clin. Endocrinol Metab. 2002. Vol. 87, № 11. Р. 199208
- Magnie M. et al. Effects of chorionic gonadotropin (hCG) therapy on the immune system//Medicina (Firenze). 1990. Vol. 10, № 2. P. 148-149.
- Parvathenani L.K. et al. Type I cAMP-dependent Protein Kinase Delays Apoptosis in Human Neutrophils at a Site Upstream of Caspase-3//J. Biol. Chem. 1998. Vol. 273, Т. 12. Р. 6736-6743. Pertof
- Pertof H. et al. Separation of human monocytes on density gradients of Percoll//J. of immunological methods. 1980. Vol. 33. P. 221-229
- Rao Ch.V, Zhou X.L., Lei Z.M. Functional luteinizing hormone/chorionic gonadotropin receptors in human adrenal cortical H295R cells//Biol. Reprod. 2004. № 71. Р. 579-587.
- Rosemblit N., Ascoli M., Segaloff D.L. Characterization of an antiserum to the rat luteal luteinizing hormone/chorionic gonadotropin receptor//Endocrinology. 1988. Vol. 123, № 5. P. 2284-2290.
- Simpson D.Z. et al. Multiple interactions between pituitary hormones and the mannose receptor//Biochem J. 1999. Vol. 343. P. 403-411.
- Song J. et al. TLR4 initiated and cAMP mediated abrogation of bacterial invasion of the bladder//Cell Host Microbe. 2007. Vol. 1(№4). Р. 287-298.
- Taylor M.E. Structure and function of the macrophage mannose receptor//Results Probl. Cell Differ. 2001. Vol. 33. P. 105-121
- Tsan M.F., Gao B. Endogenous ligand of Toll-like receptor//Leykocyte Biology. 2004. Vol. 76, № 3. Р. 514-519.
- van den Berg J.W. et al. The P-human chorionic gonadotropin-related peptide LQGV reduces mortality and inflammation in a murine polymicrobial sepsis model//Crit. Care Med. 2011. Vol. 39, № 1. P. 126-134.
- van der Zee M. et al. Synthetic human chorionic gonadotropin-related oligopeptides impair early innate immune responses to Listeria monocytogenes in Mice//J. Infect. Dis. 2010. Vol. 201, № 7. P. 1072-1080.


