Влияние хронического облучения на фитогормональный статус сосен Чернобыльской зоны отчуждения
Автор: Битаришвили С.В., Гераськин С.А., Шестерикова Е.М., Празян А.А.
Рубрика: Научные статьи
Статья в выпуске: 4 т.31, 2022 года.
Бесплатный доступ
Исследовано влияние хронического радиационного воздействия на гормональную систему сосны обыкновенной Чернобыльской зоны отчуждения. Образцы хвои отбирали на трёх экспериментальных участках с контрастным уровнем радиоактивного загрязнения в Полесском государственном радиационно-экологическом заповеднике и двух контрольных участках в Козелужском лесничестве Хойникского лесхоза в июне 2021 г. Искусственные насаждения сосны обыкновенной на экспериментальных участках были заложены за несколько лет до аварии в 1982 г. При оценке радиационного воздействия учитывали содержание в почве и хвое радионуклидов 137Cs, 90Sr, 241Am, 238Pu и 239+240Pu. Мощности поглощённых доз в хвое на загрязнённых участках варьировали в диапазоне 1,5-24,6 мкГр/ч, в контроле - 0,58-0,6 мкГр/ч. Концентрации основных классов фитогормонов: индолилуксусной кислоты, индолилмасляной кислоты, зеатина и абсцизовой кислоты в хвое были оценены методом высокоэффективной жидкостной хроматографии. В результате исследования не было выявлено существенных изменений в фитогормональном статусе сосен с загрязнённых участков Чернобыльской зоны отчуждения. Статистически значимые различия в концентрациях фитогормонов не демонстрировали зависимости от радиационного воздействия и являлись результатом значительной биологической вариабельности природных популяций или влияния иных факторов нерадиационной природы.
Авария на чернобыльской аэс, хроническое облучение, радиоактивное загрязнение, сосна обыкновенная, фитогормоны, индолилуксусная кислота, индолил- масляная кислота, зеатин, абсцизовая кислота, высокоэффективная жидкостная хроматография
Короткий адрес: https://sciup.org/170196162
IDR: 170196162 | УДК: 582.475.4:581.5:57.084.2:614.876 | DOI: 10.21870/0131-3878-2022-31-4-64-72
Текст научной статьи Влияние хронического облучения на фитогормональный статус сосен Чернобыльской зоны отчуждения
Материалы и методы
Объект исследования . Сосна обыкновенная ( Pinus sylvestris L.), широко распространённый в Чернобыльской зоне вид-эдификатор, определяющий структуру фитоценозов в лесных сообществах. Высокая радиочувствительность и широкая распространённость определила выбор сосны в качестве референтного вида, рекомендованного Международной комиссией по радиологической защите для оценки последствий облучения [6]. Искусственные насаждения сосны обыкновенной на наших экспериментальных участках были заложены за несколько лет до аварии в 1982 г.
Экспериментальные участки, пробоотбор . Обследование экспериментальных участков и пробоотбор были проведены в июне 2021 г. на территории Гомельской области Республики Беларусь, загрязнённой радионуклидами в результате аварии на ЧАЭС. Исследования проводили на трёх экспериментальных участках с контрастным уровнем радиоактивного загрязнения и составом основных дозообразующих радионуклидов в Полесском государственном радиационно-экологическом заповеднике. Участки Гнездинка (Гнезд), Масаны (Мас) и Кулажин (Кул) заложены в сосновых насаждениях искусственного происхождения вблизи бывших одноимённых населённых пунктов. Два контрольных участках Рудинка 1 (Руд 1) и Рудинка 2 (Руд 2) заложены в искусственных насаждениях сосны в Козелужском лесничестве Хойникского лесхоза (31 и 40 квартал соответственно). При оценке радиационного воздействия учитывали содержание в почве и хвое следующих радионуклидов: 90Sr, 137Cs, 238Pu, 239+240Pu, 241Am (табл. 1). Активность α-, β- и γ-излучающих радионуклидов в образцах определяли спектрометрическими и радиохимическими методами. Мощность поглощённой дозы в хвое (табл. 2) была рассчитана с помощью ERICA Tool [7]. Подробное описание радиоэкологической обстановки на экспериментальных участках и методики её исследования представлена в работе [8].
Таблица 1
Содержание радионуклидов в почве и хвое сосен на экспериментальных участках
|
Участок |
Радиоактивное |
Радионуклиды |
||||
|
загрязнение |
90Sr |
137Cs |
238Pu |
239+240Pu |
241Am |
|
|
Руд 1 |
Плотность загрязнения почвы, 20 см, кБк/м2 |
8±3 |
30±6 |
0,4±0,1 |
0,9±0,2 |
2,0▲±0,4 |
|
Удельная активность в хвое, Бк/кг |
365±55 |
495±103 |
1,5▲±0,3 |
0,7±0,2 |
2,0±0,4 |
|
|
Руд 2 |
Плотность загрязнения почвы, 20 см, кБк/м2 |
11±3 |
32±7 |
0,3±0,1 |
0,8±0,1 |
3*±0,5 |
|
Удельная активность в хвое, Бк/кг |
376±57 |
320±48 |
0,6*±0,2 |
0,8±0,2 |
2,4±0,6 |
|
|
Гнезд |
Плотность загрязнения почвы, 20 см, кБк/м2 |
43*▲±5 |
241*▲±43 |
1,4*▲±0,3 |
1,3▲±0,2 |
10*▲±3 |
|
Удельная активность в хвое, Бк/кг |
597*▲±90 |
2537*▲±278 |
2,0▲±0,3 |
1,4±0,5 |
8,6*▲±1,8 |
|
|
Мас |
Плотность загрязнения почвы, 20 см, кБк/м2 |
1760*▲±238 |
2870*▲±402 |
13*▲±2 |
33*▲±4 |
38*▲±4 |
|
Удельная активность в хвое, Бк/кг |
8647*▲±1298 |
21070*▲±730 |
21*▲±4,8 |
49*▲±8,1 |
44*▲±8,5 |
|
|
Кул |
Плотность загрязнения почвы, 20 см, кБк/м2 |
241*▲±34 |
8762*▲±1139 |
3,6*▲±0,5 |
8,7*▲±1 |
27*▲±5 |
|
Удельная активность в хвое, Бк/кг |
8995*▲±1350 |
58950*▲±1970 |
5,3*▲±1,8 |
12*▲±2,1 |
14*▲±2,3 |
|
* – значимые различия с контрольным участком Руд 1, p<0,05;
▲ – значимые различия с контрольным участком Руд 2, p<0,05.
Участки, расположенные вдали от источников техногенного загрязнения, не менее чем в 50 м от дорог, просек и открытых стен леса, имели квадратную форму 50×50 м. Почва на всех участках – дерново-подзолистая, слабооподзоленная, развивающаяся на рыхлом мелкозернистом песке. Высота сосен составляла 12-16 метров, II класс возраста. На каждом участке с 11 деревьев отбирали двухлетнюю хвою на высоте 12-16 метров от земли. Сразу после отбора хвою замораживали в жидком азоте до анализа.
Таблица 2
Мощность поглощённой дозы в хвое сосны на экспериментальных участках
|
Участок |
Координаты |
Мощность поглощённой дозы, мкГр/ч |
|||
|
внешнее γ-облучение от поверхности почвы |
внутреннее β-облучение хвои |
внутреннее α-облучение хвои |
суммарная мощность поглощённой дозы, мкГр/ч |
||
|
Руд 1 |
51°58’45.7” с.ш. 29°53’41.93” в.д. |
0,071±0,003 |
0,40±0,01 |
0,13±0,02 |
0,60±0,03 |
|
Руд 2 |
51°58’41.3” с.ш. 29°53’46.86” в.д. |
0,075±0,003 |
0,38±0,01 |
0,12±0,06 |
0,58±0,03 |
|
Гнезд |
51°38’58.09” с.ш. 29°48’25.96” в.д. |
0,19*▲±0,01 |
0,89*▲±0,06 |
0,38*▲±0,07 |
1,46*▲±0,10 |
|
Мас |
51°30’27.86” с.ш. 30°1’49.3” в.д. |
2,00*▲±0,036 |
10,73*▲±0,9 |
3,57*▲±0,25 |
16,30*▲±0,27 |
|
Кул |
51°33’16.88” с.ш. 30°13’36.48” в.д. |
7,3*▲±0,26 |
16,35*▲±0,7 |
0,98*▲±0,17 |
24,63*▲±0,7 |
* – значимые различия с контрольным участком Руд 1, p<0,05;
▲ – значимые различия с контрольным участком Руд 2, p<0,05.
Анализ концентраций фитогормонов . Навеску хвои массой 400 мг гомогенизировали в жидком азоте, экстракцию проводили 1,5 мл подкисленного (pH 3,5) 80% метанола (HPLC Gradient Grade, T.J. Baker, Нидерланды). Концентрации индолилуксусной кислоты (ИУК), индо-лилмасляной кислоты (ИМК), зеатина и абсцизовой кислоты (АБК) были оценены методом высокоэффективной жидкостной хроматографии на приборе Shimadzu LC-30 Nexera (Япония). Подробная методика выделения и определения основных классов фитогормонов в хвое сосны представлена в [9].
Статистический анализ данных . Данные обрабатывали методами непараметрической статистики с помощью программ MS Excel и STATISTICA 10. Экспериментальные выборки были проверены на наличие выбросов, которые исключали из дальнейшего анализа. Аномальными считали значения, которые выходили за пределы 1,5 межквартильных размахов от ближайшего квартиля. Статистическую значимость различий оценивали с помощью U-теста Манна-Уитни. На рисунках представлены медианы (М), минимальные и максимальные значения, первые (Q1) и третьи (Q3) квартили. Для оценки связи между показателями использовали коэффициент ранговой корреляции Спирмена.
Результаты и обсуждение
Хроматографический анализ выявил повышенные концентрации основного ауксина ИУК в хвое хронически облучаемых сосен на участке Гнезд по сравнению с контрольным Руд 2 (рис. 1А). На других загрязнённых участках концентрации ИУК не отличались от контрольных. Уровни другого ауксина ИМК характеризовались значительной биологической вариабельностью, в том числе значимо различались на контрольных участках (рис. 1Б). Статистически значимое снижение концентраций ИМК было выявлено на самом загрязнённом участке Кул относительно контроля Руд 1. Ауксины, являясь важнейшими регуляторами роста и развития растений, контролируют полярное развитие растения, апикальное доминирование, дифференцировку, растяжение (кислый рост) и деление клеток, стимулируют развитие корневой системы и работу ионных каналов [10]. В неблагоприятных условиях снижение интенсивности ростовых процессов и формирование устойчивости достигаются за счёт инактивации и окислительной деградации ауксинов, ослабления передачи сигналов и нарушений полярного транспорта [11, 12]. Нами не выявлено связи между изменением уровней ауксинов в хвое изученных сосен и уровнями радиоактивного загрязнения на участках (рис. 1). Принимая во внимание разницу между контрольными значениями, можно предположить, что статистически значимые различия концентраций ауксинов с одним из контролей являются результатом значительной биологической вариабельности природных популяций и влияния иных факторов нерадиационной природы.
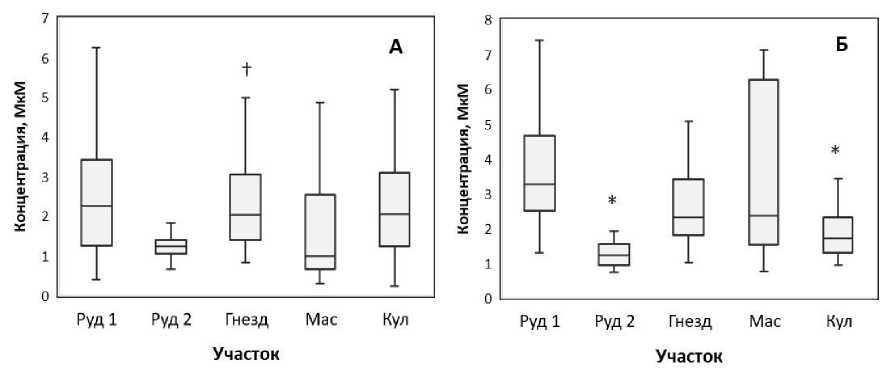
Рис. 1. Концентрации ауксинов (А – ИУК, Б – ИМК) в хвое хронически облучаемых сосен в зависимости от экспериментального участка.
* – различия статистически значимы по сравнению с контролем Руд 1, p<0,05, U-тест;
† – различия статистически значимы по сравнению с контролем Руд 2, p<0,05, U-тест.
Уровни зеатина существенно не изменялись в хвое сосен с загрязнённых участков по сравнению с контрольными (рис. 2А). Только на самом загрязнённом участке значение медианы по данному показателю было значимо выше по сравнению с контролем Руд 1. Основными функциями цитокининов, к которым относят зеатин, являются контроль клеточного цикла и стимуляция деления клеток [13]. Помимо этого, они препятствуют старению растений, подавляя разложение хлорофилла, нуклеиновых кислот, белков и других веществ [14]. Повышение концентраций зеатина на самом загрязнённом участке может указывать на компенсаторное увеличение пролиферативной активности в исследуемых тканях и активацию защитных механизмов организма.
Обнаружена отрицательная связь (r=-0,90, p<0,05) между концентрациями ИУК и зеатина в хвое изучаемых сосен. Учитывая то, что физиологические эффекты фитогормонов в значительной степени зависят от их баланса, отрицательная связь между концентрациями ИУК и зеатина свидетельствует о перекрестных механизмах, регулирующих их метаболизм [15]. Ауксины могут снижать пул активных цитокининов, главным образом зеатина, подавляя биосинтез через изо-пентениладенозин-5'-монофосфат-независимый путь [16]. Наоборот, у мутантных растений риса с нокаутированным геном цитокининоксидазы, катализирующей необратимую деградацию цитокининов, накопление цитокининов приводило к снижению уровней ИУК [17].
АБК выполняет в растении множество важных функций, одной из ключевых является контроль ответа на разнообразные стрессы [18]. В неблагоприятных условиях основной «гормон стресса» АБК запускает важнейшие адаптивные реакции растений - замедление роста, снижение транспирации, синтез стрессовых белков и др., приводящие к формированию неспецифической устойчивости [19]. Нами не выявлено изменений концентраций АБК в хвое хронически облучаемых сосен (рис. 2Б).
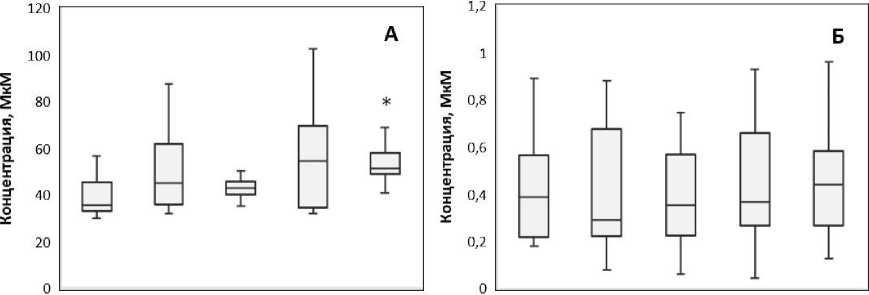
Руд 1 Руд 2 Гнезд Мас Кул Руд 1 Руд 2 Гнезд Мас Кул
Участок Участок
Рис. 2. Концентрации А - зеатина и Б - АБК в хвое хронически облучаемых сосен в зависимости от экспериментального участка.
* - различия статистически значимы по сравнению с контролем Руд 1, p<0,05, U-тест.
Результаты настоящей работы не согласуются с ранее полученными при исследовании популяций красной японской сосны в зоне аварии на АЭС Фукусима [9], где было выявлено повышение концентраций ИУК, зеатина и АБК в хвое сосен с загрязнённых участков (3,5-6,5 мкГр/ч) относительно контрольного. Рост концентраций ИУК в популяциях красной японской сосны был сопряжён с увеличением мощности дозы на участках (r=0,95, p<0,05). Вероятными причинами различия результатов являются видовые особенности сосен и разная возрастная структура популяций. Метаболические процессы, сопряжённые с работой гормональной системы, вероятно протекают интенсивнее у молодых сосен из зоны аварии на АЭС Фукусима, чей средний возраст на момент пробоотбора составлял 5-8 лет, чем у почти в 5 раз более старших деревьев сосны обыкновенной из Чернобыльской зоны отчуждения. К тому же наиболее уязвимый ранний период формирования проростков сосен фукусимской популяции пришёлся именно на год аварии или в ближайший период после неё, в то время как сосны белорусских популяций подверглись острому облучению в момент аварии будучи уже сформированными в возрасте около 4 лет. Согласно правилу Бергонье-Трибондо [20] наиболее радиочувствительными являются недифференцированные клетки, которые активно делятся и метаболизируют.
Заключение
Таким образом, в хвое сосны обыкновенной, произрастающей на загрязнённых после аварии на ЧАЭС территориях, не выявлено существенных изменений в концентрациях ауксинов, зеатина и стрессового гормона АБК в зависимости от радиационного воздействия. Различия в реакции на хроническое облучение гормональных систем красной японской сосны и сосны обыкновенной могут быть связаны как с присущими им видовыми различиями, так и с тем, что у молодых деревьев красной японской сосны гормональные процессы протекают гораздо более активно, чем у почти в 5 раз более старших деревьев сосны обыкновенной.
Работа выполнена при поддержке Российского научного фонда (проект № 21-16-00004).
Список литературы Влияние хронического облучения на фитогормональный статус сосен Чернобыльской зоны отчуждения
- Caplin N., Willey N. Ionizing radiation, higher plants, and radioprotection: from acute high doses to chronic low doses //Front. Plant Sci. 2018. V. 9. P. 847. DOI: 10.3389/fpls.2018.00847.
- Geras'kin S., Evseeva T., Oudalova A. Effects of long-term chronic exposure to radionuclides in plants populations //J. Environ. Radioact. 2013. V. 121. P. 22-32.
- Davies P.J. Plant hormones: biosynthesis, signal transduction, action! Dordrecht, The Netherlands: Kluwer Academic Publishers, 2004. 750 p.
- Peleg Z., Blumwald E. Hormone balance and abiotic stress tolerance in crop plants //Curr. Opin. Plant Biol. 2011. V. 14, N 3. P. 290-295.
- Nguyen D., Rieu I., Mariani C., van Dam N. M. How plants handle multiple stresses: hormonal interactions underlying responses to abiotic stress and insect herbivory //Plant Mol. Biol. 2016. V. 91. P. 727-740.
- ICRP, 2007. The 2007 Recommendations of the International Commission on Radiological Protection. ICRP Publication 103 //Ann. ICRP. 2007. V. 37, N 2-4. P. 1-332.
- The ERICA Tool (version 2.0). [Электронный ресурс]. URL: http://www.erica-tool.com/.
- Переволоцкая Т.В., Переволоцкий А.Н., Гераськин С.А. Ретроспективная оценка формирования радиационной обстановки в сосновых насаждениях в первый год после аварийных выпадений ЧАЭС //Радиационная биология. Радиоэкология. 2022. Т. 62, № 3. С. 295-307.
- Битаришвили С.В., Гераськин С.А., Йощенко В.И., Празян А.А., Нанба К. Изменение фитогормонального статуса красной японской сосны после аварии на АЭС Фукусима //Экология. 2021. № 2. С. 93-102.
- Woodward A.W., Bartel B. Auxin: regulation, action, and interaction //Ann. Bot. 2005. V. 95, N 5. P. 707-735.
- Xia X.J., Zhou Y.H., Shi K., Zhou J., Foyer C.H., Yu J.Q. Interplay between reactive oxygen species and hormones in the control of plant development and stress tolerance //J. Exp. Bot. 2015. V. 66, N 10. P. 2839-2856.
- Sharma E., Sharma R., Borah P., Jain M. Emerging roles of auxin in abiotic stress responses. In: Elucidation of Abiotic Stress Signaling in Plants. New York: Springer, 2015. P. 299-328.
- Sakakibara H. Cytokinins: activity, biosynthesis, and translocation //Annu. Rev. Plant Biol. 2006. V. 57. P. 431-449.
- Honig M., Plihalova L., Husickova A., Nisler J., Dolezal K. Role of cytokinins in senescence, antioxidant defence and photosynthesis //Int. J. Mol. Sci. 2018. V. 19, N 12. P. 4045. DOI: 10.3390/ijms19124045.
- Jones B., Ljung K. Auxin and cytokinin regulate each other's levels via a metabolic feedback loop //Plant Signal. Behav. 2011. V. 6, N 6. P. 901-904.
- Nordström A., Tarkowski P., Tarkowska D., Norbaek R., Astot C., Dolezal K., Sandberg G. Auxin regulation of cytokinin biosynthesis in Arabidopsis thaliana: A factor of potential importance for auxin-cytokinin-regulated development //PNAS. 2004. V. 101, N 21. P. 8039-8044.
- Joshi R., Sahoo K.K., Tripathi A.K., Kumar R., Gupta B.K., Pareek A., Singla-Pareek S.L. Knockdown of an inflorescence meristem-specific cytokinin oxidase - OsCKX2 in rice reduces yield penalty under salinity stress condition //Plant Cell Environ. 2018. V. 41, N 5. P. 936-946.
- Nakashima K., Yamaguchi-Shinozaki K. ABA signaling in stress-response and seed development //Plant Cell Rep. 2013. V. 32, N 7. P. 959-970.
- Vishwakarma K., Upadhyay N., Kumar N., Yadav G., Singh J., Mishra R.K., Kumar V., Verma R., Upadh-yay R.G., Pandey M., Sharma S. Abscisic acid signaling and abiotic stress tolerance in plants: a review on current knowledge and future prospects //Front. Plant Sci. 2017. V. 8. P. 161. DOI: 10.3389/fpls.2017.00161.
- Bergonie J., Tribondeau L. De quelques resultats de la radiotherapie et essai de fixation d'une technique rationnelle //Comptes Rendus des Seances de l'Academie des Sciences. 1906. V. 143. P. 983-985.


