Влияние импульсно-периодического рентгеновского излучения на клетки опухоли и костного мозга мышей
Автор: Булдаков М.А., Литвяков Н.В., Климов И.А., Кутенков О.П., Мельников А.А., Большаков М.А., Ростов В.В., Чердынцева Н.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (65), 2014 года.
Бесплатный доступ
Представлены результаты изучения влияния импульсно-периодического рентгеновского излучения (ИПРИ), генерируемого уникальным источником «Синус-150» (Институт сильноточной электроники СО РАН, г. Томск), на опухолевые и нормальные клетки. Изучали хромосомные аберрации (метафазный анализ) клеток костного мозга мышей, облученных ИПРИ в режимах, обеспечивающих противоопухолевый эффект. На культурах клеток карциномы Льюис, облученных ИПРИ, оценивали уровень апоптоза клеток и клеток с высоким содержанием активных форм кислорода (АФК) методом проточной цитофлуориметрии (FACSCantoII, BD). При локальном облучении ИПРИ in vivo в режимах, вызывающих противоопухолевый эффект, наблюдается умеренное увеличение аберраций в хромосомах клеток костного мозга мышей. ИПРИ индуцирует процесс апоптотической гибели в клетках карциномы легких Льюис in vitro за счет продукции АФК. При этом в диапазоне 0,2-1,0 Гр не отмечается зависимости эффекта от дозы облучения. Полученные данные свидетельствуют о перспективности дальнейших исследований для обоснования использования ИПРИ в терапии опухолей.
Импульсно-периодическое рентгеновское излучение, хромосомные аберрации, апоптоз, костный мозг, экспериментальные опухоли
Короткий адрес: https://sciup.org/14056460
IDR: 14056460 | УДК: 616-006:576.32:535.3:612.419]-092.9
Текст научной статьи Влияние импульсно-периодического рентгеновского излучения на клетки опухоли и костного мозга мышей
В последние годы активно изучаются биологические эффекты низкодозового рентгеновского излучения, генерируемого в импульсно-периодическом режиме (ИПРИ). Оно активирует клеточные реакции, которые не регистрируются при использова- нии традиционных источников ионизирующего излучения в этом же диапазоне доз. В частности, было показано, что ИПРИ в зависимости от частоты повторения импульсов и мощности дозы индуцирует двухцепочечные разрывы ДНК в опухолевых клетках Т-лимфобластной лейкемии, оказывая при этом незначительное повреждающее действие на лимфоциты человека [2]. Также имеются различия в реакции изолированных гепатоцитов мышей на воздействие ИПРИ с различными комбинациями частотных и дозовых характеристик [4].
Нами ранее было показано, что наиболее выраженное подавление пролиферации опухолевых клеток in vitro , торможение роста солидной опухоли и процесса ее метастазирования у мышей наблюдаются при использовании поглощенных доз излучения от 0,1 до 0,7 Гр при различных режимах фракционирования дозы [6]. При этом открытым остается вопрос о механизмах гибели опухолевых клеток, а также о возможных побочных эффектах описанных режимов ИПРИ. Общепризнанными достоверными маркерами повреждающего (генотоксического) действия ионизирующих излучений являются хромосомные аберрации [11], формирующиеся вследствие адсорбции энергии внутри или вблизи молекулы ДНК [10] и накопления свободных радикалов [7].
Целью работы явилось исследование количества хромосомных аберраций в клетках костного мозга мышей, подвергнувшихся воздействию ИПРИ в различных режимах фракционирования дозы, а также выявление механизма гибели опухолевых клеток в культуре при указанном воздействии.
Материал и методы
Работа осуществлена с соблюдением этических принципов проведения медицинских исследований, изложенных в Хельсинкской декларации, получено разрешение локального этического комитета Томского НИИ онкологии. В качестве экспериментальной модели in vivo использовались здоровые мыши линии С57/Bl6 массой 18–20 г.
В эксперименте были созданы условия облучения животных, идентичные таковым в проведенных ранее исследованиях по оценке противоопухолевых эффектов ИПРИ in vivo (каждая группа животных состояла из 8 мышей) [1, 6]. Животные помещались в свинцовую камеру так, чтобы облучению подвергалась только задняя правая конечность, из которой в дальнейшем извлекали бедренную кость для получения клеток костного мозга. В качестве рентгеновского источника использовалась установка «Синус-150», разработанная в Институте сильноточной электроники СО РАН (г. Томск).
Длительность импульса составляла 4 нс, частота повторения импульсов – 10 мп/с, энергия электронов – 160 кэВ, ток пучка – 3,5 кА. Суммарные очаговые дозы составили 0,2; 0,5; 0,7; 1,0 Гр.
Для оценки хромосомных аберраций в клетках костного мозга мышей после облучения использовали общепринятый цитогенетический метод –ме-тафазный анализ. Хромосомный анализ проводили через 5 сут после воздействия на зашифрованных препаратах с помощью микроскопа Axioskop 50 («Carl Zeiss», Германия). Учитывали все типы хромосомных аберраций, распознаваемые на рутинно окрашенных препаратах: одиночные фрагменты, парные фрагменты, внутрихромосомные и межхромосомные обменные аберрации, полипоиди-зация. Пробелы и эндоредупликации в анализ не включали. Аберрантной считали клетку, имеющую одну и более хромосомных аберраций. Проводили учет аберраций хромосомного и хроматидного типов. Для изучения механизмов воздействия ИПРИ in vitro использовались опухолевые клетки карциномы легких Льюис, культивировавшиеся в среде RPMI-1640 с 10 % содержанием сыворотки. Оценивали количество апоптотических клеток и клеток с высоким содержанием активных форм кислорода (АФК) методом проточной цитофлуо-риметрии (FACSCantoII, BD, США).
Статистическую значимость различий между выборками оценивали при помощи критерия Манна–Уитни в программе Statistica 6.0.
Результаты исследования и обсуждение
На первом этапе была проведена оценка спонтанного мутирования хромосом в клетках костного мозга мышей. По данным анализа рутинно окрашенных метафаз уровень спонтанных мутаций хромосом составлял 0,41 ± 0,98 % (табл. 1, группа контроля), что согласуется с литературными данными, согласно которым частота аберрантных метафаз у интактных животных не превышает 2 % [3].
В ходе дальнейшего исследования был проведен анализ хромосомных аберраций в клетках красного костного мозга мышей линии С57/BL6 при локальном воздействии импульсно-периодического рентгеновского излучения в различных режимах фракционирования дозы. Использовали 3 режима фракционирования: однократное воздействие (0,7 Гр), двукратное облучение с перерывом в 4 дня (0,5 Гр) и четырехкратное облучение с перерывом
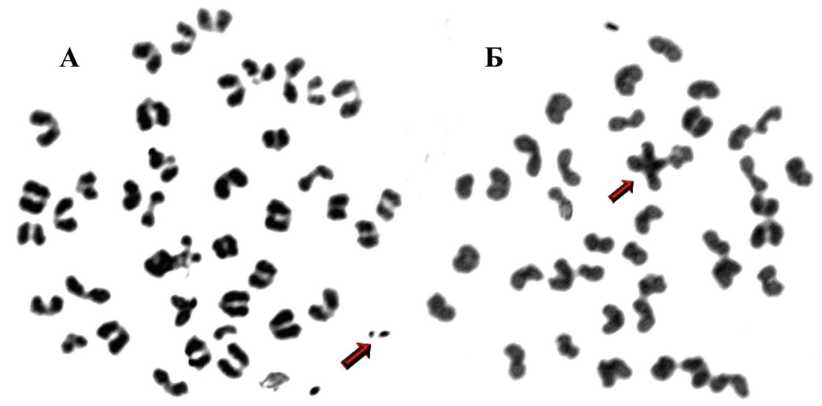
Рис. 1. Парный (ацентрический) фрагмент (указано стрелкой) хромосомы (А) и межхромосомный обмен по типу центрического слияния (Б) в клетках красного костного мозга мышей, подвергнутых воздействию импульсно-периодического рентгеновского излучения в режиме пятикратного фракционирования дозы (суммарная поглощенная доза 0,7 Гр)
в один день (0,7 Гр). Выбор указанных схем фракционирования основан на результатах, полученных нами ранее [6], и на данных литературы [8], согласно которым возможно разделение суммарной очаговой дозы на 2 или 4–5 фракций.
При оценке частоты и спектра хромосомных нарушений в клетках красного мозга мышей при воздействии ИПРИ показано, что преобладающими цитогенетическими аномалиями являются аберрации хромосомного типа (парные фрагменты, межхромосомные обмены). Наибольшая частота хромосомных мутаций наблюдается в группе с четырехкратным облучением до суммарной поглощенной дозы 0,7 Гр (см. табл. 1). Преобладающим типом хромосомных аберраций являются парные фрагменты, которые формируются в результате концевых делеций и при образовании обменных перестроек хромосом (рис. 1, А). В группах жи- вотных, подвергавшихся воздействию облучения при суммарной дозе 0,7 Гр, процент одиночных фрагментов и межхромосомных аберраций статистически значимо выше, чем в группе контрольных животных, что свидетельствует о видимых транслокационных и инверсионных преобразованиях хромосомного материала (рис. 1, Б).
Изменение общего количества аберрантных метафаз во всех исследуемых группах животных составляет не более 5 % по сравнению с группой контроля. В отношении спектра радиационно-индуцированных мутаций можно отметить, что ИПРИ вызывает главным образом аберрации хромосомного типа.
Следует отметить, что до настоящего времени не проводилось исследований мутагенных эффектов, индуцируемых в здоровых клетках воздействием ИПРИ в режимах, обусловливающих высокое
Таблица 1
Частота и спектр цитогенетических нарушений в клетках красного костного мозга мышей линии С57/bl6 при облучении ИПрИ с наиболее выраженными повреждающими характеристиками
|
Режим воздействия |
Спектр структурных и числовых нарушений хромосом |
AM |
||||
|
SF |
PF |
OA |
IA |
P |
||
|
Группа контроля |
0,12 ± 0,06 % |
0,07 ± 0,04 % |
0,07 ± 0,04 % |
0,04 ± 0,04 % |
0,10 ± 0,05 % |
0,41 ± 0,98 % |
|
0,5 Гр, 2-кратно |
0,83 ± 0,14 % |
0,91 ± 0,09 %* |
0,20 ± 0,07 % |
0,31 ± 0,12 %* |
0,39 ± 0,04 %* |
2,58 ± 0,18 %* |
|
0,7 Гр, однократно |
1,21 ± 0,39 %* |
0,44 ± 0,20 %* |
0,31 ± 0,02 %* |
0,11 ± 0,07 % |
0,09 ± 0,06 % |
2,09 ± 0,17 %* |
|
0,7 Гр, 4-кратно |
1,02 ± 0,17 %* |
1,89 ± 0,38 %* |
1,24 ± 0,05 %* |
0,86 ± 0,10 %* |
0,64 ± 0,20 %* |
5,53 ± 0,47 %* |
Примечание: SF – одиночные фрагменты; PF – парные фрагменты; OA – межхромосомные обменные аберрации; IA – внутрихромосомные обменные аберрации; Р – полиплоидия; АМ – аберрантные метафазы; количество исследованных метафазных пластинок составляет в среднем 2000 на каждую группу; * – различия статистически значимы по сравнению с контрольной группой (p<0,05).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2014. № 5
противоопухолевое действие. Наиболее близкие к нашим результаты были получены с использованием импульсного протонного излучения в дозах 4 и 8 Гр [13]. Общее число дицентриков, центрических колец и ацентриков увеличивается по отношению к контрольной группе. Согласно другим данным, рентгеновское излучение в неимпульсном режиме приводит к формированию всех типов аберраций хромосом у мышей при их тотальном облучении в дозах 0,1 и 1 Гр, в то время как при облучении животных в дозе 0,05 Гр этот эффект отсутствует [12].
Таким образом, использование режимов ИПРИ, позволяющих получить значительный противоопухолевый и антиметастатический эффект при локальном облучении животных in vivo , приводит к увеличению аберраций в хромосомах клеток костного мозга здоровых мышей.
В исследованиях in vitro на культуре опухолевых клеток карциномы легких Льюис было показано, что ИПРИ приводит к гибели клеток за счет активации механизма апоптотической гибели. Так, через 24 ч после облучения доля клеток в состоянии апоптоза в среднем равнялась 35–40 %, тогда как в группе контроля этот показатель составлял 4 % (табл. 2). Зависимости апоптоз-индуцирующего действия ИПРИ от дозы не отмечено.
При исследовании уровня АФК в клетках карциномы легких Льюис через 2 ч после воздействия ИПРИ не отмечалось значимых изменений этого показателя по сравнению с контрольной группой (см. табл. 2). Однако через 6 ч после облучения уровень АФК в среднем увеличился на 30 % во всех исследуемых группах. При этом зависимости полученного эффекта от дозы ИПРИ не наблюдалось (см. табл. 2).
Отсутствие дозовой зависимости (увеличение эффекта при увеличении дозы) биологических эффектов ИПРИ для клеток карциномы легких Льюис согласуется с полученными ранее данными об изменении пролиферативной активности некоторых культур опухолевых клеток [5]. Очевидно, что импульсный режим воздействия обусловливает высокую эффективность рентгеновского излучения в диапазоне доз менее 1 Гр, поскольку для индукции апототической гибели неимпульсным рентгеновским излучением должны использоваться дозы более 1 Гр [9].
Участие АФК в индукции апоптотической гибели, индуцируемой неимпульсным рентгеновским излучением, известно давно [14]. Очевидно, что и импульсное воздействие активирует те же сигнальные пути, так как через 6 ч после воздействия ИПРИ уровень АФК увеличивается во всех исследуемых группах. Существенным различием является только доза, необходимая для реализации повреждающего действия.
Таким образом, ИПРИ индуцирует процесс апоптотической гибели в клетках карциномы легких Льюис in vitro за счет продукции АФК. При этом в диапазоне доз 0,2–1 Гр не отмечается зависимости по типу «доза–эффект». Выявлено умеренное генотоксическое действие «противоопухолевых» режимов ИПРИ на клетки костного мозга.
Работа поддержана грантом РФФИ № 13-0498115.


