Влияние индекса Глисона на выживаемость больных локализованным раком предстательной железы в Самарской области
Автор: Андреева Р.Д., Низамова Р.С., Корабельников А.С., Журкина О.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 2 (56), 2022 года.
Бесплатный доступ
Рак предстательной железы (РПЖ) находится на третьем месте по структуре смертности у мужчин. Наиболее значимым фактором, влияющим на тактику лечения и на вероятность прогрессии опухоли после радикального лечения, является степень злокачественности опухоли. Цель исследования: проанализировать влияние группы степени злокачественности аденокарциномы простаты на выживаемость больных локализованным формами на территории Самарской области. В исследование вошли пациенты с впервые диагностированным локализованным РПЖ на территории Самарской области за 2010-2016 гг. - 2535 человек, зарегистрированных в базе данных популяционного ракового регистра Самарского областного клинического онкологического диспансера. При анализе исследуемого показателя прослеживается зависимость общей и канцерспецифической выживаемости больных локализованным раком предстательной железы от степени злокачественности опухоли. У пациентов при увеличении степени злокачественности опухоли повышается риск смерти от рака простаты.
Рак предстательной железы, выживаемость, рак простаты промежуточного риска, степень злокачественности аденокарциномы простаты
Короткий адрес: https://sciup.org/143178584
IDR: 143178584 | УДК: 616.65-006-076(470.43)
Текст научной статьи Влияние индекса Глисона на выживаемость больных локализованным раком предстательной железы в Самарской области
УДК 616.65-006-076(470.43)
Рак предстательной железы (РПЖ) относится к наиболее распространенным злокачественным новообразованиям (ЗНО) у мужчин старше 60 лет в России и других странах СНГ [1]. В структуре смертности от всех онкологических причин, по данным ВОЗ, РПЖ занимает третье место в России (7,7 %) и в странах Европейского Союза после ЗНО органов дыхательной и пищеварительной систем, в то время как в США данный показатель выше и поднимается на вторую позицию [12]. По данным Южного научного центра РАН показатель заболеваемости раком предстательной железы в Российской Федерации с 2001 по 2016 гг. вырос в 3,0 раза (с 19,1 до 56,5 случаев на 100 тыс. населения) [5]. В связи с широким использованием скрининга простатспецифиче-ского антигена (PSA) число мужчин с выявленным РПЖ на ранних этапах увеличивается в развитых странах, включая Россию [14].
Для оценки эффективности лечения больных РПЖ основными критериями являются показатели общей и безрецидивной выживаемости. Анализируя последние, можно усовершенствовать организацию противораковой борьбы путем выявления групп риска развития заболевания, выбора наиболее оптимальных методов лечения и их индивидуализации [2]. При этом, большинство эпидемиологических исследований злокачественных опухолей в основном отражают показатели заболеваемости. Выживаемость больных РПЖ на популяционном уровне отражена в единичных работах [3, 4].
Градация ацинарной аденокарциномы предстательной железы по шкале Глисона во многом определяет тактику лечения больных, вероятность прогрессии после проведения простатэктомии, чувствительность к радиотерапии [6].
Прогноз и выбор тактики лечения РПЖ во многом зависят от результатов оценки степени злокачественности опухоли по шкале Глисона, которая получила признание во всем мире с момента ее введения более 50 лет назад. С 1966 г. произошли значительные изменения в ведении и диагностике РПЖ, включая скрининг простат-специфических антигенов, что привело к выявлению ранних форм неоплазии. Это привело к эволюции классификации Глисона. Значительные изменения были внесены в 2005 и 2014 гг. на основе консенсусных конференций, проведенных Международным обществом урологической патологии (International Society of Urological Pathology, ISUP).
По шкале Глисона аденокарцинома простаты оценивается в баллах (от 1 до 5) в зависимости от степени дифференцировки. Учитывая гетерогенность опухоли, для итогового определения степени гистологической злокачественности опухоли определяют сумму Глисона как сумму баллов первичного (наиболее распространенного) и вторичного по объему компонентов [7]. Первой группе соответствует опухоль с суммой баллов по шкале Глисона 2–6, 2-й-группе – опухоль с суммой баллов 7, при условии, что первичный балл (самый распространенный) 3, вторичный – 4. Сумма баллов в 3-й группе также 7, но с первичным баллом 4. Следующая, 4-я группа объединяет разную комбинацию слагаемых из баллов, в сумме составляющую 8. Сумма баллов в 5-й группе – 9–10 [9].
Карциному с суммой 7 баллов следует относить в отдельную категорию, учитывая ее промежуточный потенциал между раками с суммой 5–6 и 8–10 баллов [8]. Потенциал злокачественности 7 баллов по Глисону определяется различным сочетанием компонентов опухоли, чаще всего это структуры, оцениваемые в 3 и 4 балла. При этом, сумма, определяемая как 3 + 4, имеет более низкий злокачественный потенциал, чем сумма 4 + 3, что значительно влияет на определение преобладающего компонента [13, 15].
Согласно рекомендациям Европейского общества урологов адаптация современной системы ISUP с разделением РПЖ с индексом Глисона 7 баллов на группу 2 (основной паттерн 3 балла) и группу 3 (основной паттерн 4 балла), вследствие их различного прогностического значения, усиливает разделение РПЖ промежуточного риска на рак низкого промежуточного риска и высокого промежуточного риска [11, 13].
Цель исследования: проанализировать значение индекса Глисона (группы степени злокачественности аденокарциномы простаты) на выживаемость больных локализованным РПЖ на территории Самарской области.
Материал и методы
В исследование вошли все зарегистрированные пациенты за период 2010–2016 гг., с впервые установленным диагнозом РПЖ. Всего выявлено 7665 больных РПЖ. Количество больных локализованными формами составило 2535 пациентов, зарегистрированных в базе данных популяционного ракового регистра Самарского областного клинического онкологического диспансера. Средний возраст пациентов 69,7 года. Дата начала исследования – 1 января 2010 года, дата его окончания – 31 декабря 2019 года. В результате проделанной работы была создана база данных больных РПЖ (свидетельство ο регистрации базы данных «Факторы прогноза выживаемости больных раком предстательной железы на территории Самарской области» № 2021620262 от 11.02.2021 г.).
Степень злокачественности опухоли оценивалась в рамках рекомендаций согласительной конференции Международного общества уропатологов (ISUP) 2014 г. Все опухоли были поделены на пять групп в зависимости от индекса Глисона.
Формирование массива данных, и последующая их статистическая обработка проведена с помощью пакета SPSS 25 (IBM SPSS Statistics, США, лицензия № 5725-А54) и Microsoft Excel (Microsoft, США).
Для оценки времени до наступления неблагоприятного исхода (смерти от рака или смерти от любой другой причины), а также для сопоставления факторов, влияющих на смертность, строили кривые дожития Каплана – Мейера. Конечным состоянием при расчете общей выживаемости была смерть пациента вне зависимости от причины. При расчете канцерспецифической выживаемости конечной точкой послужило возникновение смерти пациента от прогрессии рака предстательной железы.
Для сравнения статистических показателей в группах исследования применялся лог-ранговый критерий. Критический уровень значимости (р) при проверке статистических гипотез принимался равным 0,05.
Результаты и обсуждение
Для оценки влияния группы степени злокачественности Международного общества уропатологов ISUP 2014 г. на общую и кан-церспецифическую выживаемости были построены одномерные модели на основе регрессионного анализа Кокса.
В таблице 1 показаны результаты построения одномерной модели относительного риска смерти от РПЖ в различных группах степени злокачественности опухоли.
Далее представлены результаты построения одномерной модели влияния степени злокачественности на канцерспецифическую выживаемость (табл. 2).
В одномерной моделе четко прослеживается зависимость общей и канцерспецифиче-ской выживаемости больных локализованным раком предстательной железы от степени злокачественности опухоли.
У пациентов при увеличении степени злокачественности опухоли повышается риск смерти от РПЖ (если во 2-й группе ОР – 1,23 (1,03–1,47), то в 5-й группе ОР – 2,67 (1,64–4,35), особенно исследуемый предиктор влияет на онкоспецифическую выживаемость (ОР – 1,60 (1,13–2,28); ОР – 7,80 (4,12–14,77) соответственно). При использовании лог-ран-гового теста установлена высокая степень достоверности различий (р = 0,008, р < 0,001).
Таблица 1. Характеристика потенциального предиктора – степени злокачественности аденокарциномы, влияющего на общую выживаемость больных локализованным раком предстательной железы (по данным регрессионного анализа пропорциональных рисков Кокса)
Table 1. Characterization of a potential predictor – the degree of malignancy of adenocarcinoma, affecting the overall survival of patients with localized prostate cancer (based on Cox proportional hazards regression analysis)
|
Предиктор |
Градация предиктора |
n |
ОР (95 % ДИ) |
р |
|
1 группа Gleason 2–6 |
1373 |
1 |
– |
|
|
Группы степени |
2 группа Gleason 7 (3+4) |
751 |
1,23 (1,03–1,47) |
0,023 |
|
злокачественности РПЖ |
3 группа |
167 |
1,44 (1,08–1,92) |
0,013 |
|
Международного общества |
Gleason 7 (4+3) |
|||
|
уропатологов (ISUP 2014 г.) |
4 группа Gleason 8 |
209 |
2,04 (1,52–2,74) |
< 0,001 |
|
5 группа Gleason 9–10 |
35 |
2,67 (1,64–4,35) |
< 0,001 |
Таблица 2. Характеристика потенциального предиктора – степени злокачественности аденокарциномы, влияющего на канцерспецифическую выживаемость больных локализованным раком предстательной железы (по данным регрессионного анализа пропорциональных рисков Кокса)
Table 2. Characterization of a potential predictor – the degree of malignancy of adenocarcinoma, affecting the cancerspecific survival of patients with localized prostate cancer (based on Cox proportional hazards regression analysis)
|
Предиктор |
Градация предиктора |
n |
ОР (95 % ДИ) |
р |
|
1 группа Gleason 2–6 |
1373 |
1 |
– |
|
|
Группы степени |
2 группа Gleason 7 (3+4) |
751 |
1,60 (1,13–2,28) |
0,008 |
|
злокачественности РПЖ |
3 группа |
167 |
1,43 (1,48–4,01) |
< 0,001 |
|
Международного общества |
Gleason 7 (4+3) |
|||
|
уропатологов (ISUP 2014 г.) |
4 группа Gleason 8 |
209 |
2,44 (1,37–4,34) |
0,002 |
|
5 группа Gleason 9–10 |
35 |
7,80 (4,12–14,77) |
< 0,001 |
На рисунке 1 представлены графики общей и канцерспецифической выживаемости в различных группах степени злокачественности опухоли, рассчитанные по Каплану – Мейеру.
Общая выживаемость в 1-й группе составила 81,0 %, с увеличением степени злокаче- ственности исследуемый показатель снизился в 5-й группе до 48,1 %. При изучении уровня канцерспецифической выживаемости значения оказались выше: в 1-й группе – 94,9 %, в 5-й группе составляла уже 63,2 %.
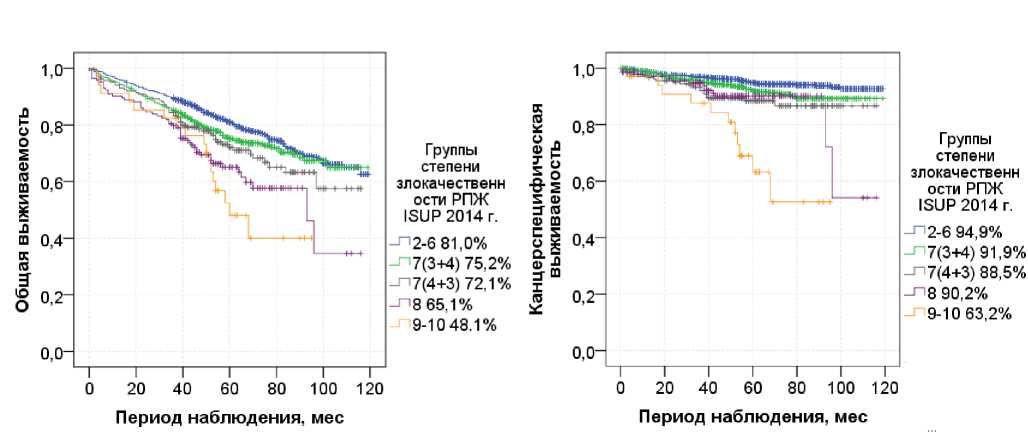
А
Б
Рисунок 1. Девятилетняя выживаемость больных локализованным РПЖ в исследуемых группах, рассчитанная по Каплану – Мейеру: А – общая; Б – канцерспецифическая
Figure 1. Nine-year survival of patients with localized prostate cancer in the study groups, calculated according to Kaplan – Meier: А – overall; В – cancer-specific
При проведении лог-рангового теста наблюдаются достоверные отличия при сравнении 1-й и 2-й группы (р = 0,008), при этом не обнаружены статистически значимые отличия (р = 0,105) при сравнении канцерспецифиче-ской выживаемости во 2-й (основной паттерн 3 балла) и 3-й группах степени злокачественности опухоли (основной паттерн 4 балла). Также необходимо отметить, что при сравнении выживаемости больных с опухолями 4 класса злокачественности со 2-й и 3-й группами не выявлено достоверных отличий (р = 0,152, р = 0,982, соответственно). Канцер-специфическая выживаемость в 5-й группе оказалась статистически значимо хуже, чем в других группах исследования (р = 0,002).
Для достижения наиболее эффективных результатов лечения рака предстательной железы недостаточно учитывать только лишь сумму Глисона и группу степени злокачественности опухоли, для этого необходим комплексный подход с учетом процента и объема поражения в биоптате, уровня и соотношения форм простатспецифического антигена, возраста пациента и дополнительных параметров. РПЖ характеризуется различным прогнозом и, соответственно, различными подходами к лечению с учетом стратификации групп риска прогрессии заболевания (табл. 3).
Таблица 3. Влияние группы риска прогрессии РПЖ на канцерспецифическую выживаемость больных локализованным раком предстательной железы (по данным регрессионного анализа пропорциональных рисков Кокса)
Table 3. Influence of the risk group for prostate cancer progression on cancer-specific survival of patients with localized prostate cancer (based on Cox proportional hazards regression analysis)
|
Предиктор |
Градация предиктора ОР (95 % ДИ) р РПЖ низкого риска прогрессии 1 – Gleason 2-6, референс |
|
Группы риска прогрессии РПЖ |
РПЖ промежуточного риска 2,16 (1,29–3,62) 0,003 Gleason 7 (3+4) РПЖ промежуточного риска 2,40 (1,02–5,67) 0,046 Gleason 7 (4+3) РПЖ высокого риска прогрессирования 3,88 (2,16-6,95) < 0,001 Gleason > 8 |
Множество разногласий встречается при выборе оптимального лечения для пациентов промежуточной группы риска [13]. По данным некоторых авторов относительный риск рецидива рака предстательной железы для 2, 3, 4, 5-й групп степени злокачественности относительно 1-й группы составляет 1,9; 5,1; 8,0 и 11,7 соответственно [10]. Поэтому, выявление предикторов, влияющих на выживаемость данной когорты пациентов, является актуальной проблемой, требующей более детального рассмотрения.
Заключение
Таким образом, результаты проведенного исследования доказывают, что степень злокачественности опухоли является статистически значимым прогностическим критерием. Опухоли с меньшим индексом Глисона выступают независимым фактором в пользу лучшей выживаемости, а с увеличением исследуемого показателя прогноз заболевания ухудшается.
Список литературы Влияние индекса Глисона на выживаемость больных локализованным раком предстательной железы в Самарской области
- Аллина Д.О., Андреева Ю.Ю., Завалишина Л.Э. и др. FASN в диагностике новообразований предстательной железы. Архив патологии. 2017;79(2):10-14. [Allina D.O., Andreeva Yu.Yu., Zavalishina L.E. et al. FASN in the diagnosis of prostate neoplasms. Archive of pathology. 2017;79(2):10-14. (In Russ)].
- Андреева Р.Д., Низамова Р.С., Андреев А.А. Динамика выживаемости больных раком предстательной железы на популяционном уровне с учетом стадии заболевания и места проживания. Онкоурология. 2020;16(4):120-8. [Andreeva R.D., Nizamova R.S., Andreev A.A. Dynamics of the survival rate of patients with prostate cancer at the population level, taking into account the stage of the disease and place of residence. Urology. Oncology. 2020;16 (4):120-8 (In Russ)]. https://doi.org/10.17650/1726-9776-2020-16-4-120-128
- Андреева Р.Д., Низамова Р.С., Андреев А.А. Оценка показателей выживаемости пациентов со злокачественными опухолями предстательной железы в Cамарской области. Аспирантский вестник Поволжья. 2019;5-6:98-103. [Andreeva R.D., Nizamova R.S., Andreev A.A. Estimation of survival rates of patients with malignant prostate tumors in the Samara region. Post-graduate bulletin of the Volga region. 2019;5-6:98-103. (In Russ)]. https://doi.org/10.17816/2072-2354.2019.19.3.98-103
- Андреева Р.Д., Низамова Р.С. Состояние онкологической помощи больным раком предстательной железы на территории Самарской области в зависимости от возраста и метода лечения. Аспирантский вестник Поволжья. 2020;5-6:119-124. [Andreeva R.D., Nizamova R.S. The state of cancer care for patients with prostate cancer on the territory of the Samara region, depending on age and method of treatment. Post-graduate bulletin of the Volga region. 2020;5-6:119-124. (In Russ)]. https://doi.org/10.17816/2072-2354.2020.20.3.119-124
- Архипова О.Е., Черногубова Е.А. Анализ заболеваемости раком предстательной железы в Ростовской области за 2001-2016 гг.: пространственно-временная статистика. Вестник урологии. 2017;5(4): 13-21. [Arhipova O.E., CHernogubova E.A. Analysis of prostate cancer incidence in the Rostov region for 2001-2016: spatio-temporal statistics. Urology Bulletin. 2017;5(4):13-21. (In Russ)].
- Волченко Н.Н., Каприн А.Д., Беляков М.М., Петров А.Н. Сравнительный анализ степени дифференци-ровки рака предстательной железы на биопсийном и операционном материалах. Онкология. Журнал им. П.А. Герцена. 2016;5(1):18-22. [Volchenko N.N., Kaprin A.D., Belyakov M.M., Petrov A.N. Comparative analysis of the degree of prostate cancer differentiators on biopsy and operational materials. Oncology. Magazine named after P.A. Herzen. 2016;5(1):18-22 (In Russ)]. https://doi.org/10.17116/onkolog20165118-22
- Смирнов А.В., Перлин Д.В., Экова М.Р., Гуров Д.Ю., Александрова Л.И., Замараев В.С., Самусев Р.П., Рогова Л.Н. Диагностическая информативность иммуногистохимических биомаркеров при проведении пато-логоанатомического исследования рака простаты. ВестникВолжскогоГМУ. 2019;1(69):51-54. [Smirnov A.V., Perlin D.V., Ekova M.R., Gurov D.YU., Aleksandrova L.I., Zamaraev V.S., Samusev R.P., Rogova L.N. Diagnostic informativity of immunohistochemical biomarkers in carrying out a pathologictomomic study of prostate cancer. Bulletin of the Volga State Medical University. 2019;1(69):51-54. (In Russ)]. https://doi.org/10.19163/1994-9480-2019-1(69)-55-58
- Egevad L, Granfors T, Karlberg L, Bergh A, Stattin P. Prognostic value of the Gleason score in prostate cancer. BJU Int. 2002;89(6):538-542. https://doi.org/10.1046/j. 1464-410x.2002.02669
- Epstein J.I. et al. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg Pathol. 2016;40:244. https://www.ncbi.nlm.nih.gov/pubmed/26492179
- Epstein J.I. et al. A Contemporary Prostate Cancer Grading System: A Validated Alternative to the Gleason Score. Eur Urol. 2016;69:428. https://www.ncbi.nlm.nih.gov/pubmed/26166626
- Gulati R. et al. Screening Men at Increased Risk for Prostate Cancer Diagnosis: Model Estimates of Benefits and Harms. Cancer Epidemiol Biomarkers Prev. 2017;26:222. https://www.ncbi.nlm.nih.gov/pubmed/27742670
- Heidenreich A., Bastian P.J., Bellmunt J. et al. EAU guidelines on prostate cancer. Part 1: Screening, diagnosis, and local treatment with curative intent-update 2013. Eur. Urol. 2014;65:124-137.
- Kane C.J. et al. Variability in Outcomes for Patients with Intermediate-risk Prostate Cancer (Gleason Score 7, International Society of Urological Pathology Gleason Group 2-3) and Implications for Risk Stratification: A Systematic Review. Eur Urol Focus. 2017;3:487. https://www.ncbi.nlm.nih.gov/pubmed/28753804
- Sano F., Uemura H. The Utility and Limitations of Contrast-Enhanced Ultrasound for the Diagnosis and Treatment of Prostate Cancer. Sensors. 2015;15:4947-4957.
- Stark J, Perner S, Stampfer M et al. Gleason score and lethal prostate cancer: does 3+4=4+3? J Clin Oncol. 2009;27(21):3459-3464.


