Влияние индукторов холестеролоксидазной активности клеток родококков на процесс биоконверсии β-ситостерола
Автор: Ноговицина Е.М., Гришко В.В., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 10, 2009 года.
Бесплатный доступ
Исследована возможность индукции холестеролоксидазной активности родококков в отношении ??-ситостерола. Показано, что холестеролоксидазная реакция более эффективно катализируется родококками в присутствии алифатических кислот, что приводит к увеличению степени образования стигмаст-4-ен-3-она из -ситостерола. Так, в присутствии пальмитиновой кислоты родококки катализируют образование стигмаст-4-ен- 3-она до 55 %.
Короткий адрес: https://sciup.org/147204448
IDR: 147204448 | УДК: 57.088.6+577.175.62
Текст научной статьи Влияние индукторов холестеролоксидазной активности клеток родококков на процесс биоконверсии β-ситостерола
ВЛИЯНИЕ ИНДУКТОРОВ
ХОЛЕСТЕРОЛОКСИДАЗНОЙ АКТИВНОСТИ
КЛЕТОК РОДОКОККОВ НА ПРОЦЕСС БИОКОНВЕРСИИ β-СИТОСТЕРОЛА
Е.М. Ноговицинаa, В.В. Гришкоb, И.Б. Ившина a,c aИнститут экологии и генетики микроорганизмов УрО РАН, 614081, Пермь, ул. Голева, 13 bИнститут технической химии УрО РАН, 614013, Пермь, ул. Академика Королева, 3 cПермский государственный университет, 614990, Пермь, ул. Букирева, 15
Исследована возможность индукции холестеролоксидазной активности родококков в отношении β -ситостерола. Показано, что холестеролоксидазная реакция более эффективно катализируется родококками в присутствии алифатических кислот, что приводит к увеличению степени образования стигмаст-4-ен-3-она из β-ситостерола. Так, в присутствии пальмитиновой кислоты родококки катализируют образование стигмаст-4-ен-3-она до 55 %.
Для получения оксигенированных стеролов и андростановых производных на основе доступных стериновых спиртов растительного, животного и микробного происхождения наиболее перспективно использование интактных клеток микроорганизмов, катализирующих реакции окисления с высокой степенью регио- и стереоселективности. В настоящее время выделены и охарактеризованы ферменты микроорганизмов, ответственные за синтез ключевых продуктов процесса биотрансформации стеролов. На первом этапе окислительной трансформации стеролов с помощью бактериальных клеток образуются 4-ен-3-оновые производные (рис. 1), синтез которых катализируется бифункциональным ферментом - холестеролокси-дазой (Toyama et.al, 2002). На основе данной реакции разработан ферментативный метод диагностики уровня холестерола в биологических жидкостях и современные технологии переработки холесте-ролсодержащего сырья в диетические продукты посредством превращения холестерола в холест-4-ен-3-он (MacLachlan et al., 2000). Обоснована возможность использования стигмаст-4-ен-3-она, образующегося при окислении холестеролоксидазой растительного β-ситостерола, в качестве лекарственного средства при лечении эндокринных заболеваний ( Streber, 1993).
Ранее нами было установлено, что родококки, обладающие способностью трансформировать широкий спектр труднодоступных для других микроорганизмов органических субстратов, являются эффективными катализаторами процесса биоконверсии β-ситостерола. Определены оптимальные условия процесса биотрансформации β-ситостерола в стигмаст-4-ен-3-он клетками ро-дококков, предполагающие использование изо- пропанола в качестве растворителя данного стерола, ростового субстрата н-гексадекана и представителей R. ruber как наиболее эффективных биокатализаторов процесса конверсии β-ситостерола (ившина и др., 2005; ноговицины и др., 2007).
Цель настоящей работы – поиск новых альтернативных методов повышения эффективности процесса биоконверсии β-ситостерола в стигмаст-4-ен-3-он клетками родококков.
Материалы и методы
В работе использовали штаммы R. erythropolis ИЭГМ 487 и R. ruber ИЭГМ 233 из Региональной профилированной коллекции алканотрофных микроорганизмов ИЭГМ (Каталог …, 1994; . Клетки родококков выращивали в условиях периодического культивирования в колбах Эрленмейера объемом 250 мл на орбитальных шейкерах (150 об/мин) при температуре 28оС. Базовый состав минеральной среды включал следующие компоненты (г/л): KNO3 – 1,0; KH2PO4 – 1,0; K2HPO4 × 3H2O – 1,0; NaCl – 1,0; MgSO4 × 7H2O – 0,2; СaCl2 × 2H2O – 0,02 (Каталог …, 1994). В среду добавляли 1 г/л дрожжевого экстракта, 0,1 об.% микроэлементов по Постгейту (Романенко, Кузнецов, 1974). В различных экспериментах β-ситостерол (0,5 г/л) вводили одновременно с внесением культуры или через 1-3 сут роста бактериальных клеток в 5,0 мл изопропанола. В ростовую среду дополнительно вносили 0,79 мМ н-декана, н-ундекана, н-додекана, н-гексадекана или н-октадекана, а также декановой, ундекановой, лауриновой, тридекановой, пентадекановой, пальмитиновой или стеариновой ки-
слот в 1 мл изопропанола. При проведении экспериментов по биотрансформации β-ситостерола в соокислительных условиях в качестве ростового субстрата в базовую минеральную среду добавляли 0,1 об. % н -гексадекана. В качестве посевного материала использовали родококки (5,0 х 105 кле-ток/мл), выращенные на мясопептонном агаре и отобранные в экспоненциальной фазе роста.
Продукты бактериального окисления экстрагировали этиловым эфиром уксусной кислоты. Объединенные этилацетатные вытяжки промывали насыщенным водным раствором NaCl, высушивали с помощью обезвоженного Na2SO4. Растворитель удаляли в вакууме роторного испарителя. Образование стигмаст-4-ен-3-она контролировали методом тонкослойной хроматографии на силикагеле с использованием флуоресцентных пластин (Merck, Германия) и ультрафиолетовой лампы КФ-4М (Россия). Экспрессное определение содержания β-ситостерола в культуральной жидкости проводили ферментативным методом ( Allain et al., 1974) с детекцией при 500 нм на спектрофотометре Lambda EZ201 (Perkin-Elmer, США). При этом использовали коммерческую тест-систему контроля уровня холестерола (ООО «Ольвекс Диагности-кум», Санкт-Петербург). Количественный анализ продуктов биотрансформации β-ситостерола осуществляли методом УФ-спектроскопии на спектрофотометре Lambda EZ201 (Perkin-Elmer, США). Для определения содержания стигмаст-4-ен-3-она 1 мг пробы растворяли в 1 мл этанола. Величину абсорбции полученных растворов измеряли при длине волны 240 нм, при расчетах учитывали коэффициент экстинкции целевого продукта (ε) – 12,2∙103 М-1см-1 ( Kreit et al., 1994).
Статистическую обработку полученных результатов осуществляли с использованием компьютерной программы Excel 2003, рассчитывая среднее арифметическое и стандартную ошибку. Все эксперименты проводили в 3 кратной повторности.
Результаты и их обсуждение
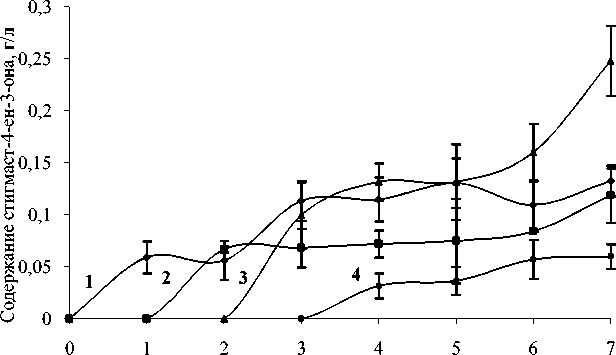
На рис. 2. приведены данные исследования динамики образования стигмаст-4-ен-3-она R. ruber ИЭГМ 233 в присутствии н- гексадекана. Установлено, что максимальная (0,25 г/л) степень образования стигмаст-4-ен-3-она достигается в условиях добавления стерола через 2 сут от начала эксперимента.
Известно (Halpern, 1981), что в качестве индукторов холестеролоксидазной активности микроорганизмов наряду с н -алканами применяются алифатические кислоты в свободном или связанном виде. При исследовании влияния свободных органических кислот на эффективность холестеролок-сидазной реакции использовали штамм R. erythropolis ИЭГМ 487, катализирующий в присутствии н -алканов образование стигмаст-4-ен-3-она в количестве лишь 7,0-11,6 % (табл. 1).
HO
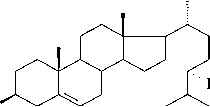
Холестерол (R = H)
Кампестерол (R = CH3) β -Ситостерол (R = C2H 5 )
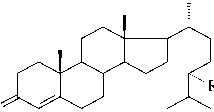
Холест-4-ен-3-он (R = H) Кампест-4-ен-3-он (R = CH 3 ) Стигмаст-4-ен-3-он (R = C2H5)
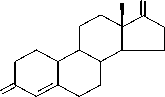
Андрост-4-ен-3,17-дион
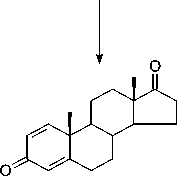
Андроста-1,4-диен-3,17-дион
Рис. 1. Основные пути биотрансформации стеролов бактериальными клетками Mycobacterium spp.; Rhodococcus spp.; Moraxella spp. и др. (по. Fernandes et al., 2003)
Таблица 1
Биотрансформация β-ситостерола R. erythropolis ИЭГМ 487 в присутствии углеводородов
|
Индуктор |
Сумма продуктов реакции, г/л |
Содержание в сумме продуктов реакции, г/л |
|
|
β-Ситостерола * |
Стигмаст-4-ен-3-она |
||
|
Без добавления индукторов (контроль) |
0,55 ± 0,002 |
0,48 ± 0,001 |
0,06 ± 0,008 (10,9)* * |
|
н -Декан (С 10 ) |
0,33 ± 0,105 |
0,25 ± 0,014 |
0,04 ± 0,006 (11,6) |
|
н -Ундекан (С 11 ) |
0,44 ± 0,024 |
0,38 ± 0,006 |
0,05 ± 0,005 (11,4) |
|
н -Додекан (С 12 ) |
0,28 ± 0,071 |
0,22 ± 0,004 |
0,04 ± 0,004 (11,4) |
|
н -Гексадекан (С 16 ) |
0,39 ± 0,050 |
0,28 ± 0,012 |
0,04 ± 0,007 (10,3) |
|
н -Октадекан (С 18 ) |
0,46 ± 0,061 |
0,42 ± 0,001 |
0,03 ± 0,000 (7,0) |
Примечание. *β-Ситостерол добавляли одновременно с внесением культуры. **Здесь и в табл. 2 в скобках приведено процентное содержание стигмаст-4-ен-3-она в сумме продуктов биотрансформации.
Время, сут
Рис. 2. Динамика образования стигмаст-4-ен-3-она из β-ситостерола клетками R. ruber ИЭГМ 233. При добавлении β-ситостерола в среду с н- гексадеканом 1 - одновременно с внесением культуры, 2 – через 1 сут роста культуры, 3 – через 2 сут, 4 – через 3 сут.
При использовании в качестве индукторов алифатических кислот (табл. 2) уровень холестро-локсидазной активности значительно повышается по сравнению с таковым в присутствии н- алканов. При этом максимальное количество стигмаст-4-ен-3-она достигается при внесении β-ситостерола в минеральную среду одновременно с инокулятом. Степень образования стигмаст-4-ен-3-она зависит от объема алкильного фрагмента алифатической кислоты, используемой в качестве индуктора. Так, в присутствии кислот с количеством углеродных атомов С 10 -С 12 среди продуктов биотрансформации обнаруживается лишь следовое количество целевого стигмаст-4-ен-3-она. Существенное повышение уровня конверсии β-ситостерола в стиг-маст-4-ен-3-он наблюдается в присутствии кислот
С 13 -С 18 (табл. 2), среди которых более эффективно индуцируют холестеролоксидазную реакцию алифатические кислоты с четным числом атомов углерода. При этом максимальная (до 55 %) степень образования стигмаст-4-ен-3-она из β-ситостерола регистрируется при использовании пальмитиновой кислоты (С 16 ).
Об особенностях индукции холестеролокси-дазной активности родококков в присутствии н-алканов или органических кислот судили по результатам сравнительного эксперимента с использованием н-гексадекана и пальмитиновой кислоты, имеющих одинаковый алкильный радикал. Обнаружено, что в течение первых 3 сут характер накопления стигмаст-4-ен-3-она в присутствии данных соединений практически не изменяется, затем в присутствии пальмитиновой кислоты в среде биотрансформации регистрируется резкое увеличение концентрации стигмаст-4-ен-3-она. По-видимому, наличие карбоксильной группы в алифатическом индукторе способствует более эффективному катализу реакции β-окисления, которая, по мнению Халпэна (Halpern, 1981), на генетическом уровне связана с холестеролоксидазной реакцией.
Таким образом, в результате проведенных исследований установлено, что использование алифатических кислот в качестве индукторов холе- стеролоксидазной активности позволяет существенно повысить (до 55,3 %) выход стигмаст-4-ен-3-она и сократить в 1,5 раза продолжительность процесса биоконверсии β-ситостерола (с 7 до 5 сут).
Работа поддержана грантами «Ведущие научные школы Российской Федерации» № НШ-4112.2008.4 и грантом междисциплинарного проекта фундаментальных исследований, выполняемых в учреждениях УрО РАН.
Таблица 2
|
Индуктор |
Сумма продуктов реакции, г/л |
Содержание в сумме продуктов реакции, г/л |
|
|
β-Ситостерола |
Стигмаст-4-ен-3-она |
||
|
Без добавления индукторов (контроль) |
0,55 ± 0,002 |
0,48 ± 0,001 |
0,06 ± 0,008 (10,9) |
|
Декановая кислота (С 10 ) |
0,41 ± 0,030 |
0,34 ± 0,035 |
(<1,0) |
|
Ундекановая кислота (С 11 ) |
0,31 ± 0,042 |
0,28 ± 0,012 |
(<1,0) |
|
Лауриновая кислота (С 12 ) |
0,46 ± 0,023 |
0,45 ± 0,004 |
(<1,0) |
|
Тридекановая (С 13 ) |
0,23 ± 0,018 |
0,14 ± 0,043 |
0,06 ± 0,006 (26,1) |
|
Пентадекановая (С 15 ) |
0,24 ± 0,060 |
0,21 ± 0,006 |
0,02 ± 0,003 (8,3) |
|
Пальмитиновая кислота (С 16 ) |
0,38 ± 0,019 |
0,17 ± 0,004 |
0,21 ± 0,019 (55,3) |
|
Стеариновая кислота (С 18 ) |
0,38 ± 0,025 |
0,24 ± 0,004 |
0,12 ± 0,006 (31,6) |
Биотрансформация β-ситостерола R. erythropolis ИЭГМ 487 в присутствии алифатических кислот
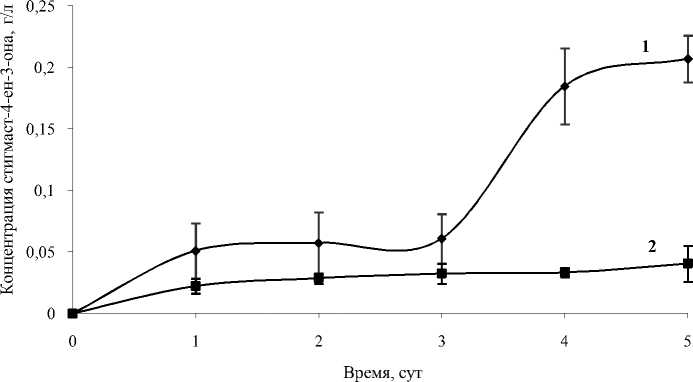
Рис. 3. Динамика образования стигмаст-4-ен-3-она клетками R. erythropolis ИЭГМ 487 при добавлении в качестве индукторов: пальмитиновой кислоты (1) или н- гексадекана (2).
Список литературы Влияние индукторов холестеролоксидазной активности клеток родококков на процесс биоконверсии β-ситостерола
- Ившина И.Б. Биотрансформация ??-ситостерола и сложных эфиров ??-ситостерола актинобактериями рода Rhodococcus/И.Б. Ившина, В.В. Гришко, Е.М. Ноговицина, Т.П. Кукина, Г.А. Толстиков//Прикладная биохимия и микробиология. 2005. Т. 41, № 6. С. 626-633.
- Каталог штаммов Региональной профилированной коллекции алканотрофных микроорганизмов/под ред. И.Б. Ившиной. М.: Наука, 1994. 163 с.
- Ноговицина Е.М. Актинобактерии рода Rhodococcus как биокатализаторы процесса трансформации -ситостерол/Е.М. Ноговицина, В.В. Гришко, И.Б. Ившина//Вестник Оренбург. гос. ун-та. 2007. № 75. С. 248-249.
- Романенко В.И. Экология микроорганизмов пресных водоемов./В.И. Романенко, С.И.Кузнецов. Л.: Наука, 1974. 194 с.
- Allain C.C. Enzymatic determination of total serum cholesterol/C.C. Allain, L.S. Poon, C.S.G. Chan, W. Richmond, P.C. Fu//Clin. Chem. 1974. Vol. 20. P. 470-475.
- Fernandes P. Microbial conversion of steroid compounds: recent developments/P. Fernandes, A. Cruz, B. Angelova, H.M. Pinheiro, J.M.S. Cabral//Enzyme Microb. Technol. 2003. Vol. 32, № 6. P. 688-705.
- Halpern M.G. Cholesterol oxidase from bacteria. Industrial enzymes from microbial sources/M.G. Halpern//Chem. Technol. Rev. 1981. Vol. 186. P. 3-22.
- Kreit J. Membrane-bound cholesterol oxidase from Rhodococcus erythropolis./J. Kreit, G. Lefebvre, P. Germain//J. Biotechnol. 1994. Vol. 33. P. 271-282.
- MacLachlan J. Cholesterol oxidase: sources, physical properties and analytical applications./J. MacLachlan, A.T.L. Wotherspoon, R.O. Ansell, C.J.W. Brooks//J. Steroid Biochem. Mol. Biol. 2000. Vol. 72. P. 169-195.
- Streber S. Use stigmasta-4-en-3-on in the treatment of androgen dependent disease/S. Streber. Patent 5264428 USA. 23.11.1993.
- Toyama M. Alteration of substrate specificity of cholesterol oxidase from Streptomyces sp. by site-directed mutagenesis/M. Toyama, M. Yamashita, M. Yoneda, A. Zaborowski, M. Nagato, H. Ono, N. Hirayama, Y. Murooka// Protein Eng. 2002. Vol. 15, № 6. P. 477-484.


