Влияние ингибирования транспорта фотосинтетического транспорта in vivo на транскрипцию генов хлоропластов в Arabidopsis
Автор: Яковлева Т.В., Зубо Ю.О., Тарасенко В.И., Гарник Е.Ю., Борнер Т., Константинов Ю.М.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 1 т.12, 2016 года.
Бесплатный доступ
Транскрипция как ядерных, так и пластидных генов, кодирующих компоненты фотосинтетического аппарата, подвергается окислительно-восстановительной регуляции. Источником окислительно-восстановительных сигналов, опосредующих это регулирование, является сама транспортная цепь хлоропластов (ETC). На сегодняшний день эффекты окислительно-восстановительного состояния отдельных компонентов ETC на скорость транскрипции генов хлоропластов были продемонстрированы только для некоторых отобранных генов и только в изолированных хлоропластах. В настоящей работе ингибиторы ЕТЦ использовали для модуляции in vivo в окислительно-восстановительном состоянии пластохинонового пула, и для оценки скорости транскрипции генов пластин использовали метод транскрипции плагинов. Мы продемонстрировали, что окислительно-восстановительное состояние пластохинона оказывает влияние на скорость транскрипции широкого спектра генов хлоропластов Arabidopsis. Лечение DCMU (пластохиноновый пул окисляется) приводит к увеличению скорости транскрипции большинства изучаемых пластидных генов. Лечение DBMIB (пластохиноновый пул уменьшено) приводит к снижению скорости транскрипции пластидных генов. Одновременное лечение одним из ингибиторов фотосинтеза и KCN (ингибитор митохондриального дыхательного комплекса IV) приводит к снижению скорости транскрипции генов пластиды в большинстве случаев. Наши результаты показывают вероятное участие митохондрий в редокс-регуляции экспрессии генов пластид в Arabidopsis.
Короткий адрес: https://sciup.org/14323980
IDR: 14323980
Текст научной статьи Влияние ингибирования транспорта фотосинтетического транспорта in vivo на транскрипцию генов хлоропластов в Arabidopsis
Изменения окислительно-восстановительного баланса между фотосистемой I (ФСI) и фотосистемой II (ФСII), а также действие ингибиторов фотосинтетического транспорта электронов порождают на тилакоидных мембранах хлоропластов высших растений редокс-сигналы, которые вызывают адаптационные изменения в структуре фотосинтетического аппарата (Allen and Pfannschmidt, 2000). У высших растений корректировка стехиометрии фотосинтетического аппарата главным образом заключается в изменении относительных количеств комплексов фотосистем I и II в тилакоидной мембране. Поскольку белковые комплексы фотосистем содержат компоненты как ядерного, так и хлоропластного кодирования, то предполагается, что для обеспечения описанных выше адаптационных процессов транскрипция соответствующих генов - как ядерных, так и органельных – подвергается редокс-регуляции (Pfannschmidt et al. , 2009). Существует гипотеза, согласно которой редокс-регуляция экспрессии генов хлоропластов является возможной причиной сохранения пластидного генома в ходе эволюции (Allen, 1993).
В 1999 году было впервые показано, что редокс-состояние связующего компонента в цепи переноса электронов – пула пластохинона тилакоидных мембран – может контролировать транскрипцию хлоропластных генов, кодирующих белки реакционных центров обеих фотосистем. При обработке растений горчицы светом определенной длины волны, специфически активирующим ФС II либо ФС I, окисленное состояние пула пластохинона индуцировало ген psbA, кодирующий субъединицу D1 реакционного центра ФСII, и подавляло транскрипцию генов psaA и psaB, кодирующих компоненты реакционного центра ФСI; восстановленное состояние пула пластохинона приводило к противоположным результатам (Pfannschmidt et al., 1999a). Следует отметить, что на сегодняшний день работ подобного рода очень мало, и они охватывают очень небольшое число хлоропластных генов. Между тем вопрос об участии сигналов, опосредуемых экспрессией пластидных генов (PGE – plastid genes expression), в регуляции экспрессии ядерных генов растений поднимается регулярно (Sullivan and Gray, 1999; Berry et al., 2013; Chi et al., 2013; Tiller and Bock, 2014). Ясно, что для получения объективной картины необходимо исследование поведения не нескольких, а как можно большего числа хлоропластных генов.
Цель настоящей работы состояла в исследовании влияния редокс-состояния дыхательной цепи хлоропластов на скорость транскрипции 31 хлоропластного гена арабидопсиса.
MATERIALS AND METHODS
Объект исследования. Во всех экспериментах использовали 12-дневные растения арабидопсиса (Arabidopsis thaliana L. [Heynh]) экотип Col-0 (дикий тип). Семена проращивали в кюветах в почве, смешанной с перлитом в соотношении 1:1. Растения выращивали в климатических камерах при температуре 20-23 °C, 16-часовом освещении (освещенность 130 мкмоль*м-2*с-1) (Lamp Master HPI-T Plus 400W E40) («Philips»). Для проведения экспериментов растения срезали на уровне грунта и экспонировали при освещенности 180 мкмоль*м-2*с-1 в течение 4 часов, погрузив срезы в воду (контроль) либо растворы ингибиторов. Конечная концентрация ингибиторов в растворах для экспозиции срезанных растений составляла: цианид калия (KCN) - 1 мM, 2,5-дибромо-3-метил-6-изопропил-p-бензохинон (DBMIB) - 25 мкМ, 3-(3,4-дихлорфенил)-1,1-диметилмочевина (DCMU) -10 мкМ.
Выделение хлоропластов. Хлоропласты выделяли методом дифференциального центрифугирования с последующей очисткой в ступенчатом градиенте перколла (Efimova et al. , 2012). Растения арабидопсиса (10 г) гомогенизировали с помощью блендера PHILIPS (Нидерланды) в буфере А, содержавшем 0,33 М сорбитол, 50 мМ Трицин (pH 8,0), 2 мМ ЭДТА, 5 мМ β-меркаптоэтанол. Полученный гомогенат фильтровали через 4 слоя капроновой ткани. Ядра и крупные клеточные фрагменты отделяли центрифугированием в течение 6 минут при 4000 g (центрифуга SORVALL RC 5B PLUS). Осадок ресуспендировали в 1,5 мл буфера A и фракционировали центрифугированием в ступенчатом (35 % / 70 %) градиенте плотности перколла в течение 30 минут при 4000 g.
Неповрежденные хлоропласты, сконцентрированные в интерфазе между 35 % и 70 % перколла, отбирали, промывали в буфере A и ресуспендировали в буфере Б (50 мМ Трис-HCl (pH 7,0), 10 мМ MgCl 2 , 10 мМ KCl, 4 мМ β-меркаптоэтанол). Все процедуры выполнялись при 4 °C. Число хлоропластов в образцах определяли путем подсчета органелл под световым микроскопом с использованием гемоцитометра Фукса-Розенталя.
Подготовка мембран с пробами исследуемых генов. Фрагменты ДНК, содержащие последовательности исследуемых генов, наносили на нейлоновую мембрану (Hybond-N, Великобритания) в две точки по 1 мкг ДНК. Образец, содержащий 2 мкг ДНК, доводили до 200 мкл дистиллированной водой, одновременно создавая денатурирующие условия добавлением NaOH до конечной концентрации 0,5 М. Для денатурации ДНК пробирки с раствором инкубировали 10 мин при 95 °С на водяной бане. По истечении 10 мин пробирки переносили на лед. Для нанесения образцов ДНК на мембрану использовали аппарат Bio-Dot TM фирмы «Bio-Rad» (США). Мембрану высушивали и фиксировали ДНК на мембране с помощью ультрафиолета. Для этого использовали переносной трансиллюминатор фирмы Dosa (Германия). Далее мембрану промывали в 2-кратном буфере SSC в течение 2 мин и высушивали.
Синтез меченых транскриптов в хлоропластном лизате. Run-on транскрипцию проводили методом, описанном в работе (Zubo et al., 2014b). Реакцию проводили в течение 15 минут при 25 оС в буфере, содержащем 50 мМ Трис-HCl (pH 8,0), 10 мМ MgCl2, 0,2 мМ ЦТФ, 0,2 мМ ГТФ, 0,2 мМ ATФ, 0,01 мМ УТФ, 50 мкКи [α-32P]УТФ (Amersham), 20 единиц РНКазы (Fermentas), 10 мМ β-меркаптоэтанола. Реакцию останавливали добавлением равного объема стоп-буфера (50 мМ Трис-HCl (pH 8,0), 25 мМ ЭДТА, 5 % Na-лаурилсаркозил). Транскрипты, меченные [α-32P] УТФ, выделяли как описано (Zubo and Kusnetsov, 2008) и гибридизовали с ДНК-зондами, нанесенными на нейлоновую мембрану в буфере, содержащем 250 мМ Na2HPO4, 7 % SDS, 2,5 мМ ЭДТА. Радиоактивные сигналы детектировали с помощью сканера «Molecular Imager FX» с использованием программы «Quantity One Software» (Bio-Rad).
Статистическая обработка результатов. Статистическую обработку данных и построение диаграмм производили с помощью пакета программ Microsoft Excel. Все эксперименты были проведены не менее чем в трех биологических повторностях. Столбцы на гистограммах означают средние значения по трем или более биологическим повторностям, бары означают среднеквадратичное отклонение. Достоверность различий оценивали по критерию Стьюдента при уровне вероятности p < 0,05.
RESULTS
На рисунке 1 представлена схема действия двух сайт-специфичных ингибиторов фотосинтетической электрон-транспортной цепи (ЭТЦ), традиционно применяемых для искусственного манипулирования редокс-состоянием пула тилакоидного пластохинона (рис. 1). Ингибитор DCMU (3-(3,4-дихлорфенил)-1,1-диметилмочевина) обладает специфическим сродством к QB-связывающему сайту белка D1 фотосистемы II. Добавление DCMU блокирует транспорт электронов через ФСII и приводит к окислению всех следующих компонентов транспортной цепи при нециклическом транспорте электронов (Pfannschmidt et al., 2009). DBMIB (2,5-дибромо-3-метил-6-изопропил-p-бензохинон) связывается с QO-сайтом комплекса цитохром b6/f тилакоидной мембраны, что приводит к восстановлению предшествующего участка ЭТЦ (Trebst, 1980). Представленные на схеме ингибиторы фотосинтеза успешно используются для манипулирования редокс-состоянием пула тилакоидного пластохинона.
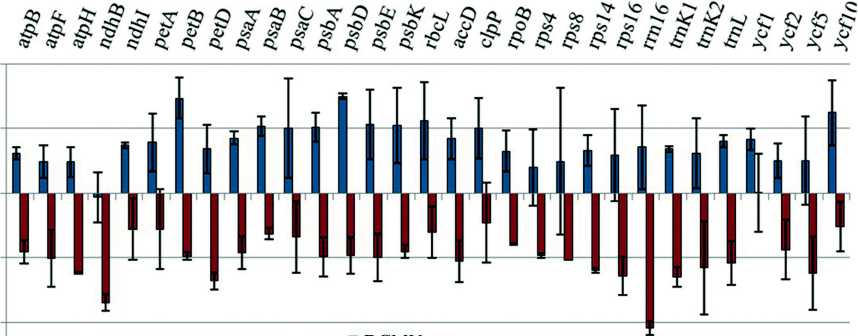
В нашей работе инкубация растений арабидопсиса в растворе DCMU приводила к достоверной активации транскрипции 30 из 31 исследованного хлоропластного гена. Исключение составляет ген ndhB. На скорость транскрипции этого гена обработка DCMU не повлияла (рис. 2). Наиболее значительное повышение скорости транскрипции наблюдали преимущественно для генов, продукты которых принимают участие в реакциях фотосинтеза: petB (субъединица комплекса цитохром b6/f), psaC (субъединица ФСI), psbA, psbD, psbE, psbK (субъединицы ФСII), rbcL (большая субъединица РУБИСКО), а также для генов clpP (хлоропластная казеинолитическая протеаза) и ycf10 (мембранный белок с неизвестной функцией). Скорость транскрипции остальных генов тоже повышалась, но не достигала 2-кратного уровня. Эти данные могут указывать на существование ген-специфичных регуляторных механизмов.
Инкубация растений арабидопсиса в растворе DBMIB приводила к 2-кратному и более понижению скорости транскрипции 30 хлоропластных генов (для одного гена – ycf1 – не наблюдали достоверных отличий от контроля). Наиболее сильное снижение транскрипции (в 4 раза) показано для генов ndhB и rrn16 (рис. 2).
Имеются данные о тесном взаимодействии хлоропластов и митохондрий в растительной клетке (Singh et al. , 1996; Padmasree и Raghavendra, 2001). Ранее нами было показано, что обработка растений арабидопсиса ингибиторами дыхательной цепи приводит к существенному изменению скорости транскрипции хлоропластных генов (Zubo et al. , 2014a). На данном этапе работы мы посчитали интересным исследовать возможное влияние на транскрипцию хлоропластных генов одновременного ингибирования и хлоропластной, и митохондриальной ЭТЦ.
Обработка растений арабидопсиса смесью ингибиторов DCMU+KCN приводила к 3-кратному подавлению скорости транскрипции всех исследованных хлоропластных генов, за исключением гена psaC (рис. 3). Наиболее сильное подавление (в 4 раза) показано для генов ndh1, psaA, psaB, rps14, rps16, trnL, ycf2, ycf5. Таким образом, ингибитор IV дыхательного комплекса митохондрий цианид калия отменял активирующий эффект DCMU, что может свидетельствовать о влиянии редокс-состояния ЭТЦ митохондрий на транскрипцию хлоропластных генов.
Инкубация растений в смеси ингибиторов DBMIB+KCN приводила к снижению скорости транскрипции в 2 и более раз (относительно контроля без ингибиторов) для хлоропластных генов: atpB , atpH , ndhB , psaA , psbK , trnK2 , trnL , ycf5, и в 4 раза генов: psbA , psbD , rps16 . Для генов petA , psbE , rbcL , ycf1 наблюдали тенденцию к повышению скорости транскрипции (рис. 4). Таким образом, добавление цианида калия для большинства исследованных генов либо не изменяло скорость транскрипции относительно обработки одним DBMIB, либо замедляло ее еще сильнее.
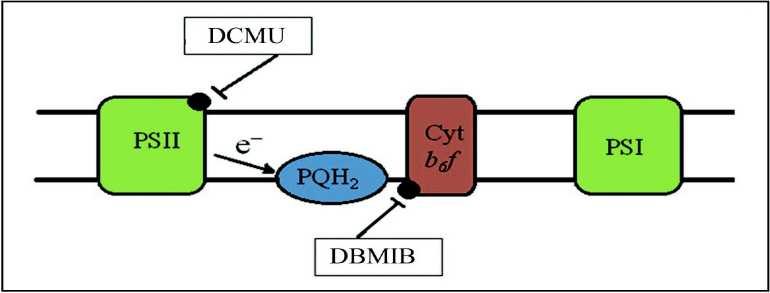
Figure 1. Схема действия ингибиторов переноса электронов в фотосинтетической ЭТЦ (по Pfannschmidt et al. , 2009).
□ DCMU
_____1DBMIB
Figure 2. Изменение скорости транскрипции хлоропластных генов арабидопсиса при ингибировании фотосинтетического транспорта электронов.
12-дневные растения инкубировали в растворах DBMIB (25 мкМ) и DCMU (10 мкМ). Эффекты ингибиторов показаны по сравнению с контролем (инкубирование в воде) как десятичный логарифм, вычисленный от среднего значения транскрипционной активности всех исследованных хлоропластных генов как минимум в 3 независимых экспериментах (0.3 указывает на двойное увеличение, -0.3 указывает на двойное уменьшение в интенсивности хлоропластной транскрипции).
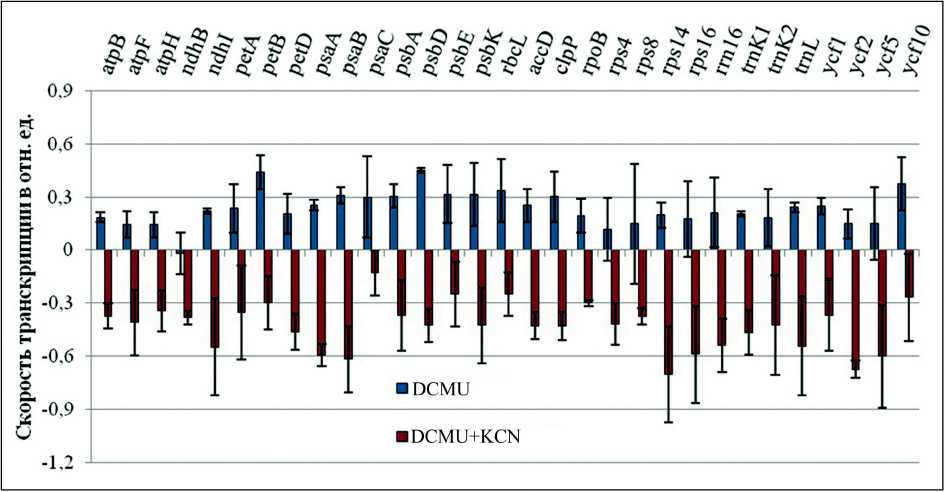
Figure 3. Влияние одновременного ингибирования транспорта электронов через ФСII и дыхательный комплекс IV на скорость транскрипции хлоропластных генов арабидопсиса. 12-дневные растения инкубировали в растворах DCMU (10 мкМ) и DCMU (10 мкМ) + KCN (1 мМ). Эффекты ингибиторов показаны по сравнению с контролем (инкубирование в воде) как десятичный логарифм, вычисленный от среднего значения транскрипционной активности всех исследованных хлоропластных генов как минимум в 3 независимых экспериментах (0.3 указывает на двойное увеличение, -0.3 указывает на двойное уменьшение в интенсивности хлоропластной транскрипции).
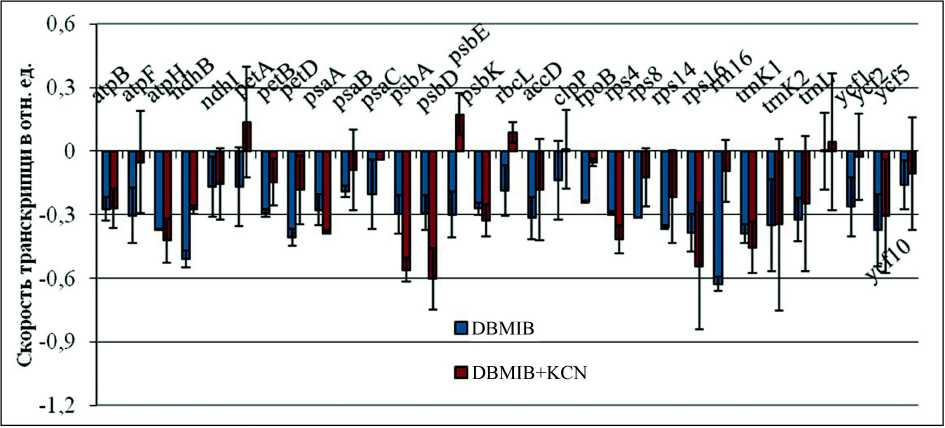
Figure 4. Влияние одновременного ингибирования транспорта электронов через комплекс цитохром b6/f и дыхательный комплекс IV на скорость транскрипции хлоропластных генов арабидопсиса.
12-дневные растения инкубировали в растворах DBMIB (25 мкМ) и DBMIB (25 мкМ) + KCN (1 мМ). Эффекты ингибиторов показаны по сравнению с контролем (инкубирование в воде) как десятичный логарифм, вычисленный от среднего значения транскрипционной активности всех исследованных хлоропластных генов как минимум в 3 независимых экспериментах (0.3 указывает на двойное увеличение, -0.3 указывает на двойное уменьшение в интенсивности хлоропластной транскрипции).
DISCUSSION
В настоящее время признано, что редокс-состояние компонентов ЭТЦ хлоропластов является одним из главных источников редокс-сигналов, управляющих ядерной и хлоропластной экспрессией генов (Chi et al., 2013). Противоположно направленный эффект ингибиторов DBMIB и DCMU на экспрессию генов в изолированных хлоропластах впервые наблюдали Pfannschmidt с соавторами в 1999 г. для трех хлоропластных генов горчицы (Pfannschmidt et al., 1999a). В 2001 г. аналогичные тенденции были показаны для промоторов четырех ядерных генов горчицы, кодирующих компоненты фотосинтетической ЭТЦ (Pfannschmidt et al., 2001). На основании этих результатов авторы постулировали, что редокс-состояние пула пластохинона является решающим фактором для регуляции экспрессии хлоропластных генов. Важно отметить, что Pfannschmidt с соавторами иллюстрировали свою гипотезу на примере отдельных генов, кодирующих субъединицы реакционных центров обеих фотосистем: одного – psbA – для ФСII, и двух – psaA, psaB – для ФСI. В этих экспериментах при окислении пула пластохинона наблюдали повышение скорости транскрипции гена psbA, кодирующего компонент ФСII, и снижение транскрипции обоих генов, кодирующих компоненты ФСI. Восстановление пула пластохинона вследствие применения DBMIB приводило к противоположным результатам, т.е. к снижению экспрессии для компонента ФСII и повышению экспрессии для компонентов ФСI (Pfannschmidt et al., 1999a). Таким образом, окисленное либо восстановленное состояние пула пластохинона индуцировало экспрессию компонентов одной фотосистемы, но одновременно репрессировало экспрессию компонентов другой. Именно это заставило авторов говорить о том, что редокс-состояние тилакоидного пластохинона балансирует стехиометрическое соотношение важнейших компонентов фотосинтетического аппарата (Allen and Pfannschmidt, 2000). Однако при манипулировании редокс-состоянием пула пластохинона посредством специфического освещения воспроизвести эти результаты удалось только для генов psaA и psaB (Pfannschmidt et al., 1999b), причем для 7 других пластидных генов, взятых в исследование, при любых изменениях редокс-состояниях пластохинона наблюдали либо повышение скорости транскрипции, либо отсутствие достоверных отличий от контроля. Таким образом, «балансирующий эффект» редокс-состояния пластохинона на скорость транскрипции был строго доказан только для двух пластидных генов горчицы в системе in organello.
В нашем исследовании при обработке растений ингибиторами фотосинтеза in vivo блокирование транспорта электронов через ФСII при помощи DCMU (окисленное состояние пула пластохинона) повышало скорость транскрипции подавляющего большинства хлоропластных генов, в том числе всех генов, кодирующих субъединицы обеих фотосистем (рис. 2). Блокирование потока электронов на уровне комплекса цитохром b6/f при помощи DBMIB (восстановленное состояние пула пластохинона) снижало скорость транскрипции всех исследованных хлоропластных генов (рис. 2). Таким образом, наши данные отличаются от полученных при обработке ингибиторами фотосинтетической ЭТЦ изолированных хлоропластов (Pfannschmidt et al., 1999a): в наших экспериментах блокирование переноса электронов приводило скорее к понижению либо повышению скорости хлоропластной транскрипции в целом, чем к избирательным изменениям экспрессии компонентов фотосистем. Та же тенденция (общее понижение либо повышение хлоропластной транскрипции) проявилась при одновременной обработке растений DCMU и KCN (рис. 3), но не DBMIB и KCN (рис. 4).
Обнаруженное нами влияние цианида калия – ингибитора митохондриального дыхательного комплекса IV – на скорость хлоропластной транскрипции представляет особый интерес. При экспонировании растений при более освещенности, чем необходимо для нормального метаболизма, эффективность фотосинтеза уменьшается. Это явление, названное фотоингибированием, происходит вследствие сверхвосстановления фотосинтетической ЭТЦ, приводящего к инактивации ее реакционных центров. Достаточно давно известно значение митохондриального дыхания в предотвращении фотоингибирования. Так, восприимчивость зеленой водоросли Chlamydomonas reinhardtii к фотоингибированию увеличивалась, если клетки экспонировали в присутствии ингибитора цитохромоксидазного пути (KCN) или в присутствии разобщителей окислительного фосфорилирования (FCCP, CCCP) (Singh et al. 1996). Кроме того, полное восстановление фотосинтетической способности после фотоингибирования было значительно медленнее в клетках, обработанных ингибиторами митохондриального дыхания, чем в необработанных клетках (Singh et al. 1996). Исследования на протопластах и листьях гороха показывают, что митохондрии участвуют в активации цикла Кальвина (Padmasree and Raghavendra, 1999) и активации ключевых хлоропластных белков (Padmasree и Raghavendra, 2001).
В наших экспериментах добавление KCN, блокирующего перенос электронов по митохондриальной ЭТЦ, вместе с DCMU снимало активирующий эффект последнего (рис. 3). Эти результаты могут говорить о том, что регуляция генов, ассоциированных с фотосинтезом, зависит как от фотосинтетического, так и от дыхательного транспорта электронов. При этом нарушение переноса электронов по митохондриальной ЭТЦ может иметь для хлоропластной транскрипции большее значение, чем нарушение транспорта электронов через фотосинтетическую ЭТЦ.
Редокс-сигналы, образующиеся в фотосинтетической ЭТЦ, связаны со многими факторами окружающей среды либо напрямую через освещение, либо косвенно через цикл Кальвина-Бенсона. Таким образом, они способны передавать информацию об изменениях важнейших факторов внешней среды, влияющих на уровень экспрессии генов (Pfannschmidt et al. ,
2009). Взаимные влияния между редокс-состоянием и энергетическим состоянием клетки (которое во многом зависит от митохондрий и также меняется в ответ на изменение условий внешней среды) представляются весьма вероятными. Дальнейшие исследования редокс-сигнальных сетей, которые включающих как хлоропласты, так и митохондрии, должны прояснить эти связи.
ACKNOWLEDGMENT
Работа выполнена при финансовой поддержке РФФИ и Правительства Иркутской области (Соглашение № 62-57-152/5/5 от 26 ноября 2015 г.) в рамках научного проекта 14-44-04001 р_сибирь_а. В работе использовано оборудование Байкальского аналитического центра (ЦКП) СО РАН при Президиуме ИНЦ СО РАН, а также оборудование ЦКП Фитотрон СИФИБР СО РАН.
Список литературы Влияние ингибирования транспорта фотосинтетического транспорта in vivo на транскрипцию генов хлоропластов в Arabidopsis
- Allen J.F. (1993) Control of gene expression by redox potential and requirement for chloroplast and mitochondrial genome. J. Theor. Biol., 165(4): 609-631
- Allen J.F., Pfannschmidt T. (2000) Balancing the two photosystems: photosynthetic electron transfer governs transcription of reaction centre genes in chloroplasts. Philos. Trans. R. Soc. Lond. Biol. Sci., 355(1402): 1351-1359
- Berry J.O., Yerramsetty P., Zielinski A.M., Mure C.M. (1999) Photosynthetic gene expression in higher plants. Photosynth. Res., 117(1-3): 91-120
- Chi W., Sun X., Zhang L. (2013) Intracellular signaling from plastid to nucleus. Annu. Rev. Plant Biol., 64: 10.1-10.24
- Efimova M.V., Kusnetsov V.V., Kravtsov A.K., Karnachuk R.A., Khripach V.A., Kuznetsov V.V. (2012) Regulation of the transcription of plastid genes in plants by brassinosteroids. Dokl. Bio. Sci., 445: 272-275
- Padmasree K., Raghavendra A.S. (1999) Prolongation of photosynthetic induction as a consequence with mitochondrial oxidative metabolism in mesophyll protoplasts of the pea (Pisum sativum L.). Plant Sci., 142: 29-36
- Padmasree K., Raghavendra A.S. (2001) Consequence of restricted mitochondrial oxidative metabolism on photosynthetic carbon assimilation in mesophyll protoplasts: decrease in light activation of four chloroplastic enzymes. Physiol. Plant., 112(4): 582-588
- Pfannschmidt T., Nilsson A., Allen J.F. (1999a) Photosynthetic control of chloroplast gene expression. Nature, 397: 625-628
- Pfannschmidt T., Nilsson A.,Tullberg A., Link G., Allen J.F. (1999b) Direct transcriptional control of the chloroplast genes psbA and psaAB adjusts photosynthesis to light energy distribution in plants. IUBMB Life, 48(3): 271-276
- Pfannschmidt T., Allen J.F., Oelmuller R. (2001) Principles of redox control in photosynthesis gene expression. Physiol. Plant., 112: 1-9
- Pfannschmidt T., Bräutigam K., Wagner R., Dietzel L., Schröter Y., Steiner S., Nykytenko A. (2009) Potential regulation of gene expression in photosynthetic cells by redox and energy state: approaches towards better understanding. Ann. Bot., 103: 599-607
- Sullivan J.A., Gray J.C. (1999) Plastid translation is required for the expression of nuclear photosynthesis genes in the dark and in roots of the pea lip1 mutant. Plant Cell, 11(5): 901-910
- Singh K.K., Shyam R., Sane P.V. (1996) Reactivation of photosynthesis in the photoinhibited green alga Chlamydomonas reinhardtii: role of dark respiration and of light. Photosynth. Res., 49(1): 11-20
- Tiller N., Bock R. (2014) The translational apparatus of plastids and its role in plant development. Mol. Plant., 7(7): 1105-1120
- Trebst A. (1980) Inhibitors in electron flow: tools for the functional and structural localization of carriers and energy conservation sites. Methods Enzymol., 69: 6750-6715
- Zubo Y.O., Kusnetsov V.V. (2008) Application of run-on transcription method for studying the regulation of plastid genome expression. Russ. J. Plant Physiol., 55: 107-114
- Zubo Y.O., Potapova T.V., Tarasenko V.I., Börner T., and Konstantinov Yu.M. (2014a) The rate of transcription in Arabidopsis chloroplasts depends on activity of alternative electron transfer pathway in mitochondria. Dokl. Biochem. Biophys., 455(1): 76-79
- Zubo, Y.O., Potapova, T.V., Yamburenko, M.V., Tarasenko, V.I., Konstantinov, Yu.M., and Börner, T. (2014b) Inhibition of the electron transport strongly affects transcription and transcript levels in Arabidopsis mitochondria. Mitochondrion, 19: 222-230


