Влияние инсулина и глюкозы in vitro на функциональную активность Т-хелперов-17 при сахарном диабете 2-го типа
Автор: Кологривова И.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.28, 2013 года.
Бесплатный доступ
Изучали влияние инсулина и глюкозы на функциональную активность T-лимфоцитов-хелперов 17-го типа (Th17). Число Th17 ex vivo оценивали у 32 пациентов с сахарным диабетом (СД) 2-го типа, 12 пациентов с нарушением толерантности к углеводам (НТУ) и 24 здоровых добровольцев. Мононуклеары периферической крови пациентов с СД 2-го типа и здоровых добровольцев культивировали в течение 24 ч в среде, содержащей 5, 10 и 20 ммоль/л глюкозы или следующие сочетания инсулина и глюкозы: 5 ммоль/л глюкозы и 10-10 моль/л инсулина, 5 ммоль/л глюкозы и 10-8 моль/л инсулина, 20 ммоль/л глюкозы и 10-8 моль/л инсулина. Оценивали число активных Th17 в культуре и количество секретированного IL-17A. Пациенты с НТУ характеризовались повышенным содержанием Th17 ex vivo. У пациентов с СД 2-го типа мононуклеары внутриклеточно продуцировали больше IL-17 по сравнению со здоровыми добровольцами после культивирования в течение суток при 5 ммоль/л глюкозы. При 10 ммоль/л глюкозы в среде внутриклеточная продукция IL-17 была выше, чем при 5 ммоль/л как у пациентов, так и у здоровых добровольцев. У пациентов с СД 2-го типа культивирование клеток с 20 ммоль/л глюкозы приводило к увеличению стимулированной форбол-миристат-ацетатом внутриклеточной продукции IL-17 по сравнению с 5 ммоль/л глюкозы. Инсулин при всех используемых концентрациях приводил к активации спонтанной внутриклеточной продукции IL-17 у пациентов и здоровых добровольцев. Сочетание 20 мммоль/л глюкозы и 10-8 моль/л инсулина вызывало увеличение количества активных Th17 у здоровых добровольцев. Таким образом, мы показали, что метаболические нарушения при СД 2-го типа могут ассоциироваться с увеличением функциональной активности Th17 in vitro.
Сахарный диабет 2-го типа, воспаление, т-хелперы 17-го типа, инсулин, глюкоза
Короткий адрес: https://sciup.org/14920272
IDR: 14920272 | УДК: 612.112.94
Текст научной статьи Влияние инсулина и глюкозы in vitro на функциональную активность Т-хелперов-17 при сахарном диабете 2-го типа
Сахарный диабет (СД) 2-го типа привлекает все большее внимание исследователей, но механизмы его развития до сих пор изучены недостаточно. При этом заболеваемость СД 2-го типа и развитие его осложнений остаются серьезными проблемами во всем мире [1].
В настоящее время известно, что СД 2-го типа ассоциируется с развитием субклинического воспаления, проявляющегося, в частности, увеличением содержания интерлейкина (IL)-1 β , IL-6 и фактора некроза опухолей (TNF)- α в циркуляции [3]. Эти цитокины могут создавать провоспалительное микроокружение, благоприятное для активации недавно открытой субпопуляции Т-лимфоцитов – Т-хелперов 17-го типа (Th17). Несмотря на значительный потенциал Th17 модулировать воспаление, мы встретили лишь незначительное число работ, посвященных изучению функционирования данных клеток у пациентов с СД 2-го типа [3, 10].
На ранних этапах развития СД 2-го типа, как правило, наблюдается гиперинсулинемия [6]. Инсулин может влиять на функцию Т-лимфоцитов, но транспорт глюкозы в лимфоцитах является независимым от инсулина, т.к. в норме они не экспрессируют переносчик глюкозы GLUT-4, а несут на своей поверхности GLUT-1 и GLUT-3 [7, 9].
Известно, что повышенная постпрандиальная концентрация глюкозы (после приема пищи) является основным фактором риска развития микро- и макрососудистых осложнений при СД 2-го типа [8]. Если в норме содержание глюкозы через 2 ч после приема пищи не превышает 5 ммоль/л, то у пациентов с СД 2-го типа постпрандиаль-ная гипергликемия может достигать 20 ммоль/л [2]. Нарушение толерантности к углеводам (НТУ) обычно предшествует развитию СД 2-го типа. Постпрандиальное содержание глюкозы при этом патологическом состоянии является повышенным, но не так выражено, как при СД 2-го типа и обычно не превышает 10 ммоль/л [2].
Цель исследования: изучение влияния различных концентраций инсулина и глюкозы в условиях in vitro на функциональную активность Th17 у пациентов с нарушениями углеводного обмена.
Материал и методы
В исследование вошли 32 пациента с СД 2-го типа (возраст – 45–61 лет; 14 мужчин/18 женщин), 12 пациентов с НТУ (возраст – 56–61 лет; 5 мужчин/7 женщин) и 24 практически здоровых добровольца (возраст – 40–59 лет; 10 мужчин/14 женщин). У пациентов с СД 2-го типа и НТУ лабораторно было подтверждено наличие гипергликемии и гиперинсулинемии. Мононуклеарные клетки из гепаринизированной венозной крови, взятой утром натощак, выделяли путем центрифугирования на градиенте плотности (Histopaque 1119, Sigma-Aldrich, США).
Для оценки внутриклеточной продукции IL-17A мо-нонуклеары культивировали на среде RPMI 1640, содержащей 10% фетальной бычьей сыворотки, 1% L-глутамина и 1% пенициллина/стрептомицина при 37 °C, 5% CO2 в присутствии GolgiPlug (BD Pharmingen, США). Оценивали как спонтанную внутриклеточную продукцию IL-17, так и стимулированную форбол-12-миристат-13-ацета-том (ФМА; 50 нг/мл, Sigma-Aldrich, США) с иономицином (1 мг/мл, Sigma-Aldrich, США). Через 6 ч 100 мл взвеси мононуклеаров окрашивали анти-CD4 моноклональными антителами, меченными фикоэритрином-цианином-5 (PE-Cy5, Becton Dickinson, США), фиксировали, увеличивали проницаемость клеточных мембран и окрашивали анти-IL-17A моноклональными антителами, меченными фикоэритрином (PE, Becton Dickinson, США). Анализ клеток проводили на проточном цитометре FACSCalibur с использованием программы CellQuestPro (BD Biosciences, США).
У 11 здоровых добровольцев и 13 пациентов с СД 2-го типа изучали влияние инсулина и глюкозы на продукцию IL-17. Для этого 106 клеток культивировали в про- бирках емкостью 15 мл в течение 24 ч при 37 °С и 5% CO2 в 1 мл среды RPMI 1640, содержащей 10% фетальной бычьей сыворотки, 1% L-глутамина и 1% пенициллина/ стрептомицина. В культуральную среду добавляли инсулин и D-глюкозу в различных концентрациях (оба реагента – Sigma Aldrich, США). Три пробирки имели концентрацию D-глюкозы 5, 10 и 20 ммоль/л и не содержали инсулина. В трех пробирках было создано следующее сочетание концентраций инсулина и D-глюкозы: 5 ммоль/л глюкозы и 10–10 моль/л инсулина; 5 ммоль/л глюкозы и 10–8 моль/л инсулина; 20 ммоль/л глюкозы и 10–8 моль/л инсулина. In vitro концентрации инсулина и глюкозы были выбраны таким образом, чтобы соответствовать условиям, которые имеют место in vivo в ходе развития СД 2-го типа. Для контроля осмолярности была использована пробирка, содержащая 5 ммоль/л D-глюкозы и 15 ммоль/л D-маннитола. Через 24 ч супернатанты клеточных культур собирали и хранили при –40 °С для последующего определения секретированного IL-17 методом иммуноферментного анализа (Вектор-БЕСТ, Россия). Клетки ресуспендировали в фосфатно-солевом буферном растворе и оценивали внутриклеточную продукцию IL-17 методом проточной цитометрии. Для оценки жизнеспособности клетки окрашивали 7-актиноамино-мицином D (7-AAD, Becton Dickinson, США). Жизнеспособность клеток варьировала от 95 до 98%.
Статистическую обработку данных проводили с использованием пакета программ SPSS 11.5.0 for Windows (SPSS Inc., США). Использовали непараметрический U-критерий Манна–Уитни и критерий Вилкоксона для связных выборок. Различия считали статистически значимыми при р<0,05. Результаты представлены в виде ме- дианы и интерквартильного размаха.
Результаты
Анализ ex vivo показал, что пациенты с НТУ характеризовались большим количеством активных Th17 после стимуляции ФМА с иономицином по сравнению со здоровыми добровольцами и пациентами с СД 2-го типа (р=0,015 и р=0,023 соответственно, рис. 1).
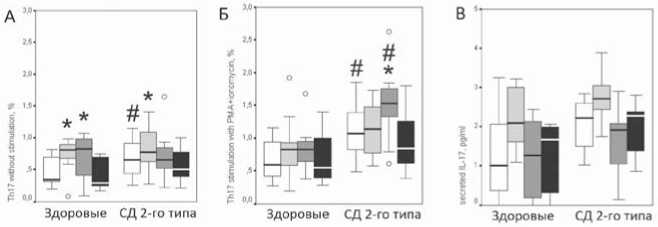
После инкубации клеток в течение 24 ч в среде с содержанием глюкозы 5 ммоль/л процент Т-клеток, внутриклеточно продуцирующих IL-17 спонтанно и после стимуляции ФМА с иономи-цином, был значительно выше у пациентов с СД 2-го типа по сравнению с контрольной группой (рис. 2 А).
Инкубация мононуклеаров здоровых добровольцев в среде с концентрацией глюкозы 10 и 20 ммоль/л привела к увеличению спонтанной внутриклеточной продукции IL-17 по сравнению с концентрацией глюкозы в среде 5 ммоль/л (р=0,010 и р=0,002 соответственно; рис. 2 А). У пациентов с СД 2-го типа увеличение спонтанной внутриклеточной продукции IL-17 наблюда- лось только при концентрации глюкозы в среде 10 ммоль/ л (р=0,044).
Стимуляция ФМА с иономицином мононуклеаров периферической крови у пациентов с СД 2-го типа приводила к более выраженному увеличению продукции цитокина при содержании глюкозы в среде 20 ммоль/л по сравнению с 5 ммоль/л глюкозы (р=0,001; рис. 2 Б). В группе здоровых добровольцев процент активированных Th17 после стимуляции ФМА с иономицином достоверно не различался при различном содержании глюкозы в среде (рис. 2 А). Инкубация с D-маннитолом не приводила к изменению внутриклеточной продукции IL-17 как в группе пациентов с СД 2-го типа, так и в группе здоровых добровольцев (рис. 2). Следовательно, наблюдаемое изменение продукции цитокинов связано именно с воздействием глюкозы, а не с изменением осмолярности среды.
Добавление 10–10 и 10–8 моль/л инсулина in vitro приводило к увеличению содержания IL-17-продуцирующих Th17 как в группе здоровых добровольцев, так и в группе пациентов с СД 2-го типа (р=0,005 и р=0,002 соответственно при 10–10 моль/л инсулина; р=0,003 и р=0,047 соответственно при 10–8 моль/л инсулина; рис. 3 А).
В группе здоровых добровольцев процент Th17, внутриклеточно продуцирующих IL-17, после стимуляции ФМА с иономицином, был выше при содержании в среде 10–10 и 10–8моль/л инсулина по сравнению со средой без инсулина (р=0,001 и р=0,007 соответственно; рис. 3 Б).
У пациентов с СД 2-го типа количество активированных Th17 не зависело от концентрации инсулина в среде, если клетки стимулировали ФМА с иономицином после 24 ч культивирования. Процент Th17, продуцирующих
IL-17, оставался высоким как в отсутствии инсулина, так и при содержании 10–10 и 10–8 моль/л инсулина в среде
(рис. 3 Б).
Культивирование мононуклеаров здоровых добровольцев в среде, содержащей повышенные концентрации инсулина (10–8 моль/л) и глюкозы (20 ммоль/л), приводило к увеличению количества активированных Th17 по
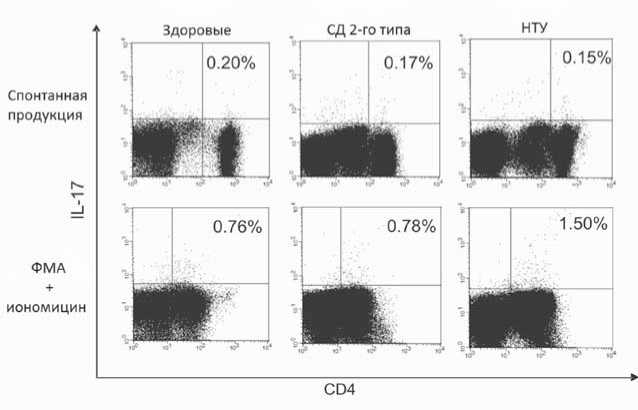
Рис. 1. Примеры точечных диаграмм, отражающих процент Th17 ex vivo у пациентов с СД 2-го типа (n=32), пациентов с НТУ (n=12) и здоровых добровольцев (n=24).
Процент указан от общего количества CD4+-лимфоцитов
сравнению с условиями культивирования без инсулина с содержанием глюкозы 5 ммоль/л (рис. 3). Данный эффект совместного воздействия высоких концентраций инсулина и глюкозы наблюдался как при стимуляции ФМА и иономицином (р=0,001), так и в отсутствии стимуляции (р=0,005).
В мононуклеарах пациентов с СД 2-го типа спонтанная и стимулированная ФМА с иономицином внутриклеточная продукция IL-17 при сочетанном воздействии 10–8 моль/л инсулина и 20 ммоль/л глюкозы не отличалась от условий культивирования без инсулина и оставалась на высоком уровне (рис. 3).
Содержание секретированного IL-17 после 24 ч культивирования было относительно низким при всех концентрациях глюкозы и инсулина, созданных in vitro в нашем исследовании, и граничило с пределом чувствительности используемого набора ИФА (2 пг/мл), рисунки 2 В и 3 В, поэтому мы не смогли сделать какого-либо заключения о влиянии инсулина и глюкозы на секрецию IL-17.
Обсуждение
Мы показали увеличение функциональной активности Th17 у пациентов с СД 2-го типа, что отражалось в активации внутриклеточного синтеза IL-17 после культивирования в течение 24 ч. В соответствии с нашими результатами, активация Th17 имеет место даже при небольшом увеличении концентрации глюкозы в среде, т.е. отклонение оси дифференцировки Th17 может предшествовать развитию СД 2-го типа, что мы наблюдали ex vivo у пациентов с НТУ.
Несмотря на увеличение внутриклеточной продукции IL-17, мы не выявили влияния глюкозы и инсулина на секрецию данного цитокина in vitro. Вероятно, для интенсивной секреции IL-17 необходимо наличие дополнительного активационного сигнала. Так, A. Lenarczyk и соавт. показали, что при секреции IL-17 важную роль играет митогенная стимуляция лимфоцитов [4].
Наши результаты свидетельствуют о том, что инсулин наряду с глюкозой может стимулировать активацию Th17, действуя как сам по себе, так и в сочетании с глюкозой. Мы полагаем, что инсулин не оказывал влияния на стимулированную продукцию цитокина в Th17 у пациен- тов с СД 2-го типа, т.к. клетки уже подвергались воздействию высоких концентраций инсулина и глюкозы in vivo. Известно, что гипергликемия может приводить к активации протеинкиназы С (PKC) с последующим ингибированием инсулинового сигналинга [5]. Вероятно, дополнительная активация данного пути in vitro с помощью ФМА привела к блокированию внутриклеточного сигна-линга инсулина и вызвала различный ответ на воздействие инсулина в группах пациентов и здоровых добровольцев. Необходимы дальнейшие исследования, направленные на выяснение роли PKC в сигналинге инсулина и глюкозы при синтезе IL-17.
глюкоза 5 ммоль/л | глюкоза 20 ммоль/л
глюкоза 10 ммоль/л ■ глюкоза 5 ммоль/л
D-маннитол 15 ммоль/л
Рис. 2. Влияние различных концентраций глюкозы на 24-часовую спонтанную внутриклеточную продукцию IL-17 (A), стимулированную ФМА с иономицином внутриклеточную продукцию IL-17 (Б), секрецию IL-17 (В) мононуклеарами периферической крови у пациентов с СД 2-го типа (n=13) и здоровых добровольцев (n=11); А и Б – указан процент клеток от CD4+-лимфоцитов, В – концентрация в пг/мл; * – р<0,05 по сравнению с концентрацией глюкозы в среде 5 ммоль/л; # – р<0,05 по сравнению со здоровыми добровольцами; o – экстремумы.
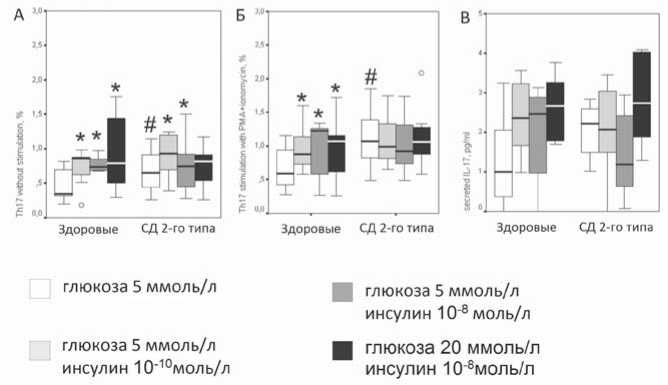
Рис. 3. Влияние различных концентраций инсулина на 24-часовую спонтанную внутриклеточную продукцию IL-17 (A), стимулированную ФМА с иономицином внутриклеточную продукцию IL-17 (Б), секрецию IL-17 (В) мононуклеарами периферической крови у пациентов с СД 2-го типа (n=13) и здоровых добровольцев (n=11); А и Б – указан процент клеток от CD4+-лимфоцитов, В – концентрация в пг/мл; * – р<0,05 по сравнению с условиями без инсулина и 5 ммоль/л глюкозы в среде; # – р<0,05 по сравнению со здоровыми добровольцами; o – экстремумы.
Таким образом, в соответствии с нашими данными, метаболические нарушения при СД 2-го типа ассоциируются с повышенной активацией линии Th17-лимфо-цитов, что может значительно увеличивать риск развития воспаления у пациентов и, следовательно, осложнений диабета.
Работа выполнена при финансовой поддержке Федерального агентства по науке и инновациям в рамках Федеральной целевой научно-технической программы “Исследования и разработки по приоритетным направлениям развития научно-технического комплекса России на 2007–2012 годы”
(Государственный контракт № 02.527.11.0007 от 30 апреля 2009 г.)
Список литературы Влияние инсулина и глюкозы in vitro на функциональную активность Т-хелперов-17 при сахарном диабете 2-го типа
- Гарганеева Н.П. Психосоциальные аспекты сахарного диабета 2-го типа: инновации профилактики//Сибирский медицинский журнал (Томск). -2011. -Т. 26, № 4. -С. 121-125.
- Airola P. Hypoglycemia: a better approach. -Phoenix, Arizona: Health Plus., 1977. -191 p.
- Jagannathan Bogdan M., McDonnell M.E., Shin H. et al. Elevated proinflammatory cytokine production by a skewed T cell compartment requires monocytes and promotes inflammation in type 2 diabetes//J. Immunol. -2011. -Vol. 186. -P. 1162-1172.
- Lenarczyk A., Helsloot J., Farmer K. et al. Antigen induced IL 17 response in the peripheral blood mononuclear cells (PBMC) of healthy controls//Clin. Exp. Immunol. -2000. -Vol. 122. -P. 41-48.
- Oldenborg P.A., Sehlin J. Hyperglycemia in vitro attenuates insulin stimulated chemokinesis in normal human neutrophils. Role of protein kinase C activation//J. Leukoc. Biol. -1999. -Vol. 65. -P. 635-640.
- Shanik M.H., Xu Y., Skrha J. et al. Insulin resistance and hyperinsulinemia//Diabetes Care. -2008. -Vol. 31, Suppl. 2. -P. S262-S268.
- Szablewski L., Sobczyk Kopciol A., Oleszczak B. et al. GLUT4 is expressed in circulating lymphocytes of diabetic patients. A method to detect early prediabetic stages?//Diabetologia Croatica. -2007. -Vol. 36. -P. 69-76.
- Tenzer Iglesias P., Brunton S. Managing postprandial glucose levels in patients with diabetes//J. Fam. Pract. Suppl. -2008. -Vol. 57, No. 1. -P. S17-S24.
- Van der Weerd K., Dik W.A., Schrijver B. et al. Morbidly obese human subjects have increase peripheral blood CD4+ T cells with skewing toward a Treg and Th2 dominated phenotype//Diabetes. -2012. -Vol. 61, № 2. -P. 401-408.
- Zeng C., Shi X., Zhang B. et al. The imbalance of Th17/Th1/Tregs in patients with type 2 diabetes: relationship with metabolic factors and complications//J. Mol. Med. (Berl.). -2012. -Vol. 90, No. 2. -P. 175-186.


