Влияние интенсивности света на развитие и содержание хлорофилла в мутантных растениях Arabidopsis с дефектами фотосинтеза
Автор: Гарник Е.Ю., Деева Д.В., Белков В.И., Тарасенко В.И., Константинов Ю.М.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Проанализированы этапы развития и адаптируемость к различной интенсивности света (150 мкмоль * м -2 * с -1 и 100 мкмоль * м -2 * с -1) в мутантных линиях Arabidopsis с дефектами фотосинтетического аппарата. Развитие растений в линиях мутантов зависело от интенсивности света в разной степени. Линии ch1-1 (отсутствие хлорофиллида - оксигеназы) и rtn16 (уменьшение количества хлорофилла a и b) были наиболее восприимчивыми к уменьшению света. Ни одна из исследованных линий не продемонстрировала изменения скорости хлорофилла a / b при различных условиях освещения. Содержание обедненного хлорофилла оказало большое влияние на развитие мутантных растений при различных условиях освещения. Различная скорость хлорофилла a / b коррелировала с различной адаптируемостью мутантных растений к низкому свету.
Chlorophyll а
Короткий адрес: https://sciup.org/14323979
IDR: 14323979
Текст научной статьи Влияние интенсивности света на развитие и содержание хлорофилла в мутантных растениях Arabidopsis с дефектами фотосинтеза
Свет является важнейшим фактором, влияющим на развитие растительного организма. У высших растений энергия света улавливается антеннами светособирающих комплексов фотосистем I и II, с которыми связаны хлорофиллы а и b. Реакционные центры фотосистемы I содержат только хлорофилл а, реакционные центры фотосистемы II — хлорофилл а и его безмагниевый аналог феофитин. Хлорофилл b входит только в состав антенн светособирающего комплекса II (Biswal et al., 2012). Эффективность работы пигментной системы зависит от соответствия ее структуры и функции климатическим и/или экологическим условиям, прежде всего условиям освещения. Тенелюбивые растения обычно имеют более высокое содержание хлорофиллов, чем светолюбивые, и более высокую долю хлорофилла b, повышающего светособирающую способность листа в области дальнего красного света (Ivanov et al., 2013). При этом фотосинтетический аппарат растений способен адаптироваться к изменениям освещенности, позволяя скоординировать распределение ресурсов для достижения и поддержания оптимальных скоростей фотосинтеза (Valladares and Niinemets, 2008) . Так, при акклимации субтропических растений семейств Araceae и Liliaceae к выращиванию в интерьере соотношение хлорофиллов а/b возрастало при снижении освещенности от 500-2500 лк до 72-124 лк у одних видов и, наоборот, снижалось у других; при этом у всех исследованных видов соотношение хлорофиллов a/b увеличивалось по мере адаптации растений к пониженной освещенности (Turbina et al., 2013). Поскольку как коровые комплексы, так и субструктуры светособирающих антенн связывают строго определенное число молекул хлорофилла, и при этом структуры фотосистемы I не содержат хлорофилла b, то соотношение хлорофиллов a/b косвенно отражает соотношение числа фотосистем I и II в тилакоидной мембране (Biswal et al., 2012) -при условии, что у растения не нарушен биосинтез хлорофиллов. Таким образом, данные об изменении содержания и соотношения хлорофиллов могут нести важную информацию о структурных перестройках фотосинтетического аппарата.
Для арабидопсиса как модельного растения известно множество разнообразных мутаций, так или иначе затрагивающих структуру и функционирование фотосинтетического аппарата. Фенотипические проявления таких мутаций очень различны: от формирования бесцветных проростков до фенотипов, внешне не отличающихся от растений дикого типа. В настоящей работе проанализированы развитие и способность к адаптации к двум уровням освещенности у ряда мутантных линий арабидопсиса, дефектных по различным компонентам фотосинтетического аппарата.
MATERIALS AND METHODS
Выращивание растений и морфометрия.
Семена Arabidopsis thaliana (L.) Heynh. экотип Columbia-0 (далее Col-0), а также семена мутантных линий ch1-1, rtn16, psaL, и rpl35 были получены из Arabidopsis Biological Resource Center (The Ohio State University, USA). Для морфометрических измерений растения выращивали на грунте с добавлением вермикулита (размер частиц 1-2 мм) в пластиковых горшочках. Режим светового дня составлял 16 часов света, 8 часов темноты, температура 22 °С в темное время и 24 °С в светлое. Освещенность составляла 150 µmol*m-2*s-1 (умеренная освещенность) и 100 µmol*m-2*s-1 (слабая освещенность). Для определения содержания хлорофиллов растения выращивали стерильно на плотных средах следующего состава: соли MS (Sigma-Aldrich, США) – половинный состав, фитогель (Sigma-Aldrich, США) - 0,8%. После стратификации при +4 °С в течение трех суток чашки устанавливали в ростовой камере горизонтально и выращивали в тех же условиях, что и растения, выращиваемые на земле. Для морфометрических измерений брали по 5 растений из каждого горшочка на каждую точку измерения. Измерения проводили с интервалом 23 суток. Определяли цвет и количество настоящих листьев, диаметр розетки. Индексом цветения для растений, выращиваемых на земле, считали день раскрытия первого цветка в каждом горшочке.
Определение содержания хлорофиллов.
Экстракцию и измерение содержания хлорофиллов проводили согласно (Ni et al ., 2009). Навеску листьев (50 мг) гомогенизировали в жидком азоте в фаянсовых ступках, затем заливали 2 мл 80% ацетона (ЗАО Реактив, Россия), экстрагировали хлорофиллы в темноте на льду 30 минут, затем центрифугировали при +4 °С при
15000 g 15 минут (Centrifuge 5415 R, Eppendorf, Германия). Супернатант разбавляли в 10 раз 80% ацетоном и измеряли оптическую плотность в диапазоне от 400 до 700 нм на спектрофотометре (УВИ-спектрофотометр СФ-56, ОКБ «Спектр», Россия). Содержание хлорофиллов a и b в экстракте рассчитывали по следующим формулам:
C a (мг/мл) = 12,7*OD 663 – 2,69*OD 645
C b (мг/мл) = 22,9*OD6 45 – 4,86*OD663
Содержание хлорофиллов a и b пересчитывали на сырой вес листьев, мг хлорофилла на г сырого веса листьев.
Статистическая обработка данных.
Статистическую обработку данных и построение диаграмм проводили с помощью пакета программ Microsoft Exсel. Рассчитывали средние арифметические и стандартные отклонения. Достоверность различий оценивали по критерию Стьюдента при уровне вероятности p < 0,05.
RESULTS
Морфометрическое исследование растений Arabidopsis thaliana линии дикого типа и мутантных линий.
В экспериментах были использованы следующие мутантные линии арабидопсиса: ch1-1– мутант по ядерному гену AT1G44446, кодирующему хлорофиллид a оксигеназу. Мутация приводит к полному отсутствию хлорофилла b и уменьшению размеров антенны светособирающего комплекса II (Yamasato et al., 2005). Растения характеризуются замедленным развитием при умеренной освещенности (Oster et al., 2000). rpl35 – мутант по ядерному гену AT2G24090, кодирующему пластидный рибосомальный белок L35. Мутация приводит к нарушению пластидной трансляции (. rtn16 – мутант по ядерному гену RTNLB16 (AT3G10915), кодирующему белок из семейства ретикулонов. Растения характеризуются желто-зеленым цветом листьев и мелкими размерами розеток при умеренной и высокой освещенности. Причинноследственная связь между мутацией и формированием такого фенотипа остается невыясненной (Tarasenko et al., 2012). psaL – мутант по ядерному гену AT4G12800, кодирующему L-субъединицу корового комплекса фотосистемы I, фенотипические отличия от растений дикого типа не описаны (Pesaresi et al., 2009).
Внешний вид растений четырех из пяти исследованных линий ( Col-0, rtn16, ch1-1, psaL ) на стадии вегетации при освещенности 150 µmol*m-2*s-1 представлен на рис. 1. Растения psaL практически не отличались от растений Col-0 по внешнему виду. Растения ch1-1 характеризовались значительно более светлой, зеленовато-желтой равномерной окраской листьев. У растений rtn16 наблюдали неравномерную окраску листьев (зеленые центральные жилки, остальная площадь листа желтого цвета) (рис. 1). Растения линии rpl35 отличались от растений Col-0 несколько более светлой окраской листьев (данные не представлены).
Исследовали развитие проростков линии дикого типа и мутантных линий psaL, rpl35, ch1-1 и rtn16 при освещенности 100 µmol*m-2*s-1 и 150
µmol*m-2*s-1. Выделяли следующие стадии развития: 1 – от прорастания до разворачивания семядольных листьев; 2 – от 1 до 2 настоящих листьев; 3 – от 3 до 4 настоящих листьев; 4 – от 5 до 7 настоящих листьев; 5 – от 8 настоящих листьев до начала цветения. Результаты представлены на рис. 2.
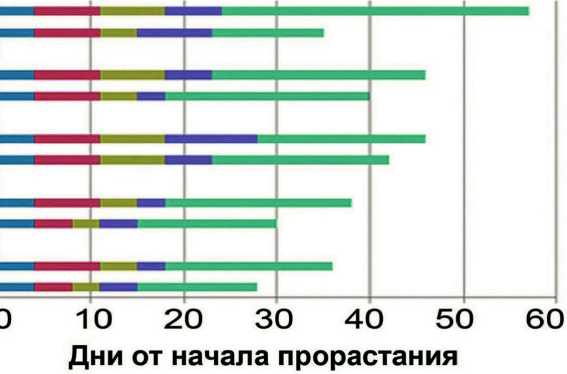
Для линии дикого типа при освещенности 150 µmol*m-2*s-1 развитие от прорастания до цветения занимало 28 суток. При освещенности 100 µmol*m-2*s-1 развитие замедлилось на 8 суток за счет удлинения стадий 1 и 5 (рис. 2А). Продолжительность развития растений всех мутантных линий от прорастания до начала цветения была увеличена при освещенности как 150 µmol*m-2*s-1, так и 100 µmol*m-2*s-1 по сравнению с растениями дикого типа. Наибольшее замедление развития при 150 µmol*m-2*s-1 по сравнению с линией дикого типа наблюдали для растений rtn16 (на 14 сут), наименьшее – у растений psaL (на 2 сут). При освещенности 100 µmol*m-2*s-1 наибольшее замедление развития по сравнению с растениями дикого типа наблюдали у растений ch1-1 (на 24 сут), наименьшее – у растений psaL (на 6 сут). Наиболее чувствительными к уровню освещенности оказались стадии 3 (от 3 до 4 настоящих листьев) и 5 (от 8 настоящих листьев до начала цветения): в большинстве случаев замедление развития происходило за счет именно этих стадий (рис. 2А).
Тенденция к снижению диаметра розетки при снижении освещенности наблюдалась у всех линий, кроме rtn16 (рис. 2B). Растения psaL не показали достоверных различий от растений Col-0 по данному признаку при обоих значениях освещенности. Розетки остальных трех мутантных линий - rtn16, rpl35 и ch1-1 - имели достоверно меньшие диаметры розетки по сравнению с линией дикого типа при всех условиях освещенности (рис. 2В).
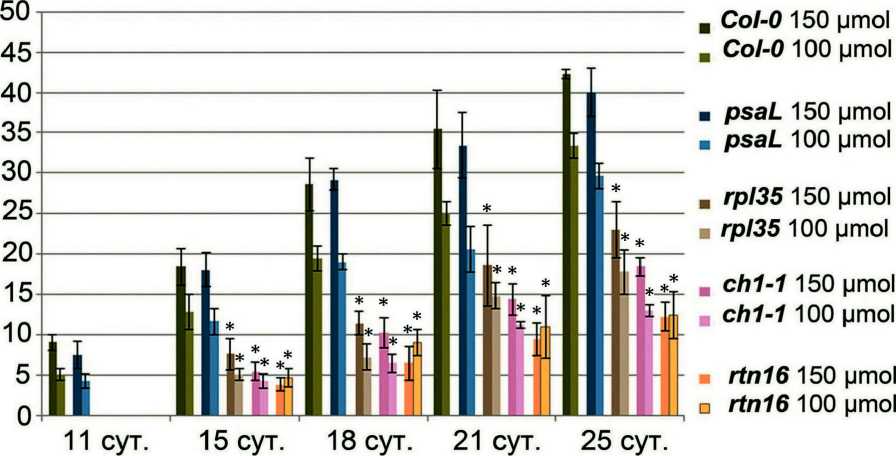
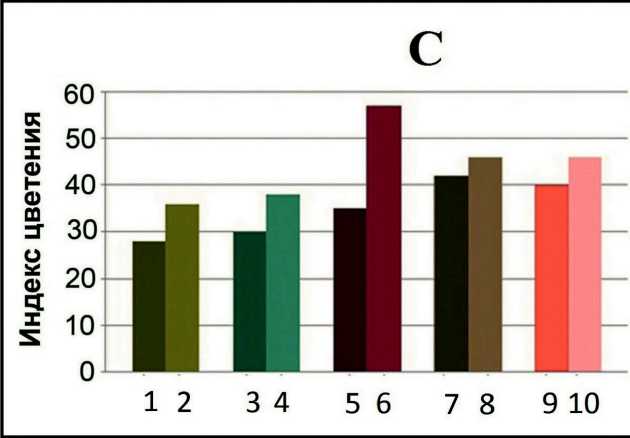
Индексом цветения в данной работе считали день раскрытия первого цветка в группе растений каждой линии. У растений Col-0 цветение наступило на 28 сутки после прорастания при освещенности 150 µmol*m-2*s-1 и на 36 сутки при освещенности в 100 µmol*m-2*s-1. У всех мутантных линий цветение наступало позже, чем у Col-0 в тех же условиях: при 150 µmol*m-2*s-1 задержка по сравнению с Col-0 составила от 2 суток у psaL до 7 суток у ch1-1 ; при 100 µmol*m-2*s-1 - от 2 суток у psaL до 21 суток у ch1-1 . Для всех линий наблюдали более позднее наступление цветения при освещенности 100 µmol*m-2*s-1, чем при 150 µmol*m-2*s-1. Для растений дикого типа разница между индексом цветения при 150 µmol*m-2*s-1 и 100 µmol*m-2*s-1 составила 8 суток. Наименьшую разницу между индексом цветения при 150
µmol*m-2*s-1 и 100 µmol*m-2*s-1 наблюдали у растений rtn16 (4 сут), наибольшую - у ch1-1 (22 сут) (рис. 2С).
Состав хлорофиллов в листьях растений исследуемых линий при различной освещенности.
Определяли состав и соотношение хлорофиллов у растений линий Col-0 , psaL , rtn16 и ch1-1 , выращенных при освещенности 150 µmol*m-2*s-1 и 100 µmol*m-2*s-1 (рис. 3). Ни по одному из исследованных показателей (содержание хлорофилла а , хлорофилла b , соотношение хлорофиллов а/b ) не обнаружили достоверных различий между растениями, выращенными при 150 µmol*m-2*s-1 и 100 µmol*m-2*s-1. При этом наблюдали достоверно более низкое по сравнению с растениями дикого типа содержание хлорофилла а у растений ch1-1 и rtn16 , хлорофилла b – у растений rtn16 (растения ch1-1 полностью лишены хлорофилла b ). Несмотря на различия в содержании хлорофиллов а и b , их соотношение при обоих значениях освещенности у мутантных растений psaL и rtn16 не отличалось от данного показателя у растений дикого типа (рис. 3A, 3B, 3C).

Figure 1. Внешний вид растений арабидопсиса линий Col-0, rtn16, ch1-1, psaL . Растения выращивали стерильно в чашках Петри, возраст растений – 20 суток.
ch1-1 100 pmol ~ ch1-1 150 pmol "
rpl35 100 pmol rpl35 150 pmol
rtn16 100 pmol rtn16 150 pmol _ psaL 100 pmol " psaL 150 pmol .
Col-0 100 pmol Col-0 150 pmol
■ стадия 1
■ стадия 2
■ стадия 3
■ стадия 4
■ стадия 5
в
1 - Col-0 150 pmol
2 - Col-0 100 pmol
3 - psaL 150 pmol
4 - psaL 100 pmol
5 - ch1-1 150 pmol
6 - ch1-1 100 pmol
7 - rtn16 150 pmol
8 - rtn16 100 pmol
9 - rpl35 150 pmol
10 - rp/35 100 pmol
Figure 2. (A, B, C). Морфометрические показатели для растений линии Col-0 и мутантных линий, выращенных на земле. (А) Продолжительность стадий развития растений. Стадия 1 – от прорастания до разворачивания семядольных листьев, стадия 2 – от 1 до 2 настоящих листьев, стадия 3 – от 3 до 4 настоящих листьев, стадия 4 – от 5 до 8 настоящих листьев, стадия 5 – от 9 настоящих листьев до начала цветения. Слева обозначены названия линий и уровень освещенности в µmol*m-2*s-1 . (B) Средний диаметр розетки растений в разном возрасте. Справа обозначены названия линий и уровень освещенности в µmol*m-2*s-1. Звездочкой обозначена достоверность различий с растениями линии Col-0 в том же возрасте и тех же условиях. (С) Значения индекса цветения для исследуемых линий при различной освещенности. Справа обозначены названия линий и уровень освещенности в µmol*m-2*s-1.
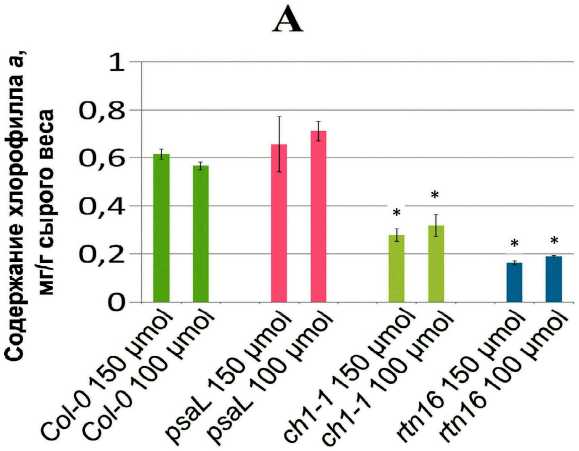
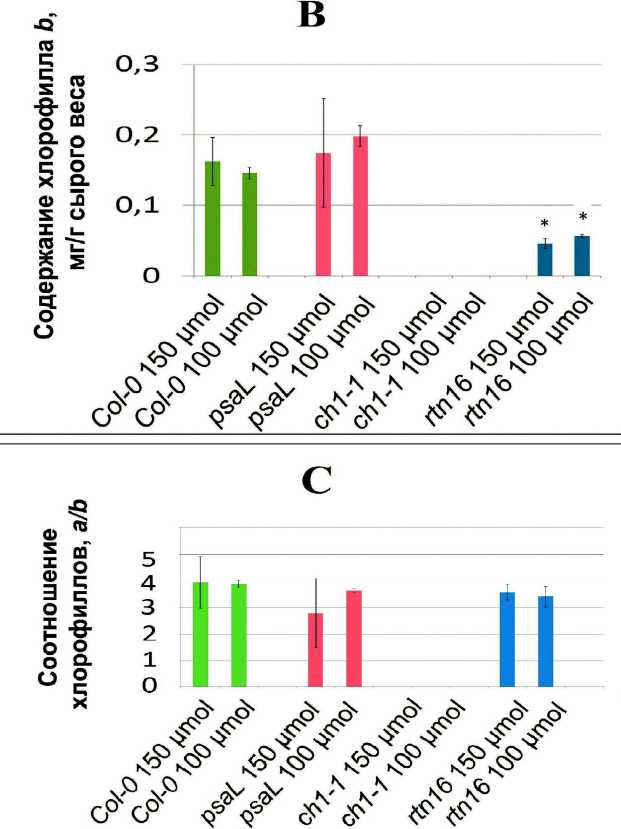
Figure 3. (A, B, C). Содержание хлорофиллов и соотношение хлорофиллов a/b в листьях растений исследованных линий при различной освещенности. (A) Содержание хлорофилла a . (B) Содержание хлорофилла b . (C) Соотношение хлорофиллов a/b . На всех диаграммах внизу обозначены названия линий и уровень освещенности. Звездочкой обозначена достоверность различий с растениями линии Col-0 в тех же условиях.
DISCUSSION
Каждая из четырех взятых в исследование мутантных линий арабидопсиса несет какой-либо дефект фотосинтетического аппарата: отсутствие L-субъединицы корового комплекса фотосистемы I у растений psaL ; отсутствие рибосомального белка, приводящее к нарушению пластидной трансляции, у rpl35 ; полное отсутствие хлорофилла b у ch1-1 ; значительное снижение содержания хлорофиллов у rtn16 . По внешнему виду наиболее яркие отличия от растений дикого типа наблюдали у растений с измененным составом хлорофиллов ( ch1-1, rtn16 ) (рис. 1). По морфометрическим показателям также выделялись ch1-1 и rtn16 . Замедление развития у растений этих двух линий по сравнению с растениями дикого типа, вероятно, можно напрямую связывать со сниженным содержанием хлорофиллов и пониженной способностью к фиксации углерода.
Интересно, что способность растений ch1-1 и rtn16 к адаптации к освещенности оказалась контрастной: для растений ch1-1 характерно сильное замедление развития и большая задержка начала цветения при понижении освещенности, тогда как для растений rtn16 , напротив, наблюдали минимальную разницу в скорости развития при 150 µmol*m-2*s-1 и 100 µmol*m-2*s-1. Мы видим для таких различий несколько взаимодополняющих объяснений.
Хлорофилл b необходим для сборки и функционирования большинства белков светособирающего комплекса II и обеспечивает его стабилизацию в тилакоидной мембране. В отсутствие хлорофилла b размер антенны уменьшается за счет деградации несвязанных с мембраной белков протеазами (Hoober and Eggink, 2001). Показано, что у растений ch1-1 отсутствие хлорофилла b приводит к дестабилизации и уменьшению размеров антенны светособирающего комплекса II (Yamasato et al., 2005), что, в свою очередь, снижает способность этих растений к фиксации углерода при слабой и умеренной освещенности. При этом повышение освещенности отчасти компенсирует уменьшенный размер антенн светособирающего комплекса II и уменьшает отставание ch1-1 в развитии от растений дикого типа (Ogawa et al., 2004). Любопытно, что небольшое (судя по отсутствию изменений в соотношении хлорофиллов у растений Col-0) снижение освещенности в наших экспериментах привело к такой значительной (22 суток) задержке цветения у растений ch1-1 по сравнению с растениями дикого типа (рис. 2С).
Для растений линии rtn16 нами были показаны ранее повышенный уровень активных форм кислорода и повышенная активность ряда антиоксидантных ферментов, причем все эти отличия от растений дикого типа были выражены у растений rtn16 тем сильнее, чем выше была освещенность. Мы пришли к выводу, что растения rtn16 на свету испытывают фотоокислительный стресс, сила которого возрастает с повышением уровня освещенности (Tarasenko et al., 2012). Вероятно, это одна из причин, по которым более высокая освещенность в наших экспериментах не приводила к значительному ускорению развития растений rnt16 (рис. 2А), а по среднему диаметру розетки различия между растениями rtn16, выращенными при 150 µmol*m-2*s-1 и 100 µmol*m-2*s-1, вовсе не наблюдали (рис. 2B). С другой стороны, хотя по суммарному содержанию хлорофиллов растения линий ch1-1 и rtn16 очень близки, соотношение хлорофиллов a/b у них резко различается: у растений rtn16 – не отличается от данного параметра у растений дикого типа, тогда как у растений ch1-1 хлорофилл b отсутствует полностью. Известно, что соотношение хлорофиллов a/b косвенно отражает соотношение числа фотосистем I и II в тилакоидной мембране (Biswal et al., 2012). В случае мутанта ch1-1 невозможно судить о соотношении числа фотосистем по содержанию хлорофиллов (при полном отсутствии хлорофилла b уменьшается размер антенн светособирающего комплекса II, но коровые комплексы фотосистемы II могут формироваться нормально), однако у растений rtn16 соотношение числа фотосистем I и II, судя по соотношению хлорофиллов, остается таким же, как у растений дикого типа. Возможно, это объясняет высокую приспособляемость к пониженной освещенности у растений rtn16.
Наши данные позволяют сделать некоторые выводы о значимости отдельных компонентов фотосинтетического аппарата для адаптации растений к уровню освещенности. Очевидно, что наибольшее влияние на характер развития растений оказало пониженное содержание хлорофиллов (линии ch1-1 и rtn16 ) и изменение соотношения хлорофиллов a/b (линия ch1-1 ).
Дефект пластидного рибосомального белка у растений линии rpl35 также приводил к замедлению развития и снижению среднего диаметра розетки во всех использованных условиях, но не приводил к существенному изменению (увеличению либо сокращению) разницы в сроках начала цветения при освещенности 150 µmol*m-2*s-1 и 100 µmol*m-2*s-1. Отсутствие L-субъединицы фотосистемы I практически не отразилось ни на одном из исследованных признаков растений линии psaL . Эта линия оказалась фенотипически наиболее близка к линии дикого типа. Предполагается, что субъединица L у высших растений, как и у водорослей, отвечает за стабильность сборки корового комплекса фотосистемы I (Ihalainen et al ., 2002). Однако отсутствие этой субъединицы, судя по нашим результатам, не является критичным для растений в условиях, близких к оптимальным.
ACKNOWLEDGMENT
Работа выполнена при финансовой поддержке РФФИ и Правительства Иркутской области (постановление № 545-пп от 29 октября 2015) грант 14-44-04001 р_сибирь_а. В работе использовано оборудование Байкальского аналитического центра (ЦКП) СО РАН при Президиуме ИНЦ СО РАН, а также оборудование ЦКП Фитотрон СИФИБР СО РАН.
Список литературы Влияние интенсивности света на развитие и содержание хлорофилла в мутантных растениях Arabidopsis с дефектами фотосинтеза
- Biswal A.K., Pattanayak G.K., Pandey S.S., Leelayathi S., Reddy V.S., Tripathy G., Tripathy B.C. (2012) Light intensity-dependent modulation of chlorophyll b biosynthesis and photosynthesis by overexpression of chlorophyllide a oxygenase in tobacco. Plant Physiol., 159(1), 433-449
- Hoober J.K., Eggink L. (2001) A potential role of chlorophylls b and c in assembly of light-harvesting complexes. FEBS Letters, 489(1), 1-3
- Ihalainen J.A., Jensen P.E., Haldrup A., van Stokkum I.H.M., van Grondelle R., Scheller H.V., Dekker Y.P. (2002) Pigment organization and energy transfer dynamics in isolated photosystem i (psi) complexes from Arabidopsis thaliana depleted of the PSI-G, PSI-K, PSI-L, or PSI-N subunit. Biophys. J., 83, 2190-2201
- Ivanov L.A., Ivanova L.A., Ronzhina D.A., Yudina P.K. (2013) Changes in the chlorophyll and carotenoid contents in the leaves of steppe plants along a latitudinal gradient in South Ural. Rus. J.Plant Physiol., 60(6), 812-820
- Ni Z., Kim E.-D., Yf M., Lackey E., Liu J., Zhang Y., Sun Q., Chen Z.J. (2009) Altered circadian rhythms regulate growth vigor in hybrids and allopolyploids. Nature, 457(7227), 327-331
- Ogawa K., Hatano-Iwasaki A.,Yanagida M., Iwabuchi M. (2004) Level of glutathione is regulated by atp-dependent ligation of glutamate and cysteine through photosynthesis in Arabidopsis thaliana: mechanism of strong interaction of light intensity with flowering. Plant Cell Physiol. 45(1), 1-8
- Oster U., Tanaka R., Tanaka A., Rudiger W. (2000) Cloning and functional expression of the gene encoding the key enzyme for chlorofhyll b biosynthesis (CAO) from Arabidopsis thaliana. Plant J., 21(30), 305-310
- Pesaresi P., Hertle A., Pribil M., Kleine T., Wagner R., Strissel H., Ihnatowicz A., Bonardi V., Scharfenberg M., Schneider A., Pfannschmidt T., Leister D. (2009) Arabidopsis STN7 kinase provides a link between short-and long-term photosynthetic acclimation. Plant Cell, 21, 2402-2423
- Tarasenko V.I., Garnik E.Yu., Katyshev A.I., Subota I.Yu., Konstantinov Yu.M. (2012) Disruption of Arabidopsis reticulon gene RTNLB16 results in chloroplast dysfunction and oxidative stress. Proceedings of the 2nd International Conference «Plant Genetics, Genomics, and Biotechnology», Irkutsk, 2012 -p.69
- Turbina I.N., Gorban M.V., Kravchenko I.V, Vdovkin R.S. (2013) Comparative characteristics of the photosynthetic pigments contents of some greenhouse plants under various conditions of illumination. Vestnik OSU, 12(161), 179-181
- Valladares F., Zaragoza-Castells J., Sanchez-Gomez D., Matesanz S., Alonso B., Portsmuth A., Delgardo A., Atkin O.K. (2008) Is shade beneficial for mediterranean shrubs experiencing periods of extreme drought and late-winter frosts? Ann. Bot., 102(6), 923-933
- Yamasato A., Nagata N., Tanaka R.,Tanaka A. (2005) The N-terminal domain of chlorophyllide a oxygenase confers protein instability in response to chlorophyll b accumulation in Arabidopsis. Plant Cell, 17, 1585-1597


