Влияние интервала времени между воздействием излучений разного качества на выживаемость клеток мышиной меланомы В-16
Автор: Исаева Е.В., Бекетов Е.Е., Наседкина Н.В., Малахов Е.П., Трошина М.В., Лычагин А.А., Ульяненко Л.Н., Ульяненко С.Е.
Рубрика: Научные статьи
Статья в выпуске: 1 т.28, 2019 года.
Бесплатный доступ
В современных схемах лучевой терапии злокачественных новообразований используются излучения различного качества. Последовательность облучения и интервал между воздействиями могут быть различными. При сочетанном гамма-нейтронном воздействии вклад нейтронов в суммарную очаговую дозу, как правило, колеблется от 20 до 40%. Принимая во внимание биофизические особенности заряженных частиц и особенности процессов клеточного поражения и восстановления, при разных режимах воздействия редко- или плотноионизирующего излучений можно ожидать отличный по силе поражающий эффект. В настоящей работе исследовано влияние длительности временного интервала между облучениями клеток мышиной меланомы В-16 g-квантами 60Со со средней энергией 1,25 МэВ и нейтронами с энергией 14,1 МэВ. Источником нейтронного излучения служил портативный нейтронный генератор (НГ-14) непрерывного действия, разработанный во ВНИИ автоматики им. Н.Л. Духова (Москва); источником гамма-излучения - установка «Луч». Облучение проводили в двух последовательностях: сначала гамма-излучение, затем нейтронное (g-n), и наоборот (n-g); интервал между воздействиями составлял 30, 60 и 120 минут. Эффективность облучения оценивали по количеству выживших клеток, определяемых по их клоногенной активности. Показано, что биологическая эффективность сочетанного действия нейтронов и фотонов не зависела от последовательности их применения. С увеличением длительности интервала между облучениями (от 30 до 120 мин) число выживших опухолевых клеток возрастало, т.е. в промежутках между воздействиями в клетках запускался механизм репарации сублетальных повреждений ДНК. Наиболее приемлемым, с точки зрения планирования схем сочетанной лучевой терапии, является интервал между облучениями фотонами и нейтронами независимо от их последовательности, не более 1 часа.
Быстрые нейтроны, нг-14, фотоны, сочетанное облучение, последовательность облучения, синергизм, репарация днк, клоногенная активность, меланома, клетки b-16
Короткий адрес: https://sciup.org/170171477
IDR: 170171477 | УДК: 616-006.04:612.014.482.4/6 | DOI: 10.21870/0131-3878-2019-28-1-59-67
Текст научной статьи Влияние интервала времени между воздействием излучений разного качества на выживаемость клеток мышиной меланомы В-16
Конкуренция в сфере разработки новых медицинских технологий, интенсивное внедрение методов ионной терапии, а также побочные негативные эффекты, наблюдавшиеся при лечении быстрыми нейтронами в 70-е годы прошлого столетия, привели к ограничению использования нейтронов и, как следствие, утрате возможностей реализации преимуществ нейтронной терапии в медицинской практике в целом [1]. В России дистанционная нейтронная терапия осуществляется в двух центрах: НИИ онкологии СО РАМН (Томск) и Уральском центре нейтронной терапии (Снежинск). В МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России (Обнинск) нейтронная терапия не проводится с 2002 г., с момента выведения из эксплуатации реактора БР-10 (АО «ГНЦ РФ – ФЭИ», Обнинск). Вместе с тем, исследования биологических эффектов нейтронов с использованием портативных нейтронных генераторов с энергией ~14 МэВ (ИНГ-031, НГ-14, НГ-24), разработанных во ВНИИ автоматики им. Н.Л. Духова (Москва) продолжаются как в опытах in vitro , так и in vivo [2-6].
Исаева Е.В. – с.н.с., к.вет.н.; Бекетов Е.Е.* – зав. лаб., к.б.н.; Наседкина Н.В. – лаб.-иссл.; Малахов Е.П. – м.н.с.; Трошина М.В. – н.с.; Лычагин А.А . – зав. лаб., к.ф.-м.н.; Ульяненко Л.Н. – в.н.с., д.б.н., проф.; Ульяненко С.Е. – зав. отделом, д.б.н. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Современные тенденции использования быстрых нейтронов в лучевой терапии заключаются в отказе от их самостоятельного применения [1, 7]. Вместо этого используют схемы сочетанного гамма-нейтронного воздействия, в которых вклад нейтронов в суммарную очаговую дозу колеблется от 20 до 40%. Теоретическим обоснованием сочетанного применения редко- и плотноионизирующего излучений является предположение [8], из которого следует, что излучения с высокой и низкой линейной передачей энергии (ЛПЭ) не действуют независимо друг от друга, а существует взаимодействие между двумя типами излучений. Характер этого взаимодействия может зависеть как от вклада плотноионизирующего компонента в суммарную дозу облучения, так и от последовательности применения излучений и временного интервала между воздействиями.
В проведённых ранее исследованиях нами было показано, что при одновременном облучении клеток мышиной меланомы В-16 γ-квантами 60Со и нейтронами с энергией 14,1 МэВ (с вкладом последних 15, 20 и 30% по физической дозе) по тесту клоногенной активности клеток наблюдался синергетический эффект [2, 9]. Целью данной работы являлось исследование влияния длительности временного интервала между облучениями нейтронами и γ-квантами в разной последовательности на сохранение эффекта синергетического взаимодействия.
Материалы и методы
Клеточная линия. В качестве экспериментальной тест-системы использовали культуру клеток мышиной меланомы В-16F10. Культуру клеток получили из ГУЗ «Московский НИИ медицинской экологии», выращивали в монослое в культуральных флаконах с площадью поверхности 25 см2 (Corning, США) в среде RPMI-1640 (ПанЭко, Россия) с добавлением 10% эмбриональной телячьей сыворотки (Biosera, Франция) и гентамицина (ПанЭко, Россия) из расчёта 0,01 мг/мл среды. Клетки культивировали в СО 2 -инкубаторе (MCO-5AC, Sanyo, Япония) при температуре +37 °С и 5% содержании СО 2 . Характеристика клеточной линии приведена в ранее опубликованной работе авторов [10].
Анализ клоногенной активности. Клетки облучали в монослое в чашках Петри диаметром 3,5 см (Corning, США). После облучения определяли их клоногенную активность. Клетки снимали с пластика смесью растворов версена (0,02%) и трипсина (0,25%) в соотношении 1:1, ресуспендировали в среде RPMI-1640 до получения одиночных клеток и подсчитывали в камере Горяева. Облучённые и интактные (без облучения) клетки высевали в чашки Петри диаметром 100 мм (Corning, США) в среду RPMI-1640 с добавлением 10% эмбриональной телячьей сыворотки. На одну чашку высевали по 10000 клеток, подвергшихся облучению, и по 1000 – без облучения. Чашки с клетками выдерживали в СО 2 -инкубаторе в течение 8-9 суток до формирования видимых невооружённым глазом колоний. По окончании инкубации культуральную среду удаляли, колонии окрашивали 2% раствором метиленового синего в 50% этаноле. Подсчёт вели на ручном счётчике Interscience Scan 100 (Франция), учитывая колонии, содержащие 50 и более клеток. Фракцию клоногенных клеток выражали в процентах по отношению к высеянным. Итоговая выживаемость представляла собой отношение выживаемости в экспериментальной и контрольной группах.
Процедура облучения. Источником нейтронного излучения служил портативный генератор нейтронов НГ-14 непрерывного действия, разработанный во ВНИИ автоматики им. Н.Л. Духова, Москва. Генератор позволяет получить практически моноэнергетические (7%) ней- троны с энергией, зависящей от угла вылета и энергии дейтронов (при угле вылета 90° независимо от энергии дейтронов - 14,1 МэВ) с интенсивностью до 1,5-1010 н/с. В качестве источника гамма-излучения (60Co) использовали установку «Луч» (Е=1,25 МэВ). Схема опыта включала два варианта облучения клеток в разной последовательности: сначала гамма-излучение, затем нейтронное (g-n), и наоборот – сначала нейтронное, затем гамма-излучение (n-g) с интервалами 30, 60 и 120 минут между воздействиями. В интервале между облучениями клетки находились в СО2-инкубаторе. Доза гамма-излучения составляла 4,5 Гр, мощность дозы ~1 Гр/мин; доза нейтронного излучения ~ 1,0 Гр, мощность дозы ~ 0,3 Гр/мин. Исследования проводили в трёх повторностях для каждого варианта опыта.
Статистическая обработка. Статистическую обработку результатов проводили с помощью программного обеспечения R ( версии 3.4.1 с применением пакета "multcomp". Сравнение выживаемости клеток в разных вариантах опыта – с применением дисперсионного анализа и критерия Тьюки. Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
Результаты исследований влияния длительности временного интервала между нейтронным и гамма-облучением в разной последовательности на клоногенную активность клеток меланомы В-16 свидетельствуют об эффекте взаимодействия повреждений, индуцированных разными видами излучения (рис. 1). Даже после двухчасового интервала между облучениями выживаемость клеток меланомы (~ 3%) была значительно ниже выживаемости, которую мы наблюдали при независимом действии двух агентов в тех же дозах (8-10%) в ранее опубликованном исследований [2]. Данный эффект может объясняться с позиций синергизма [8, 11]. Временной интервал между воздействием редко- и плотноионизирующего излучений может оказывать влияние на уровень клоногенной активности облучённых клеток. Увеличение интервала между облучениями от 30 до 120 минут сопровождалось повышением количества выживших клеток примерно в два раза (с 1,5 до 3,0%). Экстраполяция данных позволяет рассчитать выживаемость при отсутствии интервала между воздействием, которая составляет около 1%. Статистически значимое различие по критерию Тьюки отмечено для вариантов опыта с интервалами между облучениями 30 и 120 минут независимо от последовательности воздействия нейтронов или фотонов.
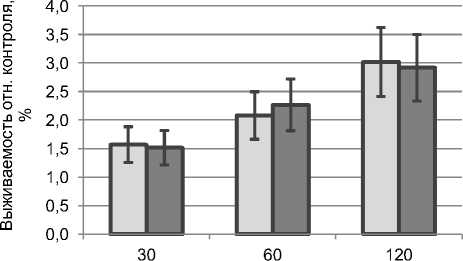
Интервал между облучениями, мин
Рис. 1. Выживаемость клеток меланомы B-16 (по данным клоногенной активности, средние значения и стандартные отклонения) в зависимости от интервала между облучениями: левый столбик – сначала облучение нейтронами затем фотонами (n-g), правый – фотонами, затем нейтронами (g-n).
Следовательно, как в случае первоначального воздействия фракции нейтронов (плот-ноионизирующее излучение), так и в случае первоначального воздействия фотонами (редкоио-низирующее излучение) имеется некоторый пул клеток, способных к восстановлению при наличии определённого временного интервала до следующей фракции (другого типа воздействия) и физиологических условий содержания клеток между облучениями (+37 оС, содержание 5% СО 2 ). Исходя из характера дозовых зависимостей обоих типов излучений (линейная для нейтронов и линейно-квадратичная для фотонов [2, 5]), следовало ожидать, что после облучения фотонами будет наблюдаться более выраженный рост выживаемости клеток с увеличением интервала между облучениями, в то же время наши данные не подтвердили это. При облучении нейтронами формируется достаточное количество сублетальных повреждений ДНК, которые после облучения фотонами становятся летальными для клетки. Можно предположить, что это связано с характером вторичных ионизирующих частиц, образующихся после облучения нейтронами с энергией 14,1 МэВ. В условиях протонного равновесия ~70% поглощённой дозы нейтронов обусловлено протонами и 30% – α-частицами и ядрами отдачи более тяжёлых элементов ткани C, N, O [12]. Таким образом, именно редкоионизирующий компонент вторичного излучения нейтронов с энергией 14,1 МэВ обеспечивает как взаимодействие повреждений, наносимых двумя видами излучений, так и их восстановление.
В основу современных представлений о механизмах синергетического действия двух агентов ионизирующей природы на клетку положены два предположения: они изменяют качество повреждений при сочетанном действии, приводя к формированию сложных кластерных повреждений, и/или влияют на клеточные механизмы восстановления этих повреждений. В пользу обеих точек зрения свидетельствуют результаты исследования Staaf и соавт. [13] о формировании гамма-фокусов в клетках, подвергнутых облучению смешанным пучком альфа-частиц и рентгеновских лучей. Авторами была выдвинута гипотеза, что наличие повреждений, вызванных рентгеновским излучением, изменяет механизм репарации ДНК и приводит к отсроченному ответу на более сложное повреждение, вызванное альфа-частицами. Позднее Sollazzo и соавт. [14] предположили, что повреждение ДНК, вызванное излучением с высокой ЛПЭ, приводит к изменению структуры хроматина, что делает ДНК более восприимчивой к воздействию активных форм кислорода, генерируемых излучением с низкой ЛПЭ. Cary и соавт. [15] и Zhang и со-авт. [16] показали, что гамма-нейтронное облучение усиливает экспрессию некоторых генов, в частности, фактора роста тромбоцитов (PDGF) и ангиопоэтина 2 (ANG2).
В отношении последовательного применения двух излучений разного качества и эффективности той или иной последовательности, опубликованные в литературе данные противоречивы. Их результаты зависят не только от характеристик излучений, но и изучаемых биологических систем. Некоторым доказательством большей эффективности режима, при котором фракция редкоионизирующего излучения предшествует облучению нейтронами, могут служить результаты облучения рентгеновскими лучами и ионами неона [17]. Меньшая эффективность режима облучения «n-g» по сравнению с обратной последовательностью («g-n») выявлена при действии нейтронов с энергией 3 МэВ на кожные покровы мышей [18]. Аналогичный вывод о большей эффективности режима «g-n» получен отечественными исследователями на проростках и покоящихся семенах Crepis Capillaris [19] и на дрожжах с использованием реакторных нейтронов [20].
О большей биологической эффективности облучения при предварительном нейтронном воздействии с последующим гамма-облучением («n-g») свидетельствуют многочисленные данные. С помощью метода ДНК-комет в исследованиях на лимфоцитах [21] показано, что предварительное облучение приводило к выраженному адаптивному ответу как в случае редкоионизи-рующего излучения (γ-γ), так и плотноионизирующего излучения 252Cf (n-n). Облучение в режиме γ-n также приводило к достоверному снижению эффективности облучения. Использование нейтронов в брахитерапии показало другой возможный механизм большей эффективности последовательности «n-g» [22]: идущая сначала фракция нейтронов 252Cf приводит к гибели гипоксических клеток, что провоцирует последующую реоксигенацию соседних клеток и уже через 5-6 суток после воздействия клетки опухоли оказываются более радиочувствительными к γ-излучению.
Кроме вывода о большей эффективности той или иной последовательности применения плотно- и редкоионизирующих излучений имеются данные и об отсутствии каких-либо различий при облучении сочетанным гамма-нейтронным излучением клеток китайского хомячка линии V79 [23-25]. Однако, в отличие от фундаментальных исследований in vitro , кроме противоопухолевого действия, в лучевой терапии решающую роль играет и действие излучения по отношению к здоровым тканям. С учётом того, что в здоровых и опухолевых клетках репаративные процессы выражены в разной степени, возможен подбор режима, который будет оказывать разнонаправленное действие в отношении опухолевых и нормальных клеток. Так, в исследованиях in vivo было показано, что фракционирование гамма-нейтронного излучения в режиме «g-g-n-n» по сравнению с обратной последовательностью обеспечивает как менее выраженные кожные реакций, так и повышение числа полностью излеченных животных [26].
Заключение
На основании полученных в рамках настоящего исследования экспериментальных данных на клетках меланомы В-16 можно сделать заключение о независимости эффективности сочетанного воздействия нейтронов портативного генератора НГ-14 (14,1 МэВ) и фотонов (60Со, 1,25 МэВ) от последовательности их применения. Это достаточно неожиданно ввиду большой разницы в ЛПЭ этих излучений и отличается от результатов ряда исследований о наличии зависимости развития поражения от последовательности применения излучений разного качества. Выживаемость клеток меланомы В-16 даже после двухчасового интервала между облучениями находится ниже уровня, ожидаемого, исходя из предположения о независимом действии нейтронов и фотонов, таким образом, эффект синергизма сохраняется в течение этого времени. Увеличение интервала между воздействиями нейтронов и фотонов, независимо от их последовательности («n-g», «g-n»), позволяет клеткам запускать и успешно реализовывать механизмы восстановления повреждений ДНК. Наиболее приемлемым, с точки зрения практической реализации результатов исследования, является интервал между облучениями фотонами и нейтронами независимо от их последовательности не более 1 ч. Однако данный вывод касается только противоопухолевой эффективности и не распространяется на действие такого сочетанного воздействия на здоровые ткани.
Данная работа проводилась в рамках выполнения тем государственного задания МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России за 2015-2017 гг. [27].
Список литературы Влияние интервала времени между воздействием излучений разного качества на выживаемость клеток мышиной меланомы В-16
- Wagner F.M., Specht H., Loeper-Kabasakal B., Breitkreutz H. Современное состояние терапии быстрыми нейтронами //Сибирский онкологический журнал. 2015. № 6. С. 5-12.
- Бекетов Е.Е., Исаева Е.В., Корякин С.Н. Лычагин А.А., Ульяненко С.Е. Зависимость эффективности одновременного воздействия гамма-квантов и нейтронов с энергией 14 МэВ от вклада плотноио-низирующего компонента //Радиация и риск. 2012. Т. 21, № 3. С. 82-90.
- Исаева Е.В., Бекетов Е.Е., Корякин С.Н., Лычагин А.А., Ульяненко С.Е. Сравнение биологической эффективности импульсного и непрерывного нейтронного излучения с энергией 14 МэВ на культуре клеток мышиной меланомы В-16 //Радиация и риск. 2012. Т. 21, № 2. С. 83-90.
- Лычагин А.А., Бекетов Е.Е., Корякин С.Н. Исаева Е.В., Ульяненко С.Е. Экспериментальная установка для облучения биологических объектов смешанными полями ионизирующих излучений разного качества //Медицинская физика. 2013. T. 59, № 3. С. 56-60.
- Isaeva E.V., Beketov E.E., Koryakin S.N., Ulyanenko S.E., Lychagin A.A. A comparative study of the biological effectiveness of 14-МеУ neutron pulse and continuous radiation using mouse B-16 cells //Radiat. Prot. Dosimetry. 2014. V. 161, N 1-4. P. 478-482.
- Корякин С.Н., Кайдан Н.А., Исаева Е.В., Ульяненко Л.Н., Лычагин А.А., Ульяненко С.Е. Опыт применения портативного отечественного нейтронного генератора в схемах гамма-нейтронной терапии домашних животных со злокачественными новообразованиями //Радиация и риск. 2018. Т. 27, № 1. С. 94-106.
- Мардынский Ю.С., Гулидов И.А., Аминов Г.Г., Рагулин Ю.А., Сысоев А.С. Сочетанная (фотонно-нейтронная) терапия в комплексном лечении местнораспространённого рака молочной железы //Вопросы онкологии. 2014. Т. 60, № 4. С. 489-492.
- Zaider M., Rossi H.H. The synergistic effect of different radiation //Radiat. Res. 1980. V. 83, N 3. P. 732-739.
- Бекетов Е.Е. Влияние сочетанного гамма-нейтронного облучения на гибель опухолевых клеток in vitro и in vivo: дис. ... канд. биол. наук. Обнинск, 2012. 139 с.
- Beketov E., Isaeva E., Malakhov E., Nasedkina N., Koryakin S., Ulyanenko S., Solovev A., Lychagin A. The study of biological effectiveness of U-70 accelerator carbon ions using melanoma B-16 clonogenic assay //Rad. Applic. 2017. V. 2, N 2. P. 90-93.
- McNally N., de Ronde J., Hinchliffe M. The effect of sequential irradiation with X-rays and fast neutrons on the survival of V79 Chinese hamster cells //Int. J. Radiat. Biol. 1984. V. 45, N 4. P. 301 -310.
- Caswell R.S., Coyne J.J., Randolph M.Z. Kerma factors for neutron energies below 30 MeV //Radiat. Res. 1980. V. 83, N 2. P. 217-254.
- Staaf E., Brehwens K., Haghdoost S., Czub J., Wojcik A. Gamma-H2AX foci in cells exposed to a mixed beam of X-rays and alpha particles //Genome Integr. 2012. V. 3, N 1. P. 8.
- Sollazzo A., Shakeri-Manesh S., Fotouhi A., Czub J., Haghdoost S., Wojcik A. Interaction of low and high LET radiation in TK6 cells-mechanistic aspects and significance for radiation protection //J. Radiol. Prot. 2016. V. 36, N 4. P. 721-735.
- Cary L.H., Noutai D., Salber R.E., Williams M.S., Ngudiankama B.F., Whitnall M.H. Interactions between endothelial cells and T cells modulate responses to mixed neutron/gamma radiation //Radiat. Res. 2014. V. 181, N 6. P. 592-604.
- Zhang J., He Y., Shen X., Jiang D., Wang Q., Liu Q., Fang W. y-H2AX responds to DNA damage induced by long-term exposure to combined low-dose-rate neutron and y-ray radiation //Mutat. Res. Genet. Toxicol. Environ. Mutagen. 2016. N 795. P. 36-40.
- Ngo F., Blakely E., Tobias C. Sequential exposures of mammalian cells to low- and high-LET radiations //Radiat. Res. 1981. V. 87, N 1. P. 59-78.
- Joiner M., Brenner J., Denekamp J., Maughan E. The interaction between X-rays and 3 MeV neutrons in the skin of the mouse foot //Int. J. Radiat. Biol. 1984. V. 46, N 5. P. 625-638.
- Фесенко Э.В., Лучник Н.В. Влияние комбинированного гамма-нейтронного облучения на образование структурных мутаций //Фундаментальные и прикладные аспекты нейтронной радиобиологии. Сборник научных работ. Обнинск: НИИМР АМН СССР, 1985. С. 54-64.
- Цыб Т.С., Пахомова О.Н. Летальные эффекты последовательного действия у-излучения и быстрых (0,85 МэВ) реакторных нейтронов у клеток дрожжей Saccharomyces //3-й съезд по радиационным исследованиям. Пущино, 1997. Т. 1. С. 138-139.
- Gajendiran N., Tanaka K., Kumaravel T., Kamada N. Neutron-induced adaptive response studied in go human lymphocytes using the comet assay //J. Radiat. Res. 2001. V. 42, N 1. P. 91-101.
- Втюрин Б.М., Иванов В.К., Иванов В.Н., Медведев В.С., Абдукадыров С.А. Сочетанная нейтронная и гамма-терапия рака языка //Медицинская радиология. 1986. № 9. С. 14-19.
- Higgins P., DeLuca P., Pearson D., Gould M. V79 survival following simultaneous or sequential irradiation by 15-MeV neutrons and 60Co photons //Radiat. Res. 1983. V. 95, N 1. P. 45-56.
- McNally N., de Ronde J., Hinchliffe M. Survival of V79 cells following simultaneous irradiation with X-rays and neutrons in air or hypoxia //Int. J. Radiat. Biol. 1985. V 48, N 5. P. 847-855.
- Suzuki S. Survival of Chinese hamster V79 cells after irradiation with a mixture of neutrons and 60Co gamma rays: experimental and theoretical analysis of mixed irradiation //Radiat. Res. 1993. V 133, N 3. P. 327-333.
- Обатуров Г.М., Соколов В.А., Ульяненко С.Е., Цыб Т.С. Актуальные проблемы радиобиологии нейтронов //Радиационная биология. Радиоэкология. 1997. Т. 37, № 4. С. 475-481.
- Каприн А.Д., Галкин В.Н., Жаворонков Л.П., Иванов В.К., Иванов С.А., Романко Ю.С. Синтез фундаментальных и прикладных исследований - основа обеспечения высокого уровня научных результатов и внедрения их в медицинскую практику //Радиация и риск. 2017. Т. 26, № 2. С. 26-40.


