Влияние инвазии трематод на терморезистентность популяции Lymnaea stagnalis (Gastropoda, Pulmonata) из пойменного водохранилища реки Ангара
Автор: Голубев А.П., Бодиловская О.А., Хомич А.С., Коротчикова Н.В., Верещагина К.П., Лубяга Ю.А., Щапова Е.П., Шатилина З.М., Аксенов-грибанов Д.В.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 2 т.11, 2015 года.
Бесплатный доступ
Определены средние термины (АТ) выживания при 35 ° С в созревании Lymnaea stagnalis с различными уровнями инвазии трематод. Были неинвазированные индивидуумы из естественной популяции L. stagnalis и лабораторной культуры; (задние спороцисты и красные) и сильно вторглись (многочисленные церкарии) из естественного населения. Значения AT для обеих неинвазированных групп были практически одинаковыми (соответственно 31,6 и 32,4 часа). Значения AT для сильно инвазивных (18,0 часов) были значительно ниже (p
Короткий адрес: https://sciup.org/14323968
IDR: 14323968
Текст научной статьи Влияние инвазии трематод на терморезистентность популяции Lymnaea stagnalis (Gastropoda, Pulmonata) из пойменного водохранилища реки Ангара
Возрастающее антропогенное загрязнение пресных водоемов становится все более острой экологической и социальной проблемой. В связи с этим особую актуальность приобретают вопросы разработки достаточно простых и информативных методов биоиндикации его воздействия на биоту водоемов, которые возможно применить в мониторинговых и серийных экологотоксикологических исследованиях (Golubev et al ., 2013; Batyan et al ., 2009 и др.). Одним из них является определение средней термоустойчивости особей и популяций, т.е. среднего времени выживания выборки особей при определенной стандартной, обычно постоянной температуре.
Повышение температуры среды вызывает практически у всех видов интенсификацию синтеза белков теплового шока (БТШ) (Clark et al., 2008). Известно, что синтез БТШ имеет место и при воздействии на организм стрессовых факторов различной природы, в том числе антропогенного загрязнения водоемов (Kregel, Kevin, 2002; Roberts et al., 2010). Молекулы БТШ, которые начинают синтезироваться в клетке уже после непродолжительного воздействия стрессовых факторов (Sung, 2014), обеспечивают правильную укладку и сборку вновь синтезируемых белков клетки, что повышает устойчивость организмов к негативным факторам среды. Поэтому термоустойчивость является простым и информативным критерием адаптивных способностей популяций (Verbitskiy, 2013) и показателем их общей резистентности к широкому спектру стрессовых факторов.
Одним из распространенных модельных видов, используемых для оценки последствий загрязнения пресных водоемов умеренной зоны Евразии для их биоты, является легочный моллюск Lymnaea stagnalis Linnaeus, 1758 (Gnatishina et al ., 2011). Однако интенсификацию синтеза БТШ у L. stagnalis могут вызывать не только негативные факторы внешней среды, но и паразитарная инвазия. Нами установлено, что у L. stagnalis из ряда водоемов Беларуси, в том числе из незагрязненного озера Нарочь, инвазированных личинками трематод, отмечено существенное повышение концентрации ряда изоформ БТШ (БТШ70 и др.) (Golubev et al ., 2013).
Большой прудовик является промежуточным хозяином более чем 20 видов трематод (Bryozoa, 1984). Попадающие в организм моллюсков личинки первой свободноживущей стадии трематод (мирацидии) обычно локализуются в пищеварительной железе (печени). Там они проходят последовательные стации спороцисты, редии и церкарии – второй свободноживущей стадии. Последние заражают своих основных хозяев, преимущественно, водоплавающих и околоводных птиц, где превращаются во взрослую стадию – мариту. Последние производят яйца, из которых при попадании в воду выходят мирацидии (Beer, Voronin, 2007).
Массовое партеногенетическое размножение личинок на стадиях спороцисты и редии оказывает существенное негативное воздействие на состояние моллюсков, что приводит к изменениям целого ряда их физиологических и биохимических показателей, рассматриваемых как биомаркеры для оценки последствий воздействия стрессовых факторов на биоту водоемов (Berger, Kondratenkov, 1974; Galaktionov, 1993; Stadnichenko et al., 1999; Russo, Lagadic, 2000; Berger et al., 2001; Galaktionov et al., 2002; Ataev, Polevchshikov 2004). В частности, отмечено существенное снижение термоустойчивости у инвазированных брюхоногих моллюсков (Vernberg, 1963; Levakin, 2004). С другой стороны, в ряде случаев отмечены нейтральные и даже положительные эффекты паразитарной инвазии на стрессоустойчивость моллюсков (Sousa, Gleason, 1989; Galaktionov et al., 1990, 1993).
Логично предположить, что одной из причин подобных противоречий являются диаметрально противоположные воздействия на резистентность моллюсков двух факторов – паразитарной инвазии, снижающей жизнестойкость особей, и, вызванной ею же интенсификацией синтеза БТШ, повышающих их общую устойчивость. В ходе настоящей работы нами проведены исследования воздействия разной степени инвазированности личинками трематод на терморезистентность L. stagnalis .
MATERIALS AND METHODS
Исследования проводили на особях из природной популяции L. stagnalis пойменного водоема, связанного с р. Ангара (52°26.83’ с.ш., 104°28.13’ в.д.). Водоем находится в рекреационной зоне г. Иркутска, его существенное антропогенное загрязнение отсутствует (State report, 2014).
В середине сентября 2012 г. из водоема была отловлена группа из 25 ювенильных особей в возрасте 1,5 – 2 месяца (высота раковины до 10 – 12 мм). Через 2 суток после отлова, особи были доставлены в Международный государственный экологический университет им. А.Д. Сахарова. Там они были помещены в емкость с водой объемом 10 л, где были дорощены до размеров половозрелых особей. В декабре 2012 – январе 2013 гг. в результате перекрестного оплодотворения от них были получены кладки.
Молодь, отрожденную из этих кладок, выращивали при плотности 10 – 12 экз·л-1 до возраста 5 – 5,5 месяцев (конец мая 2013 г.). Температура воды в период выращивания изменялась в пределах от 17 –19°С (декабрь – январь) до 22 – 24°С (в мае). В качестве корма использвовали свежую ботву салата. Смену воды и корма проводили не реже 2 раз в неделю. Таким образом, особи лабораторной культуры L. stagnalis не могли быть инфицированы паразитами.
Первая серия экспериментов проведена в конце мая 2013 г. – у случайной выборки из 24 половозрелых особей (высота раковины 25 – 35 мм) определяли термоустойчивость, т.е. среднее время их выживания при постоянной температуре 35°С, что соответствует полулетальной температуре для L. stagnalis (Sidorov, 2003). Для этого и всех последующих экспериментов использованы только особи, находившиеся в хорошем физиологическом состоянии. Последнее оценивалось визуально – по силе прикрепления моллюсков к вертикальным стенкам сосудов. Группы по 6 особей садили в сосуды объемом 1 л, которые помещали в термостат, где поддерживали постоянную температуру 35±0,1°С.
Сосуды с моллюсками проверяли каждые 30 минут и отмечали число погибших особей, которых немедленно удаляли. Гибель особей определяли по отсутствию реакции ноги на легкий укол энтомологической булавкой.
Вторая серия экспериментов была проведена с особями из природной популяции L. stagnalis водоема в черте г. Иркутска. В конце июля 2013 г. в нем было отловлено 115 половозрелых особей, которые были разделены случайным образом на 2 группы. У первой группы, численностью 67 особей, была определена зараженность личинками трематод общепринятым методом компрессии (Dorozhenkova, Bekish, 2007), для чего выделенную из тела моллюска пищеварительную железу раздавливали в капле воды между двумя предметными стеклами и полученную жидкость просматривали под бинокулярным микроскопом МБС-10 (увеличение х56) для выявления наличия в ней промежуточных стадий развития трематод – спороцист, редий и церкариев. В случае обнаружения церкариев, их таксономическую принадлежность определяли по (Viderker et al ., 2009).
У второй группы, численностью 48 особей, через двое суток после доставки в лабораторию, определяли термоустойчивость по методике, аналогичной использованной для особей из лабораторной культуры (первая серия экспериментов). У погибших моллюсков сразу же после удаления из экспериментального сосуда определяли инвазированность личинками трематод.
Основными хозяевами трематод являются гомойотермные животные (птицы и млекопитающие), температура тела которых достигает 37 – 41°С, поэтому температура 35°С для личинок трематод не является летальной. По нашим наблюдениям, редии и церкарии во внутренних органах моллюсков, погибших в ходе температурной экспозиции при 35оС, оставались живыми еще в течение не менее 2–3 ч. Методики определения терморезистентности и инвазированности особей из данной группы аналогичны описанным выше.
По степени инвазированности все исследованные моллюски из приодной популяции были разделены на три группы. Первую группу составили неизвазированные особи, в печени которых не были обнаружены личинки трематод. Ко второй группе были отнесены слабо инвазированные моллюски. В их печени имелись спороцисты и редии, однако печень оставалась еще неразрушенной, церкарии еще не появились или были немногочисленными. У моллюсков третьей группы печень была полностью разрушенной, в ней наряду с редиями имелись многочисленные церкарии.
Для каждой исследованной группы были рассчитаны значения средней длительности выживания особей при содержании в 35°С (AT), периоды 50%-ной гибели особей (LD-50), ошибку средней (δ), коэффициенты дисперсии (σ) и вариации (C.V.) для AT, время 50%-ной гибели особей (LD-50). Для моллюсков из поймы р. Ангара аналогичные расчеты выполнены как для всей экспериментальной группы, так и отдельно для выборок инвазированных и неинвазированных особей. Достоверность различий между средними значениями AT для исследованных выборок определяли по непараметрическому критерию Манна – Уитни. Различия считались статистически значимыми при p < 0,05. Статистический анализ данных проводили с использованием программы Statistica 8.0.
RESULTS
Природная популяция L. stagnalis в период отбора проб (конец июля 2013 г.) отличалась высокой степенью инвазированности. Из общей выборки 115 особей, извазированными личинками разных стадий трематод оказались 99 особей, т.е. 84,6%. Церкарии были отмечены у 90 особей (третья группа), или у 78,2% от общей выборки. Высокая инвазированность данной популяции может объясняться целым рядом факторов. Прежде всего, средняя продолжительность жизни L. stagnalis в водоемах умеренной зоны составляет 1 – 1,5 года. Длительность развития личинок большинства видов трематод умеренной зоны Евразии (от проникновения мирацидиев в моллюска до появления церкариев) равна приблизительно 6 – 7 недель (Scriabine, 1951). Поэтому мирацидии, попавшие в начале лета в организм моллюсков (вскоре после весеннего прилета птиц), способны уже к середине лета пройти в них цикл развития до стадии церкариев. Моллюски, инфицированные трематодами, не способны от них избавиться и потому остаются зараженными до конца своего жизненного цикла. Второй важной причиной может быть большая численность птиц вблизи водоема и низкая скорость течения воды в нем, что увеличивает вероятность заражения моллюсков мирацидиями.
Церкарии были обнаружены у 93-х особей из природной популяции. Из них у 85-ти особей (91,4%) отмечены церкарии видов семейства Echinostomatidae. По две особи были заражены церкариями видов из семейств Diplostomidae и Strigeidae. Еще у одной особи отмечено заражение двумя видами трематод из семейств Echinostomatidae и Schistosomatidae, что является редким случаем для моллюсков. Виды трематод из семейств Echinostomatidae, Diplostomidae и Strigeidae не являются патогенными для человека, однако на стадии мариты они вызывают серьезные заболевания у водоплавающих птиц.
У 4-х моллюсков были обнаружены церкарии видов Schistosomatidae. Виды данного семейства из родов Trichobilharzia и Bilharziella , распространенных в умеренной зоне Евразии, являются потенциально патогенными для человека. Их церкарии, попавшие на кожные покровы находящегося в воде человека (неспецический, или тупиковый хозяин), могут вызвать специфическое аллергическое заболевание – церкариальный дерматит (Bayer, Voronin, 2007). Инвазированность моллюсков видами семейства
Schistosomatidae, считая и случай двойного заражения, очень низка - 4,3% от общего числа проанализированной выборки. Тем не менее, даже такой уровень считается вполне достаточным для поддержания устойчивого очага церкариоза в водоеме (Zhukova, Ostapenya, 2007).
Во всех сериях экспериментов термоустойчивость (AT) отдельных особей L. stagnalis изменялась в широких пределах (табл.1, рис. 1). Диапазон изменчивости по AT у особей из лабораторной культуры составил от 2 до 53 ч., а из природной популяции (общая выборка) от 4 до 47 ч. Значения коэффициентов вариации (С.V.) по этому показателю для общих выборок из лабораторной и природной популяции составляют 46,6 и 51,2% соответственно. Тем не менее, среднее значение AT для лабораторной культуры оказалось существенно выше, для природной популяции – 32,4 и 22,5 ч. соответственно. Установленные различия оказались статистически значимыми (р < 0,01) (табл. 2).
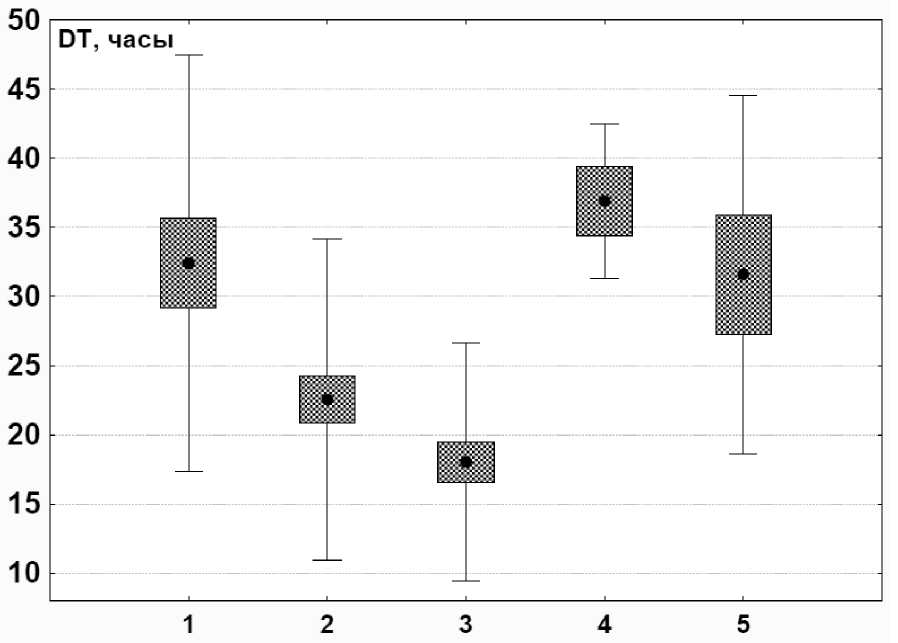
Рисунок 1 . Вариабельность по термоустойчивости (AT) в группах инвазированных и неинвазированных особей Lymnaea stagnalis .
1. Неинвазированные особи из лабораторной культуры. 2. Массовая выборка особей из популяции р. Ангара. 3. Особи из р. Ангара с высоким уровнем инвазированности. 4. Особи из р. Ангара с низким уровнем инвазированности. 5. Неинвазированные особи из р. Ангара. Точки – средние значения AT; прямоугольники – ошибка средней; усы – стандартное отклонение.
Таблица 1 . Термоустойчивость инвазированных и неизвазированных особей L. stagnalis
|
№ выборок |
Выборки особей |
Число особей |
AT min – ATmax, часы |
Среднее AT ± σAT, часы |
δ , часы |
C.V., %% |
|
1 |
Особи из лабораторной культуры |
22 |
2 – 53 |
32,4 ± 15,1 |
3,2 |
46,6 |
|
2 |
Особи из природной популяции |
48 |
4 – 47 |
22,5 ±11,6 |
1,7 |
51,2 |
|
В их числе: |
||||||
|
3 |
Неинвазированные особи (первая группа) |
9 |
4 – 47 |
31,6 ±13,0 |
4,3 |
41,0 |
|
4 |
Слабо инвазированные особи (вторая группа) |
5 |
29,5 – 44 |
36,9 ±5,6 |
2,5 |
15,1 |
|
5 |
Сильно инвазированные особи (третья группа) |
34 |
4 – 40 |
18,0 ±8,6 |
1,5 |
47,7 |
Таблица 2. Уровни значимости (р) различий средней терморезистентности в выборках L. stagnalis при попарных сравнениях по критерию Манна – Уитни
|
№ выборок* |
2 |
3 |
4 |
5 |
|
1 |
р = 0,0047** |
p = 0,7277 |
p = 0,6849 |
p = 0,0002 |
|
2 |
p = 0,0429 |
p = 0,0081 |
p = 0,0911 |
|
|
3 |
p = 0,5050 |
p = 0,0036 |
||
|
4 |
p = 0,0006 |
* номера выборок соответствуют таковым в табл. 1.
** жирный шрифт – различия статистически достоверны при уровне значимости p < 0,05.
DISCUSSION
На термоустойчивость особей L. stagnalis из природной популяции значительное воздействие оказывает паразитарная инвазия. Термоустойчивость неинвазированных особей (первая группа) практические не отличалась от таковой для моллюсков из лабораторной культуры (среднее AT = 31,6 ч.). Для слабо инвазированных моллюсков (вторая группа) этот показатель оказался даже несколько более высоким (среднее AT = 36,9 ч.), чем для лабораторной культуры, однако различия оказались статистически незначимыми (р > 0,05).
Наименьшей термоустойчивостью отличались особи третьей группы, в печени которых были обнаружены многочисленные церкарии; среднее значение AT для них снизилось до 18,0 ч. Различия этого показателя для третьей группы с аналогичными показателями для первых двух групп из природной популяции L. stagnalis оказались высоко достоверными (р < 0,01).
Продукция церкариев у L. stagnalis может быть очень высокой. Ранее нами установлено, что у L. stagnalis из озера Нарочь суточная продукция церкариев изменялась в пределах от нескольких сотен до 15 000 экземпляров на одного моллюска (Golubev et al ., 2008). По другим данным продукция церкариев у L. stagnalis может достигать до 500 000 экземпляров в сутки (Haas, 2003).
Размеры церкариев трематод достаточно велики – от 0,5 мм у видов семейства Echinostomatidae до 1 – 1,3 мм у видов родов Trichobilharzia и Bilharziella семейства Schistosomatidae (Dorozhenkova, Bekish, 2007). Для поддержания такой высокой интенсивности продукции церкариев редиям необходимы значительные пищевые и энергетические ресурсы. Ими являются запасы гликогена, которые концентрируются преимущественно в печени моллюсков. Быстрое потребление редиями гликогена приводит к разрушению печени и нарушению нормального пищеварения моллюсков, что оказывает значительный негативный эффект на их биохимические параметры и физиологическое состояние. При высокой степени инвазированности у моллюсков имеет место существенное снижение плодовитости, вплоть до полного прекращения размножения («паразитическая кастрация») (Kennedy, 1978).
Наряду с этим, заражение личинками трематодами вызывает у моллюсков интенсификацию синтеза БТШ. В начальный период развития трематод (до массового продуцирования церкариев) их личинки не оказывают существенного негативного воздействия на физиологическое состояние своих хозяев, а индуцированный ими синтез БТШ, напротив, способствует повышению их термоустойчивости. Однако в дальнейшем интенсивная продукция церкариев приводит к истощению пищевых и энергетических ресурсов в организме моллюсков. Это уже не может быть компенсировано синтезом БТШ (БТШ70), что приводило к резкому снижению жизнестойкости моллюсков, одним из критериев которых является термоустойчивость.
Неодинаковое воздействие разной степени патогенности трематод на сроки выживания при 42°С показано в исследованиях на примере Нydrodia ulvae, инвазированном двумя видами трематод – Bunocotyle progenetica и Cryptocotyle cancavum (Levakin, 2004). При этом В. progenetica весь жизненный цикл проходит в моллюске, вплоть до марит. Последние развиваются внутри редий, поэтому гибель моллюска является необходимым условием попадания яиц марит во внешнюю среду. Напротив, развитие C. cancavum в моллюсках происходит только до стадии церкарии, поэтому данный вид является для своих хозяев менее патогенным, чем В. progenetica. Сроки выживания моллюсков, инвазированных В. progenetica оказались значительно более низкими, чем инвазрованных C. cancavum, а зараженных C. cancavum – лишь незначительно уступали таковым у незараженных особей.
В настоящих экспериментах по термоустойчивости церкарии были обнаружены у 34-х особей из природной популяции, из которых у 33-х особей оказались церкарии видов семейства Echinostomatidae и лишь у одной – семейства Schistosomatidae. Это не позволило выявить возможное воздействие личинок видов из разных семейств трематод на термоустойчивость своих хозяев, однако, очевидно, что этот важный вопрос требует дальнейших исследований.
Виды всех семейств трематод, обнаруженных нами у моллюсков из исследованной популяции, имеют одинаковые жизненные циклы – они покидают моллюсков на стадии церкарии. Лишь личинки семейства Echinostomatidae при массовом развитии в организме моллюсков приводят к их паразитической кастрации. Личинки других семейств трематод подобного эффекта не вызывают, хотя и могут существенно снижать плодовитость своих хозяев (Jourdane, Kulo, 1982; Fashuyi, 1986). Наши исследования на L. stagnalis из озера Нарочь подтвердили этот вывод (Golubev et al ., 2008).
С другой стороны, у зараженных личинками трематод легочных моллюсков может наблюдаться увеличение размеров особей. Это обычно объясняется перераспределением энергетических ресурсов организма с образования половых продуктов на увеличение массы тела, что может в определенной степени повысить устойчивость организма к негативным факторам среды (Sousa, 1983; Sousa, Gleason, 1989).
В целом, термоустойчивость L. stagnalis является весьма лабильным показателем не только у особей из природных популяций, но даже у неинвазированных особей из лабораторной культуры, выращенных в относительно стабильных и близких к оптимальным условиях. Высокий уровень вариабельности по AT у последних может объясняться индивидуальными различиями в физиологическом состоянии особей и особенностями экспрессии БТШ.
Тем не менее, есть серьезные основания предполагать, что терморезистентность природных популяций L. stagnalis в значительной степени определяется долей в них особей, инвазированных личинками трематод, а также стадией развития последних. Эти обстоятельства необходимо учитывать при мониторинговых и экотоксикологических исследованиях с организмами из природных популяций. Таким образом, методически правильным является проведение подобных исследований только на особях, незараженных личинками трематод.
ACKNOWLEDGEMENTS
Работа выполнена в рамках Задания № 5.3.14 Государственной программы научных исследований Республики Беларусь «Химические технологии и материалы, природно-ресурсный потенциал», а также при частичной финансовой поддержке проектов МИНОБРНАУКИ РФ (ГЗ 1354–2014/51; 6.382.2014/K [приобретение расходных материалов]), РНФ (14-14-00400
[приобретение оборудования]), CRDF (FSCX-15-61168-0 [приобретение расходных материалов]), РФФИ (14-04-00501, 15-04-06685, 15-54-04062, 15-29-01003 [выплата вознаграждений исполнителям проектов]) и ФГБОУ ВПО «ИГУ».
Список литературы Влияние инвазии трематод на терморезистентность популяции Lymnaea stagnalis (Gastropoda, Pulmonata) из пойменного водохранилища реки Ангара
- Atayev G. L., Polevschikov A. V. (2004) Defense reactions of gastropods. 1. Cellular reaction. Parasitologia, 38(4), 342-351
- Batyan A.N., Frumin G.T., Bazylev V.N. (2009) Foundations of general and environmental toxicology. SPb.: SpetzLit. 352
- Bedulina D.S., Evgen’ev M.B., Timofeyev M. A., Protopopova M.V., Garbuz D.G., Pavlichenko V.V., Luckenbach T., Shatilina Z.M., Axenov-Gribanov D.V., Sokolova I. M., Zatsepina O.G. (2013) Expression patterns and organization of the hsp70 genes correlate with thermotolerance in two congener endemic amphipod species (Eulimnogammarus cyaneus and E.verrucosus) from Lake Baikal. Mol. Ecol., 2, 1416-430
- Beer S.A., Voronin M.V. (2007) Cercarial dermatitis in the urbanized ecosystems. Moscow: Nauka. 240
- Berger V.J., Galaktionov K.V., Prokofiev V.V. (2001) The impact of parasites on adaptation of host to abiotic environmental factors: host-parasite system parthenites of trematodes -mollusks. Parasitologia, 35(3), 192-200
- Berger V.J.,Kondratenkov A.P. (1974) The influence of infestation Hydrobia ulvae of trematode larvae on the resistance to desiccation and desalination. Parasitologia, 8(6), 56-564
- Bryozoa, Molluska, Arthropoda. (1984) Ser. “Animal world of Moldavia”. Chişinău: Stiinta Publ. 304
- Clark M.S., Fraser K.P.H., Peck L.S. (2008) Antarctic marine mollusks do have an HSP70 heat shock response. Cell Str.Chap., 13, 39-49
- Dorozhenkova T.E., Bekish O.J. (2007) A method for determining of the cercariae species of bird trematodes Shistosomatidae in the gastropods. Instruction on the application. Minsk: Ministry of Health of the Republic of Belarus. 8
- Fashuyi S.A. (1986) Field observations on the possibility of using echinostomes to control schistosome infections in snails. Helmintologia, 23(1), 37-41
- Galaktionov K.V., Berger V.J., Prokofiev V.V. (2002) Comparison of resistance to environmental factors of mollusk Hydrobia ulvae, infected parthenitae of trematodes and free from infestation. Parasitology, 36(3), 195-202
- Gnatishina L.L., Fal’fushinskaya G.I., Golubev O.P., Dallinger R., Stoliar O.B. (2011) Role of metallothioneins in adaptation of Lymnaea stagnalis (Mollusca: Pulmonata) to environment pollution. Hydrobiol. J., 47(5), 56-66
- Golubev A.P., Aksenov-Gribanov D.V., Timofeyev M.A. (2013) The application of integrated approach on assessment of the impact of anthropogenic contamination on the freshwater biota. Ecol. Ves., 3(25), 106-115
- Golubev A.P., Samtzova E.A., Malukha N.Yu., Bodilovskaya O.A., Aksenov-Gribanov D.V., Lubyaga Yu.A., Gurkov A.V., Vereschagina K.P., Schapova E.H., Timofeyev M.A. (2013) The impact of parasitic invasion on biochemical parameters in Lymnaea stagnalis (Gastropoda, Pulmonata). In: Sakharov Readings 2008: Environmental problems of XXI the century. Minsk. 168
- Golubev A.P., Zhukova T.V., Bodilovskaya O.A., Slesareva L.E., Godun K.V.(2008) The demographic characteristics of interacting populations of pond snail Lymnaea stagnalis (Gastropoda, Pulmonata) and trematodes of Echinostomatidae family. Ecol. Ves., 1(4), 134-138
- Haas W. (2003) Parasitic worms: strategies of host finding, recognition and invasion. Zoology. 106, 349-364
- Jourdane J., Kulo S. D. (1982) Perspective d’utilisation de Echinostoma togoensisdans le control biologique intestinale en Afrique. Ann. Parasitol. Hum. en Comp., 57(5), 443-451
- Kennedy C.R. (1975) Ecological Animal Parasitology. Oxford. London. Edinburgh & Melbourne: Blackwell Scientific Publications. 168 p
- Kregel K.C. (2002) Invited review: heat shock proteins: modifying factors in physiological stress responses and acquired thermotolerance. J. Appl. Physiol., 92(5), 2177-2186
- Levakin I.A. (2004) The influenct of the invasion by trematodes Bunocotyle progenetica (Hemiuridae) and Cryptocotyle cancavum (Heterophyidae) on mortality of marine of littoral mollusks Hydrobiaulvae (Gastropoda: Prosobranchia) when exposed to extreme high temperature. Parasitologia, 38(4), 352-358
- Roberts R.W., Agius C., Saliba C. Bossier P., Y. Y. Sung Y.Y. (2010) Heat shock proteins (chaperones) in fish and shellfish and their potential role in relation to fish health: a review. J. of Fish Diseases, 33(10), 789-801
- Russo J., Lagadic L. (2000) Effects of parasitism and pesticide exposure on characteristics and functions of hemocyte populations in the freshwater snail Lymnaea palustris (Gastropoda, Pulmonata). Cell. Biol. Toxicol., 16(1), 15-30
- Scriabine K.I. (1951) The genus Trichobilharzia. In: Trematodes of animals and humans. Moscow: Publisher Academy of Sciences of the USSR. Vol. 5. 377-387
- Sidorov A.V. (2003) Temperature effect on pulmonary respiration, defensive reactions and locomotoric behavior of freshwater snail Lymnaea stagnalis. Zh. VND., 55(4), 513-517
- Sousa W. P. (1983) Host life history and the effect of parasitic castration on growth: a field study of Cerithidea californica Haldeman (Gastropoda: Prosobranchia) and its trematode parasites. J. Exp. Mar. Biol. Ecol., 73, 273-296
- Sousa W. P., Gleason M. (1989) Does parasitic infection compromise host survival under extreme environmental conditions? The case Cerithidea californica (Gastropoda: Prosobranchia). Oecologa, 80, 456-464
- Stadnichenko A.P., Ivanenko L.D., Vitkovskaia O.V., Kalinina N.N. (1999) The influence of trematode invasion on the content of hemocyanin in the hemolymph of Lymnaea stagnalis (Gastropoda, Pulmonata, Lymnaeidae). Parasitologia, 33(2), 125-128
- Sung Y.Y. (2014) Heat shock proteins: An alternative to control disease in aquatic organism. Marine Science. Res. Dev., 4(1), 1-4
- State report (2014) The state and environmental protection of the Irkutsk region in 2013. Irkutsk: Institute of Geography V.B. Cochava. 389 p
- Verbitsky V.B. (2013) Experimental methods of determining optimal and pessimal temperature for hydrobionts. In: Biology of inland waters. Materials of XV School-conference of young scientists. Borok. 3-11
- Vernberg W.В.,Vernberg F.J. (1963) Influence of parasitism on thermal resistance of the mudflat snail Nassa obsoleta Say. Exp. Parasitol., 14(3), 330-332
- Wiederkehr M.A., Ignatkin D.S., Indiyakova T.A. (2009) Atlas of cercariae of the Middle Volga. Internet publication. Internet Resource: Available
- Zhukova T.V., Ostapenya A.P. (2007) The parasitic infestation of mollusks by schistosome cercariae in the coastal zone of the Naroch Lake. In: The problem of cercarial dermatitis in the Naroch region. Minsk: Medisont. 8-103


