Влияние ионизирующего излучения на активность антиоксидантных ферментов штамма Escherichia coli «ПЛ-6» при многократном облучении
Автор: Галлямова М.Ю., Вагин К.Н., Гайнутдинов Т.Р., Рахматуллина Г.И., Рыжкин С.А.
Рубрика: Научные статьи
Статья в выпуске: 1 т.33, 2024 года.
Бесплатный доступ
Данная статья посвящена анализу ферментативной активности микроорганизма Escherichia coli штамм «ПЛ-6» после многократного воздействия ионизирующего излучения (ИИ) в возрастающих дозах. Облучение культуры клеток микроорганизма проводилось на стационарной гамма-установке «Исследователь» (60Co) с суммарной мощностью 36,7 Гр/мин. Дозы, выбранные для работы: от 3,5 до 10 кГр с шагом 0,5 кГр и от 10 до 30 кГр с шагом 5 кГр. Контролем в опыте служила необлучённая клеточная суспензия исследуемого микроорганизма. Ферментативная активность определялась спектрофотометрическим методом на приборе «MultiSkan Go» (Thermo Fisher Scientific, Finland) после каждого облучения. В результате проведённого цикла облучений установлено, что пошаговое увеличение дозы ИИ поспособствовало повышению начальной радиоустойчивости выбранного штамма. Тем временем каждое облучение в более высокой дозе приводило к снижению количества жизнеспособных клеток: от 109 КОЕ/мл в контрольном образце культуры до 102 КОЕ/мл после облучения в дозе 30 кГр. Таким образом, проводя последовательное многократное облучение, постоянно увеличивая дозу ИИ, был произведён отбор самых радиоустойчивых клеток культуры. Изученные ферменты антиоксидантной системы проявляют повышенную удельную активность при облучении по сравнению с ферментами контрольного варианта. Активность ферментов увеличивается с повышением дозы облучения. Каталазная активность усиливается после многократных облучений в 5 раз и пероксидазная активность - в 4 раза. Для сравнения результатов в группах был применен t-критерий Стьюдента при p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Ионизирующее излучение, каталаза, пероксидаза, радиорезистентность, радиочувствительность клетки е. coli
Короткий адрес: https://sciup.org/170204364
IDR: 170204364 | УДК: 577.152.1:577.346 | DOI: 10.21870/0131-3878-2024-33-1-68-76
Текст научной статьи Влияние ионизирующего излучения на активность антиоксидантных ферментов штамма Escherichia coli «ПЛ-6» при многократном облучении
Действие ионизирующих излучений в живых клетках способствует радиолизу воды, при котором происходит образование активных форм кислорода [1-3]. Известно, что радиационное воздействие способно модифицировать деятельность антиоксидантных систем, приводя к изменению их активности [4-7]. Изучение вопроса изменчивости микроорганизмов, в частности, изменения ферментативной активности, актуально и необходимо для понимания механизма развития сверхустойчивости к воздействию ионизирующего излучения (ИИ) [8-13].
Авторами многих работ выявлено модифицирующее влияние на метаболизм различных типов излучения на микроорганизмы [14-16]. Доказано, что изменчивость тесно связана с факторами окружающей среды, но при этом отличительной чертой микроорганизмов являются пластичные свойства всех их составных частей и физиологических функций [17], что позволяет им быстро адаптироваться к меняющимся условиям окружающей среды [18].
Галлямова М.Ю. – мл. науч. сотр.; Вагин К.Н.* – вед. науч. сотр., зав. лаб., д.б.н., ФГАОУ ВО КФУ; Гайнутдинов Т.Р. – вед. науч. сотр., зав. сект. к.б.н., ФГАОУ ВО КФУ; Рахматуллина Г.И. – ст. науч. сотр., зав. сект., к.б.н.; Рыжкин С.А. – ст. науч. сотр., зав. каф., д.м.н., доцент, ФГБОУ ДПО РМАНПО Минздрава России, ФГБОУ ВО Казанский ГМУ Минздрава России, ФГАОУ ВО КФУ. ФГБНУ «ФЦТРБ-ВНИВИ».
Согласно литературным данным, одним из ключевых механизмов радиозащитного действия ферментов является инактивация свободных радикалов, возникающих в живых клетках при облучении. За осуществление инактивации свободных радикалов отвечает антиоксидантная система, представленная антиокислительными ферментами [19, 20]. За разрушение в живой клетке токсичного пероксида водорода отвечают ферменты каталаза и пероксидаза, поэтому указанные антирадикальные ферменты были выбраны в качестве объектов данного исследования. Облучение изменяет обменные процессы микроорганизмов, в частности, активность ферментов антиоксидантной защиты, соответственно, целью настоящей работы явилось определение активности ферментов каталазы и пероксидазы при радиационном воздействии в различных дозах на культуру клеток штамма Escherichia coli «ПЛ-6».
Материалы и методы
Эксперименты были проведены в лаборатории радиационного контроля и экологии ФГБНУ «ФЦТРБ-ВНИВИ» и на кафедре микробиологии КФУ. Объектом исследования был выбран производственный штамм Escherichia coli «ПЛ-6», предоставленный Государственной коллекцией штаммов возбудителей особо опасных инфекций, используемых в ветеринарии и животноводстве ФГБНУ «ФЦТРБ-ВНИВИ». Облучение культуры штамма осуществляли на стационарной гамма-установке «Исследователь» с источником излучения 60Co. Гамма-установка представляет собой свинцовый контейнер, установленный на станине, в центре контейнера расположен облучатель в виде кассеты с источниками излучения типа ГИК-7-2 на основе радионуклида 60Co с суммарной мощностью 0,612 Гр/с, распределение источников круговое, что обеспечивает получение поглощённой дозы объектом достаточно равномерно относительно центра, в который он помещается. Производилось систематическое воздействие ИИ на штамм, сохраняющий жизнеспособность после предыдущего облучения. Дозы, выбранные для работы: от 3,5 до 10 кГр с шагом 0,5 кГр и от 10 до 30 кГр с шагом 5 кГр. Контролем в опыте служила необлучённая клеточная суспензия Escherichia coli . Также определена инактивирующая доза ИИ для полученного ра-диоустойчивого варианта, равная 31 кГр.
Клеточная суспензия штамма с концентрацией 1 млрд м.к./см3 в объёме 5 мл, помещённая в пенициллиновые флаконы, подвергалась гамма-воздействию по 3 флакона на каждую дозу. После облучения производили посев культуры на питательные среды: мясопептонный агар и Эндо по 1 мл на чашку Петри (по 3 чашки). После каждого воздействия ИИ оценивался рост культуры на чашках Петри, из нескольких колоний готовили мазки с окраской по Граму. Посевы культивировали в термостате при температуре 37 °С, через 24 ч выросшие колонии культуры Escherichia coli смывали 0,85% стерильным раствором хлорида натрия, готовили суспензию в концентрации 1 млрд м.к./см3 по стандарту мутности бактерийных взвесей (Ормет, Россия). Культура после каждого облучения подвергалась 3 пассажам на плотной питательной среде. Клеточную суспензию в концентрации 1 млрд м.к./см3 после 3-го пассажа разливали в пенициллиновые флаконы, закупоривали резиновыми пробками, обкатывали алюминиевыми колпачками и вновь подвергали облучению в дозе, превышающей предыдущую.
Для получения экстрактов с целью последующего определения ферментативных активностей культуру клеток исследуемого микроорганизма центрифугировали при 3000 об/мин в течение 10 мин, дважды промывали смесью, содержащей 50 мМ калий-фосфатный буфер (pH 7,0) и 0,5 мМ ЭДТА. После промывки клетки ресуспендировали в том же буфере и обрабатывали ультразвуком
8 мин при 4 °С, используя ультразвуковой дезинтегратор УЗДН-2Т (рабочая частота 22 кГц) для разрушения клеток. Клеточные суспензии центрифугировали при 4000 g в течение 10 мин при 4 °С. Полученные, свободные от клеток, экстракты хранили на льду, определение активности ферментов производили в течение последующих нескольких часов. Анализ активности ферментов был произведён в трёх повторностях.
Определение каталазной активности проводили в суспензии интактных клеток. Диспропорционирование перекиси водорода каталазой фиксировали спектрофотометрическим методом при длине волны 240 нм на спектрофотометре MultiSkan Go (Thermo Fisher Scientific, Finland), применяя молярный коэффициент поглощения для H 2 O 2 39,4 М -1 хсм-1. Активность определяли в реакционной смеси объёмом 2 мл (50 мМ калий-фосфатный буфер (pH 7,0); 0,5 мМ ЭДТА; 10 мМ перекись водорода и 20 мкл клеточной суспензии), в пробу контроля H 2 O 2 не добавляли. За единицу активности каталазы принимали количество 1 мкмоль H 2 O 2 , превращённыхза 1 мин.
Определение пероксидазной активности производили, как и у предыдущего фермента, в свободном от клеток экстракте. Поглощение определяли при длине волны 436 нм в следующей реакционной смеси общим объёмом 2 мл: 50 мМ калий-фосфатного буфера (pH 7,0); 0,5 мМ ЭДТА; 0,4 мМ о-дианизидина; 10 мМ H 2 O 2 ; 0,3 мМ NaN 3 и 20 мкл клеточного экстракта. За единицу активности фермента принимали количество экстракта, которое приводило к изменению оптической плотности на 0,01 ед. за 1 мин при 436 нм.
Статистическую обработку полученных данных производили при помощи t-критерия Стьюдента при p<0,05.
Результаты и обсуждение
По результатам проведённой серии облучений выявлено, что повышение дозы ИИ привело к увеличению исходной радиорезистентности штамма, но в то же время каждое последующее облучение клеток, сохранивших жизнеспособность после предыдущего менее интенсивного воздействия, способствовало снижению количества жизнеспособных клеток (рис. 1).
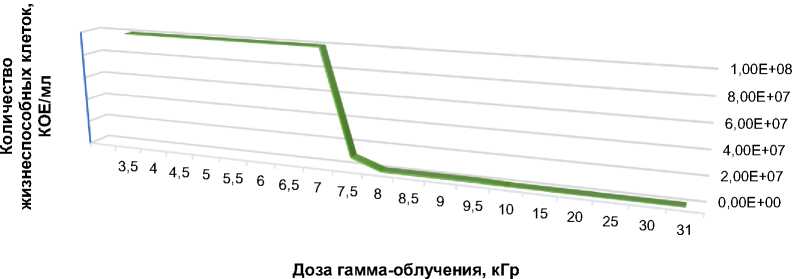
Рис. 1. Зависимость снижения количества жизнеспособных клеток Escherichia coli штамм «ПЛ-6» от величины поглощённой дозы.
Каталаза – фермент антиоксидантной системы клетки, участвующий в нейтрализации су-пероксид-аниона и пероксида водорода. Нами было выявлено, что с повышением дозы ИИ на культуру клеток Escherichia coli наблюдается увеличение каталазной активности, причём начиная с дозы 3,5 до 7 кГр с шагом 0,5 кГр между облучениями происходит плавное увеличение
(с дозы 4,5 кГр показания активности статистически значимы по отношению к показаниям контрольного образца), а при следующем облучении в дозе 7,5 кГр наблюдается резкий скачок в активности с разницей в 10 единиц, после чего снова наблюдается плавное возрастание активности. В результате каталазная активность интактного варианта составляет 9,8±0,33 единиц, в то время как активность при самой высокой дозе, применяемой в эксперименте, 30 кГр составляет 48,83±0,46 единиц, что примерно в 5 раз больше, чем у необлучённого варианта.
Пероксидаза представляет собой окислительно-восстановительный фермент класса оксидоредуктаз, использующий пероксид водорода в качестве акцептора электронов. Уровень пероксидазной активности повышается с увеличением дозы ИИ. Без облучения активность составила 0,43±0,03 единиц, начиная с первой дозы облучения 3,5 до 7 кГр наблюдается незначительное постепенное увеличение с 0,49±0,01 до 0,75±0,01 единиц (с дозы 4 кГр показания активности статистически значимы по отношению к показаниям контрольного образца). При воздействии дозы в 7,5 кГр зафиксировано повышение в 0,2 единицы от предыдущей дозы – 0,91±0,02. Дозы с 7,5 до 30 кГр, аналогично предыдущим дозам, стимулируют активность пероксидазы. В точке крайней дозы (30 кГр) наблюдается максимальный уровень фермента – 1,77±0,03 единицы. В ходе эксперимента активность пероксидазы возрастает примерно в 4 раза.
Выявленные изменения активности основных представителей клеточной антиоксидантной защиты (каталазы, пероксидазы) демонстрируют прямую зависимость содержания ферментов от дозы воздействия ИИ. Данные по исследованию активности ферментов антиоксидантной системы представлены в табл. 1.
Таблица 1
Исследование активности ферментов антиоксидантной системы Escherichia coli штамма «ПЛ-6» в зависимости от дозы гамма-облучения
|
Доза, кГр |
Каталаза, мкмоль H 2 O 2 /мг белка/мин |
Пероксидаза, мкмоль/мин |
|
0 |
9,8 ± 0,33 |
0,43 ± 0,03 |
|
3,5 |
10,0 ± 0,08 |
0,49 ± 0,01* |
|
4 |
10,7 ± 0,24* |
0,52 ± 0,01* |
|
4,5 |
11,2 ± 0,12* |
0,54 ± 0,01* |
|
5 |
13,0 ± 0,57* |
0,57 ± 0,005* |
|
5,5 |
13,73 ± 0,25* |
0,63 ± 0,02* |
|
6 |
14,0 ± 0,08* |
0,68 ± 0,03* |
|
6,5 |
14,63 ± 0,33* |
0,7 ± 0,005* |
|
7 |
15,23 ± 0,12* |
0,75 ± 0,01* |
|
7,5 |
25,23 ± 0,82* |
0,91 ± 0,02* |
|
8 |
26,97 ± 0,12* |
0,97 ± 0,01* |
|
8,5 |
30,57 ± 1,16* |
1,07 ± 0,04* |
|
9 |
34,83 ± 1,19* |
1,16 ± 0,04* |
|
9,5 |
36,87 ± 0,5* |
1,21 ± 0,01* |
|
10,0 |
37,53 ± 0,31* |
1,25 ± 0,01* |
|
15,0 |
39,17 ± 0,87* |
1,31 ± 0,01* |
|
20,0 |
41,9 ± 0,43* |
1,49 ± 0,02* |
|
25,0 |
45,2 ± 0,57* |
1,6 ± 0,01* |
|
30,0 |
48,83 ± 0,46* |
1,77 ± 0,03* |
Примечание: * – различия статистически значимы по сравнению с контрольными значениями; p<0,05, t-тест.
Схожая тенденция повышения активности ферментов каталазы и пероксидазы при облучении культуры клеток может быть связана с выполнением одинаковой функции в клетке – превращение токсичного пероксида водорода в кислород и воду.
Заключение
Подводя итоги проведённого эксперимента, можно заключить, что многократное воздействие гамма-излучения на культуру клеток Escherichia coli штамма «ПЛ-6» при увеличении дозы с каждым последующим облучением способствует усилению синтеза антиоксидантных ферментов: каталазная активность при выбранной схеме облучения возросла пятикратно, а пероксидазная четырёхкратно. Повышенный синтез антиокислительных ферментов можно использовать при конструировании радиозащитных профилактических и лечебных препаратов. Применение веществ микробного происхождения, как составных частей противолучевых препаратов, – перспективное направление радиационной биологии, в частности, ветеринарии, т.к. именно препараты природного происхождения обладают меньшей токсичностью, являются эффективными и безопасными.
Работа выполнена в рамках Программы стратегического академического лидерства КФУ (приоритет 2030).
Список литературы Влияние ионизирующего излучения на активность антиоксидантных ферментов штамма Escherichia coli «ПЛ-6» при многократном облучении
- Гудков С.В. Частные вопросы радиационной биофизики: учебное пособие. Нижний Новгород: Нижегородский государственный университет им. Н.И. Лобачевского, 2022. 235 с.
- Васин М.В. Противолучевые лекарственные средства. М., 2010. 180 с.
- Волкова П.Ю. Адаптивные реакции растений на действие ионизирующего излучения в низких дозах: дис. … докт. биол. наук. Обнинск, 2020. 390 с.
- Мартусевич А.К., Карузин К.А. Оксидативный стресс и его роль в формировании дизадаптации и патологии //Биорадикалы и антиоксиданты. 2015. Т. 2, № 2. С. 5-18.
- Джафаров Э.С., Годжаева Г.А., Джафарлы А.К., Оруджева Д.Р., Бабаев Г.Г. Изменение содержания отдельных элементов антиоксидантной системы зашиты Аlhagi pseudalhagi (Вieb.) в условиях хрониче-ского гамма-облучения //Вопросы радиационной безопасности. 2013. № 3. С. 12-24.
- Volkova P.Yu., Geras’kin S.A. Enzyme polymorphism of an antioxidant system in chronically irradiated scots pine populations //Russ. J. Genet Appl. Res. 2014. V. 4, N 5. P. 421-433.
- Гераськин С.А., Волкова П.Ю., Удалова А.А., Казакова Е.А., Васильев Д.В., Дикарева Н.С., Макаренко Е.С., Дуарте Г.Т., Кузьменков А.Г. Эффекты хронического облучения в популяциях рас-тений на примере референтного организма «сосна обыкновенная». Обзор //Радиация и риск. 2018. Т. 27, № 4. С. 95-118.
- Ягафарова Г.Г., Сафаров А.Х., Мигранова И.Г., Акчурина Л.Р., Микулик Д.И. Исследование устой-чивости нефтеокисляющих микроорганизмов к действию ионизирующего излучения //SOCAR Proceedings. 2022. № 1. С. 1-5.
- Галлямова М.Ю., Вагин К.Н., Низамов Р.Н., Юнусов И.Р., Габдрахманова Л.Я., Рахматуллина Г.И. Модификация синтеза антиоксидантных ферментов в процессе развития радиорезистентности у Escherichia coli //Современные проблемы радиобиологии, радиоэкологии и агроэкологии: сб. докладов IV Международной научно-практической конференции, 22-24 сентября 2021 г. Обнинск: ВНИИРАЭ, 2021. С. 27-29.
- Галлямова М.Ю. Снижение радиочувствительности Escherichia coli к -лучам //Молодежные разра-ботки и инновации в решении приоритетных задач АПК: сб. материалов международной научной кон-ференции студентов, аспирантов и учащейся молодежи, посвящённый 150-летию со дня рождения профессора Карла Генриховича Боля, 8 апреля 2021 г. Казань: КГАВМ, 2021. С. 196-198.
- Галлямова М.Ю., Вагин К.Н., Низамов Р.Н., Гайнутдинов Т.Р., Василевский Н.М., Идрисов А.М., Рахматуллина Г.И. Фенотипическая изменчивость Escherichia coli, индуцированная -лучами 60Co //Ве-теринарный врач. 2021. № 3. С. 19-23.
- Гайнутдинов Т.Р., Шашкаров В.П., Идрисов А.М., Курбангалеев Я.М., Спиридонов Г.Н., Гурьянова В.А. Определение устойчивости возбудителей колибактериоза к воздействию ионизирующий радиации //Ядерно-физические исследования и технологии в сельском хозяйстве (к 50-летию со дня образования ФГБНУ ВНИИ радиологии и агроэкологии): сб. докладов международной научно-практической конфе-ренции, 16-18 сентября 2020 г. Обнинск: ВНИИРАЭ, 2020. С. 46-49.
- Илюхина Н.В., Колоколова А.Ю., Прокопенко А.В., Филиппович В.П. Исследование эффективности облучения биологических объектов с применением пучка ускоренных электронов //Радиационные тех-нологии в сельском хозяйстве и пищевой промышленности: состояние и перспективы: сб. докладов международной научно-практической конференции, 26-28 сентября 2018 г. Обнинск: ВНИИРАЭ, 2018. С. 76-80.
- Taghipour F. Ultraviolet and ionizing radiation for microorganism inactivation //Water Res. 2004. V. 38, N 18. P. 3940-3948.
- Гордеева Т.Х., Гаврицкова Н.Н. Изменение численности и структуры комплекса целлюлозоразруша-ющих микроорганизмов под воздействием СВЧ-излучения //Вестник Поволжского государственного технологического университета. Серия: Лес. Экология. Природопользование. 2012. № 2 (16). С. 86-91.
- Воробьева Е.А., Белов А.А., Чепцов В.С., Соина В.С., Крючкова М.О., Караевская Е.С., Иванова А.Е. Устойчивость микроорганизмов экстремальных ксерофитных экотопов к воздействию инактивирующих факторов //Известия ТСХА. 2018. № 4. С. 111-127.
- Садыхова Ф.Э., Раджабов М.А. Изменчивость микроорганизмов и приобретенная резистентность //Биомедицина. 2018. № 1. С. 19-22.
- Luckey T.D. Hormesis with ionizing radiation. New York: CRC press, 2019. 222 p.
- Gallyamova M.Yu. Study of radioprotective properties of drugs based on Escherichia coli metabolites and substances of natural origin //Ветеринарный врач. 2021. № 2. С. 16-18.
- Vagin K.N., Gaynutdinov T.R., Nizamov R.N., Nizamov R.N., Ishmukhametov K.T., Gallyamova M.Yu., Vasilevsky N.M., Kurbangaleev Ya.M., Smolentsev S.Yu., Yunusov I.R., Rakhmatullina G.I., Kalimullin F.Kh., Gabdrakhmanova L.Ya. Obtaining and application of a radioprotective preparation of microbial origin //Linguistica Antverpiensia. 2021. V. 2021, N 2. P. 1156-1175.


