Влияние ионов Cd2+ на структурно-функциональные параметры галофита Suaeda salsa
Автор: Розенцвет Ольга Анатольевна, Нестеров Виктор Николаевич, Богданова Елена Сергеевна, Розенцвет Виктор Александрович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 5-2 т.20, 2018 года.
Бесплатный доступ
Исследовано влияние ионов Cd2+ и NaCI на структурные и функциональные параметры галофита Suaeda salsa. Установлено, что корни растений накапливали ионы металла в 38 раз больше, чем листья. Реакция пигментного фонда и липидов, ответственных за структуру мембран, на действия Cd2+ в лабораторных экспериментах была аналогична действию засоления почвы на растениях естественных условиях произрастания. Полученные данные позволяют заключить, что механизмы устойчивости к засолению и действию ионов Cd2+ у галофитов, во многом, реализуются за счет структурных перестроек мембранного аппарата и активации окислительных процессов.
Галофиты, засоление, кадмий, липиды, пигменты
Короткий адрес: https://sciup.org/148314069
IDR: 148314069 | УДК: 57:
Текст научной статьи Влияние ионов Cd2+ на структурно-функциональные параметры галофита Suaeda salsa
Галофиты являются экологически специализированными видами растений с высоким потенциалом биологической устойчивости к засолению. Несмотря на общее название, отражающее отношение к одному экологическому фактору, галофиты представляют крайне неоднородную группу растений, к которым относятся представители разных таксонов, жизненных форм, экологических типов, флор [1]. Принято разделять галофиты в зависимости от способности к накоплению/исключению солей на «соленакапливающие» – эугалофиты, «солевыделяющие» – криногалофиты, «соленепроницаемые» – гликогалофиты и псевдогалофиты. Устойчивость галофитов к NaCl связана с разнообразными физиологическими и молекулярными механизмами. К ним относятся: ограничение поступление ионов; выделение соли через железки; накопление соли в вакуолях; участие ферментов и низкомолекулярных соединений в противостоянии окислительному стрессу антиоксидантной защите [2-4]. Многие из этих механизмов обнаруживаются и у растений, проявляющих высокую устойчивость к ионам тяжелых металлов (ТМ) [5, 6].
В настоящее время существуют работы, свидетельствующие о способности галофитов накапливать большие концентрации тяжелых металлов (ТМ) [7]. Существует определенная аналогия в классификации галофитов по признаку накопления ТМ: аккумуляторы; индикаторы; исключате-ли. При этом о степени и характере накопления и распределению металлов по органам растений можно судить по индексу транслокации (отношение содержания металла в надземной части к его содержанию в корнях). Одни виды являются фитоэкстракторами (содержание ТМ больше в листьях), другие – фитостабилизаторами почвы (содержание ТМ больше в корнях). Это дает основание предполагать использование галофитов в технологиях фиторемедиации засоленных почв и загрязненных ТМ [8].
Одним из потенциальных кандидатов для этих целей являются растения Suaeda salsa сем. Chenopodiaceae. Это типичный эугалофит, произрастает на засоленных почвах при большом диапазоне минерализации почвенного раствора. В работах авторов [9, 10] приводятся данные, согласно которым растения S . salsa способны произрастать на почвах, содержащих не только значительные концентрации металлов, но и нефтепродукты. Побеги S. salsa могут содержать ионы Cu2+, Cr3+, Pb2+ и As2+ в концентрации 100, 40, 5 и 2 мг/г сухой массы. Показано также, что клетки корней накапливают ионы Cd2+ через неселективные Са2+-каналы, локализованные в мембранах клеток корней [11]. Результаты полевых исследований показали, что данный эугалофит прекрасно адаптируется к сильно загрязненной среде, коэффициент покрытия растениями составляет более 60%, что способствует постепенному восстановлению растительного покрова и загрязненных земель [4, 10].
Среди металлов Cd2+ относится к высокотоксичным элементам. Значение данного металла для растений до конца не установлено, но известно, что в небольших концентрациях ионы металла могут стимулировать рост растений [12]. Фитотоксичность проявляется в нарушении активности ферментов, торможении фотосинтеза, нарушении транспирации, а также ингибировании восстановления NО2 до NО. Ионы Cd2+ являются антагонистами ряда элементов питания (Zn, Cu, Mn, Ni, Se, Ca, Mg, P) [13].
Одним из общих проявлений токсического действия NaCl и ТМ является изменение свойств биомембран, вызванных нарушением баланса между генерацией и утилизацией активных форм кислорода, что становится причиной окисления липидов. В результате меняются барьерные и защитные функции мембран, их проницаемость, меняется водный баланс растений; изменяются фотосинтетические процессы [14]. Реакции фотосинтетического аппарата и состояние мембран – важных составляющих адаптационного потенциала на действие NaCl и ТМ, у растений галофитов остаются мало изученными.
Цель работы – провести сравнительный анализ влияния Cd2+ и NaCI на параметры фотосинтетического аппарата и структурные компоненты мембран S . salsa . В задачу исследования входило изучение пигментного фонда, интенсивности перекисного окисления липидов (ПОЛ) и состава липидов мембран.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования были листья растений S . salsa , выращенные в лабораторных условиях, и дикорастущих (Sw) растений, собранных в естественных условиях произрастания в приустьевых участках рек бассейна оз. Эльтон (Волгоградская обл.) в 2012-2015гг. Содержание соли (NaCI) в почве исследованного района составляло 5–30 г/л. Температура воздуха в период исследования варьировала в интервале +30 – +40оС, а интенсивность солнечной радиации в полдень достигала 2000 мкмоль/м2 с-1.
Постановка эксперимента . Семена S . salsa высевали в сосуды с песком, полив осуществляли питательным раствором Робинсона: (Ca(NO3)2 x 4H2O, KNO3, KH2PO4, MgSO4, H2BO4, FeSO4 x 7H2O, Na2, MnCI2 x 4H2O, ZnSO4 x 7H2O, CuSO4 x 7H2O, MoO4 x 2H2O). Растения выращивали при температуре 20–22оС при освещенности 1200 мкмоль/ м2 с-1. Одновозрастные растения разделяли на две группы: контрольные (SK) и опытные образцы (SCd). К опытным растениям в течение 10 дней добавляли раствор, содержащий Cd (NO3)2 до достижения конечной концентрации 200 мкМ/л.
Для каждого вида анализов отбирались листья, из усредненной массы составляли три независимых биологических пробы по 0,5–2 г сырой массы.
Количество ТМ в тканях галофитов определяли методом атомно-абсорбционной спектрометрии на спектрометре «МГА-915» (Россия) после мокрого озоления [15].
Содержание ионов Na+ определяли в сухом размолотом материале, после минерализации проб с применением метода оптической и эмиссионной спектроскопии с индуктивно связанной плазмой на приборе «SPECTRO CIROS-CCD» [16].
Экстракцию фотосинтетических пигментов проводили общепринятым методом с использованием охлажденного ацетона (90%). Определение концентрации проводили на спектрофотометре ПромЭкоЛаб ПЭ-3000 УФ (Россия) при длине волны λ = 662, 645 и 470 нм. Расчет концентрации хлорофиллов а , b (Хл а , b ) и каротиноидов (Кар) производили по методу [17].
Интенсивность перекисного окисления липидов (ПОЛ) в листьях растений оценивали по содержанию малонового диальдегида после реакции с тиобарбитуровой кислотой [14], определение проводили на спектрофотометре «Specol» (Германия) при длине волны 532 нм.
Липиды экстрагировали смесью хлороформа и метанола (1:2) с одновременным механическим разрушением тканей. Разделение липидов осуществляли методом тонкослойной хроматографии [18]. Количество фосфолипидов (ФЛ) определяли по содержанию неорганического фосфора, гликолипидов (ГЛ) и нейтральных липидов (НЛ) – денситометрическим методом, используя программу «Денскан-04» (Ленхром, Россия). Хроматограммы анализировали в режиме параболической аппроксимации по градировочным зависимостям, используя монога-лактозилдиацилглицерин (МГДГ) и холестерин в качестве стандартов [14].
Метанолиз жирных кислот (ЖК) осуществляли кипячением в 5% -ном растворе HCl в метаноле. Полученные эфиры анализировали на хроматографе «Хроматэк Кристалл 5000.1» (Россия) в изотермическом режиме с использованием капиллярной колонки длиной 105 м и диаметром 0.25 мм «RESTEK» (США). Температура колонки – 180оС, испарителя и детектора – 260оС, скорость тока газа-носителя (гелий) – 2 мл/мин.
Для оценки достоверности различий между разными видами использовали критерии Стьюдента при доверительном интервале P < 0.05. Значения в таблицах и рисунках представляют средние арифметические из трех биологических повторностей и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Оценка влияния NaCI на растения S. salsa в естественных условиях произрастания и ионов Cd2+ в условиях эксперимента не выявила каких-либо визуальных признаков, свидетельству- ющих о токсичности этих двух абиотических факторов. По данным атомно-абсорбционной спектрометрии установлено, что общее содержание Cd2+ в почвенном субстрате, на котором выращивали экспериментальные растения, составляло 0,020 мг/г сухой массы почвы. В корнях S. salsa содержалось 0,12 мг/г Cd2+, а в листьях – 0,0032 мг/г сухой массы, что в 38 раз ниже показаний, полученных для корней. Концентрация ионов Na+ в листьях составляла 150,0 мг/г сухой массы.
Данные о влиянии NaCI и ионов Cd2+ на оводненность тканей разных органов растений приведены на рисунке 1. Листья растений SK, SCd и Sw характеризовались высоким уровнем оводненности – 91,0–94,0% от сырой массы. В корневой части галофитов содержание воды было не только ниже в сравнении с листьями, но существенно различалась между контрольными образцами, растениями, обработанными Cd2+, и дикорастущими растениями. Так в растениях SK уровень оводнености соответствовал значению 82,1%. Внесение Cd2+ в почву приводило к снижению данного параметра в корнях растений SCd в 1,2 раза. Аналогичные результаты были получены и для корней растений Sw, содержание воды в них в 1,3 было ниже, по сравнению с галофитами SK.
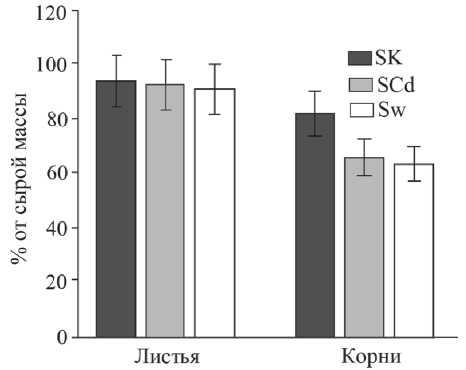
Рис. 1. Содержание воды в листьях и корнях
S. salsa. Обозначения : SК– контроль, SCd – растения, выращенные на среде с добавлением Cd2+, Sw –дикорастущие растения засоленных почв
Одним из основных параметров, характеризующих процесс фотосинтеза, является кон- центрация пигментов. В листьях исследованных растений сумма зеленых пигментов составляла 0,17–0,49 мг/г сырой массы (табл. 1). Наибольшее содержание Хл и Кар отмечено у растений, выращенных на среде, содержащей Cd2+. Галофиты, произраставшие в естественных условиях, характеризовались более низким содержанием фотосинтетических пигментов по сравнению с лабораторными растениями.
В листьях растений, выращенных на среде, содержащей ионы Cd2+, отмечали двукратное увеличение интенсивности ПОЛ по сравнению с контролем, что свидетельствует об окислительном стрессе, вызванном действием ионов металла (Рис. 2). Аналогичные данные были получены и для Sw растений.
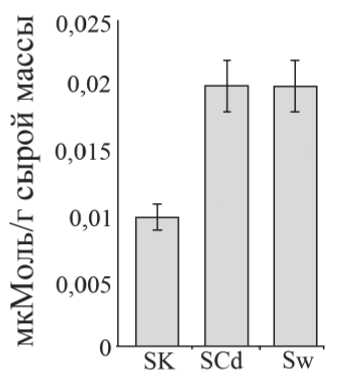
Рис. 2. Интенсивность перекисного окисления липидов в листьях S . salsa. Обозначения как на рис. 1
Суммарное содержание липидов в листьях исследованных растений составляло от 4,2 до 6,0 мг/г сырой массы. (Рис. 3 а). Для дикорастущих растений выявлено высокое содержание НЛ, за которыми следуют ГЛ и ФЛ, а в контрольных вариантах – ГЛ, затем НЛ и ФЛ. В присутствии Cd2+ увеличивалось содержание всех типов липидов (Рис. 3 а).
При этом наблюдали перестройки в составе основных компонентов, образующих мембраны тилакоидов. Так, в листьях SK растений они располагались в следующем порядке: МГДГ – 53,9%, дигалактозилдиацилглицерин (ДГДГ) –33,9% и сульфолипид (СХДГ) – 12,2% (Рис. 3 б). В растениях SCd и Sw содержание МГДГ существенно
Таблица 1. Содержание фотосинтетических пигментов в листьях S . salsa (мг/г сырой массы).
|
Параметры |
SK |
SCd |
Sw |
|
Хл а |
0,33±0,01 |
0,35±0,05 |
0,11±0,03 |
|
Хл b |
0,12±0,02 |
0,14±0,01 |
0,05±0,01 |
|
Кар |
0,09±0,01 |
0,10±0,01 |
0,04±0,01 |
Примечание: SК– контроль, SCd – растения выращенные на среде с добавлением Cd2+, Sw –дикорастущие растения засоленных почв.
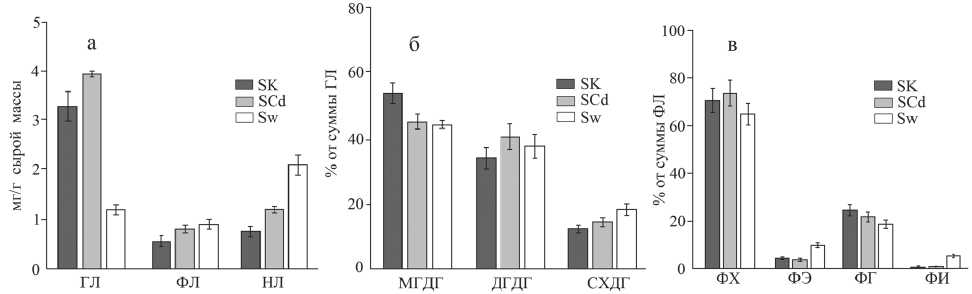
Рис. 3. Соотношение разных групп и содержание индивидуальных липидов листьев S . salsa. Обозначения как на рис. 1
снижалось, при этом увеличивалась доля ДГДГ и СХДГ. Подобные изменения в соотношении между МГДГ и ДГДГ рассматриваются, как ответная реакция на изменение факторов внешней среды.
Структурными компонентами плазмалем-мы и эндомембран являются ФЛ. Среди них основную часть составляет фосфатидилхолин (ФХ). За ним следуют фосфатидил- глицерол (ФГ), -этаноламин (ФЭ) и -инозит (ФИ). Сравнение данных по составу ФЛ показывает, что в листьях растений, выращенных на среде, содержащей ионы Cd2+, количество ФХ было выше, чем в контроле (Рис. 3 в). В листьях Sw растений содержание ФХ было самым низким. Однако у этих же растений содержание ФЭ и ФИ было в 2 раза выше, а количество ФГ в 1,3 раза ниже по сравнению с растениями SK и SCd.
Как известно, функции биологических мембран зависят от их текучести, которая определяется составом ЖК, входящих в молекулы липидов [19]. Количество насыщенных ЖК в листьях исследованных растений варьировало от 22,0 до 28,7% от суммы ЖК (Табл. 2). У всех растений основными насыщенными кислотами (НЖК) были пальмитиновая (16:0) и стеариновая (18:0) кислоты, их содержание составляло от 18,3 до 21,3% и от 1,8 до 2,8%, соответственно. Суммарное ко- личество ненасыщенных ЖК (ННЖК) было существенно выше и составляло от 69,5 до 78,0%. В исследованных растения главными ННЖК являются линолевая (18:2n6c) и линоленовая (18:3n3) кислоты. Внесение ионов Cd2+ в корнеобитаемую среду приводило к увеличению концентрации 18:3n3 в липидах листьев S. salsa. Результаты таблицы 2 показывают, что естественные условия в большей степени влияли на количественный и качественный состав ЖК. Это проявлялось в низком содержании 18:3n3 и образовании кислот с большей длиной углеводородной цепи (С 20:0).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Способность растений поглощать ионы Cd2+ во многом зависит от их видовых особенностей. Обычно большая часть металла задерживается корнями растений, и лишь небольшое количество может поступать в надземную часть [12]. Проведенные исследования показали, что выращивание растений в среде, содержащей ионы Cd2+, не обнаружило видимых симптомов токсичности, подобно растениям, произраставших в естественных условиях, что говорит об устойчивости S . salsa к действию данных абиотических факторов . Количество накопленного Na+ в надземной части растений, свидетельствует о
Таблица 2. Состав жирных кислот листьев S . salsa , % от суммы
|
Кислоты |
SK |
SCd |
Sw |
|
> С16 |
1,03±0,03 |
0,8±0,1 |
0,9±0,1 |
|
С16:0 |
20,3±2,0 |
18,3±1,3 |
21,3±1,3 |
|
С18:0 |
2,1±0,1 |
1,8±0,3 |
2,8±0,8 |
|
С16:1 |
2,1±0,3 |
1,8±0,3 |
2,2±0,2 |
|
C18:1n9c |
2,9±0,5 |
2,0±0,4 |
5,1±0,1 |
|
C18:2n6c |
14,0±1,4 |
15,2±1,2 |
17,4±0,4 |
|
C18:3n3 |
56,3±6,0 |
58,5±1,5 |
40,5± |
|
< С20 |
0,4±0,01 |
0,4±0,02 |
5,9±0,1 |
|
Е НЖК |
24,3±0,4 |
22,0±0,1 |
28,7±0,7 |
|
Е ННЖК |
75,3±0,5 |
78,0±0,8 |
69,5±0,5 |
Примечание: обозначения как в таблице 1.
высокой транслокационной способности растений в отношении соли. В свою очередь, многократно более низкая концентрация ионов Cd2+ в листьях растений SCd по сравнению с корнями говорит о том, что данный металл практически не транспортируется в надземные ткани, а накапливается в корнях. С позиций фиторемедиации растения S. salsa следует отнести к растениям аккумуляторам катионов Na+ и Cd2+, но по отношению к Cd2+ S. salsa является фитостабилизатором почвы, загрязненной ионами Cd2+, а по отношению к Na+ – фитоэкстрактором.
Устойчивость S. salsa к NaCI и Cd2+ обеспечивается разными механизмами. Прежде всего, это касается различий в ион-транспортных процессах – катионы Na+ и Cd2+ транспортируются различными семействами транспортных белков и разными ионными каналами [20-22].
Несмотря на различия, связанные с поглощением и дальнейшей транспортировкой ионов Na+ и Cd2+, выявлены одинаковые изменения водного статуса корневой системы S. salsa . В обоих случаях наблюдали снижение оводнености тканей и увеличение сухой массы растений, что может свидетельствовать о замедления роста корня, уменьшении числа корневых волосков, что влияет на всасывающую поверхность корней и, как следствие, на поступление воды и необходимых элементов питания.
Фотосинтез, как правило, отличается очень высокой чувствительностью к воздействию ТМ, которые влияют на многие стороны этого процесса – снижение скорости ассимиляции СО2, структурные и функциональные изменения в фотосинтетическом аппарате растений [12, 23]. Следует отметить, что ионы Cd2+, накапливаемые в корнях, не влияли на содержание пигментов в листьях в условиях эксперимента. Листья растений в естественных условиях отличались более низким количеством пигментов. Данное обстоятельство, по-видимому, связано с тем, что галофиты в естественных условиях кроме засоления испытывают действие высоких уровней инсоляции и температуры. Не исключено, что более низкий уровень пигментов является реакций растений, направленной на защиту фотосинтетического аппарата.
Недостаток влаги и элементов питания могли стать причиной окислительного стресса. Одной из первых реакций растений на стресс является индукция окислительных процессов, включая процессы ПОЛ. В нашем исследовании показано, что окислительный стресс был вызван как действием Cd2+, так и NaCI. Окислительный стресс тесно связан с повреждениями мембран. Действительно, в составе липидов и ЖК обнаружены существенные изменения, свидетельствующие о структурных перестройках, как в плазмалемме, так и эндомембранах. Поскольку
ГЛ являются структурными компонентами мембран тилакоидов, то выявленные изменения в содержании МГДГ и ДГДГ имеют компенсаторный характер, что позволяет сохранять физические свойства мембраны, плавно корректировать фазовые переходы и изгибы мембраны, при этом сохранять фотосинтетическую активность растений [24]. Структурные перестройки затрагивают и непластидные мембраны, особенно в растениях в естественных условиях. В частности для этих растений выявлены более существенные изменения в составе ФЛ по сравнению с растениями лабораторных экспериментов. Полученные данные согласуются с известными из литературных источников фактами. При сравнении разных видов растений, различающихся по степени солеустойчивости (устойчивые - Salicornia europaea и Atriplex gmelinii ; средне-устойчивые - Gossypium arboreem , Spinacia olearacea и Lycopersicum esculentum ; чувствительные - Cucumis sativus ), также были обнаружены существенные различия в составе мембранных липидов, особенно в корневых тканях. При этом мембраны солеустойчивых видов были более проницаемы для ионов, чем мембраны чувствительных растений. По мере возрастания гало-фильности снижалось отношение МГДГ/ДГДГ и содержание ФЛ, но увеличивалось соотношение ГЛ/ФЛ [25]. В совокупности с результатами нашей работы это доказывает участие мембран в ответе на действие NaCl и ионов металлов.
ВЫВОДЫ
Проведенными исследованиями показано, что растения S. salsa устойчивы не только к действию NaCI, но и к действию ТМ. Выявлены существенные различия в параметрах фотосинтетического аппарата и составе липидов у растений S. salsa , выращенных в лабораторных и естественных условиях произрастания. Реакция пигментного фонда и липидов, ответственных за структуру мембран, на действия ионов Cd2+ в лабораторных экспериментах была аналогична действию засоления почвы на растениях естественных условиях произрастания. Полученные данные позволяют заключить, что механизмы устойчивости к засолению и действию ионов ТМ у галофитов, во многом реализуются за счет структурных перестроек мембранного аппарата и активации окислительных процессов.
Список литературы Влияние ионов Cd2+ на структурно-функциональные параметры галофита Suaeda salsa
- Шамсутдинов З.Ш., Савченко И.В., Шамсутдинов Н.З. Галофиты России, их экологическая оценка и использование. Москва: Эдель-М, 2000. 399 с.
- Thapa G., Sadhukhan A., Panda S.K., Sahoo L. Molecular mechanistic model of plant heavy metal tolerance//BioMetals. 2012. Vol. 25. Pp. 489-505.
- Flowers T.J., Colmer T.D. Salinity tolerance in halophytes//New Phytologist. 2008. Vol. 179. Pp. 945-963.
- Manousaki E., Kalogerakis N. Halophytes-an emerging trend in phytoremediation//International Journal of Phytoremediation. 2011. Vol. 13. Pp. 959-969.
- Thomas J.C., Malick F.K., Endreszl C., Davies E.C., Murray K.S. Distinct responses to copper stress in the halophyte Mesembryanthemum crystallinum//Physiologia Plantarum. 1998.Vol. 102. Pp. 360-368.


