Влияние ионов Cu2+ и Pb2+ на состав липидов Elodea сanadensis Michx
Автор: Нестеров В.Н., Розенцвет О.А.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 2 т.10, 2008 года.
Бесплатный доступ
Исследовали качественный и количественный состав липидов в условиях аккумуляции и элиминации тяжелых металлов (ТМ) пресноводным сосудистым растением Elodea сanadensis Michx. Растения инкубировали в 100 мкМ растворах нитратных солей Cu+2, Pb+2 в течении 10 суток, затем выдерживали в течении 5 суток в среде, не содержащей ТМ. Максимальное накопление ТМ было связано с измене- нием состава общих, полярных, нейтральных липидов и жирных кислот (ЖК). Медь в наибольшей степени угнетала рост и липидный обмен, что проявлялось в снижении основных компонентов различ- ных классов липидов, увеличении насыщенности ЖК. Ионы Pb+2 положительно влияли на прирост биомассы, увеличивали содержание фосфолипидов и ненасыщенных ЖК. Обсуждается роль липидов в адаптации водных растений к используемым металлам, как в период инкубации, так и в постстрессо- вый период во время реабилитации растений (отсутствие металлов в среде инкубации).
Короткий адрес: https://sciup.org/148198126
IDR: 148198126 | УДК: 581.192;
Текст научной статьи Влияние ионов Cu2+ и Pb2+ на состав липидов Elodea сanadensis Michx
Стремительно нарастающая геохимическая деятельность человеческого общества приводит к нарушению природных круговоротов вещества. Техногенную миграцию элементов создают главным образом промышленное извлечение металлов из недр Земли и их освобождение при сжигании горючих ископаемых [1-3]. К числу веществ, которым уделяется повышенное внимание из – за их токсичности для многих организмов, относятся такие тяжелые металлы (ТМ)* как медь и свинец.
При изучении влияния ТМ на живые организмы особое место занимают процессы, происходящие в клетке - элементарной единице всего живого. Биологические мембраны благодаря свойству избирательной проницаемости являются первым «живым» барьером на пути токсикантов в клеточную среду [4]. Изучение модификации клеточных мембран в зависимости от концентрации и
Сокращения: ГЛ - гликолипиды; ДАГ - диглицериды; ДГДГ - дигалакто-зилдиацилглицерины; ДФГ - дифосфатил-глицерины; ЖК - жирные кислоты; МГДГ - моногалакто-зилдиацилглицерины; нейтральные липиды (НЛ); ОЛ - общие липиды; ОФ - общий фосфор СС - свободные стерины; СХДГ - сульфохиновозилдиацилглицерины; ТАГ - триглицериды; ТМ - тяжелые металлы; ФЛ - фосфолипиды; ФГ - фосфа-тидилглицерины; ФИ - фосфатидилинозиты; ФК - фосфатидная кислота; ФХ - фосфатидилхолины; ФЭ - фосфатидил-этаноламины; ЭС - эфиры стеринов.
химических свойств отдельных металлов помогает оценить степень устойчивости живых организмов к загрязнению окружающей среды. Растения, с этой точки зрения, являются подходящим объектом для исследования, потому что, в отличие от животных, не способны к активному перемещению и, следовательно, им крайне редко удается избежать воздействия неблагоприятных факторов среды.
Аккумуляция ТМ водными растениями представляет особый интерес, поскольку водные растения отличаются повышенной способностью к их накоплению [5-8]. Ведущим направлением в настоящее время является изучение липидного метаболизма растений [9-14]. Однако до сих пор остаются недостаточно изученными изменения в составе липидов, происходящие в условиях повышенных концентраций ТМ в воде у разных видов водных растений. Представляет интерес также исследование реакций липидов, как в присутствие высоких концентраций металлов, так и в условиях удаления ТМ из растений в восстановительный период.
В связи с вышеизложенным, целью работы стало изучение качественного и количественного состава общих липидов (ОЛ), фосфолипидов (ФЛ), гликолипидов (ГЛ) и нейт- ральных липидов (НЛ) у пресноводного растения Elodea сanadensis Michx. в условиях накопления ионов Cu2+и Pb2+, а также их удаления из растений в постстрессовый период.
Методика
Объектом исследования служило водное погруженное сосудистое растение Elodea сanadensis (элодея канадская) из сем. Hydrocharitaceae (водокрасовые). Данный вид широко распространен в водоемах России, неприхотлив к минеральному составу воды, отличается быстрым ростом, не требует обязательного укоренения, удобен для лабораторных исследований [15]. Это многолетнее растение с погруженными в воду длинными ветвистыми стеблями, на которых расположены мутовки с листьями, по 2?5, чаще по 3 листа в каждой. Растения выращивали в лабораторных условиях на 5% среде Хогланда-?Арнона.
Постановка эксперимента . Перед началом эксперимента побеги растений разрезали на фрагменты весом 3?4 г и помещали их в вегетационные сосуды объемом 1 л. В опытные варианты добавляли соли Cu(NO3)2, Pb(NO3)2 в концентрации 100 мкМ. Использованная концентрация нитратных солей металлов выбрана, исходя из ранее исследованных концентрационных и временных зависимостей влияния ТМ на липидный, белковый и пигментный метаболизм водных растений [16]. Растения инкубировали в условиях освещения ? 800 ± 200 лк при 10-часовом световом дне и температуре 24оС. В данных условиях растения выдерживали 1, 3 или 10 суток. По истечении заданного времени часть растений промывали в проточной воде и использовали для анализов, а другую помещали в чистую воду и выдерживали 5 суток (период «реабилитации»). Эта часть растений служила для анализа ТМ и липидов в постстрессовый период. Прирост биомассы определяли гравиметрически. Для анализа липидов использовали только побеги, в которых предварительно определяли количество ТМ.
Экстракцию липидов проводили по методу Блайя и Дайэра [17]. Количественное со- держание ОЛ определяли взвешиванием аликвот экстрактов, высушенных в вакууме до постоянного веса.
Разделение ФЛ проводили методом двумерной тонкослойной хроматографии (ТСХ) на стеклянных пластинках (6 х 6 см) с закрепленным слоем силикагеля с использованием систем растворителей: хлороформ : метанол : бензол : аммиак (130 : 60 : 20 : 12) – первое направление; хлороформ : метанол : бензол : ацетон : уксусная кислота (140 : 60 : 20 : 10 : 8) – второе направление. Проявляли ФЛ опрыскиванием пластинок 10% H2SO4 в метаноле с последующим нагреванием их при температуре 180оC в течение 15 мин. Количество ФЛ определяли по содержанию неорганического фосфора [18].
Разделение ГЛ проводили методом одномерной ТСХ на пластинках (10 х 10 см) с закрепленным слоем силикагеля с использованием системы растворителей: ацетон : бензол : вода (91 : 30 : 8). Проявляли ГЛ опрыскиванием пластинок 5% 12MoO3 х H3PO4 в метаноле и последующим нагреванием их при температуре 150оC в течение 10 мин.
Разделение НЛ проводилось методом одномерной двукратной ТСХ на стеклянных пластинках (10см х 10см) с использованием систем растворителей: толуол : гексан : муравьиная кислота (объемное соотношение 140:60:1), гексан : диэтиловый эфир : муравьиная кислота (объемное соотношение 60:40:1). Проявляли НЛ аналогично ФЛ.
Количество НЛ и ГЛ определяли денситометрически.
Для анализа ЖК использовали их метиловые эфиры, которые получали путем кипячения в 5% HCl в метаноле [19]. Полученные эфиры очищали препаративной ТСХ и анализировали на газо-жидкостном хроматографе “Хроматэк Кристалл 5000.1” (Россия) с использованием капиллярной колонки длиной 105 м и диаметром 0.25 мм “RESTEK” (США). Температура колонки ? 180оС, испарителя и детектора ? 260оС. Скорость тока газа-носителя (гелий) ? 20 мл/мин.
Содержание ТМ в тканях растений определяли на атомно-абсорбционном спектрофотометре МГА-915 (Россия) после мокрого озоления [20].
Данные обрабатывали статистически. Определения проводили в трех биологических повторностях с 3 аналитическими по- вторностями. Значения в таблицах и рисунках, представляют средние арифметические из всех опытов и их стандартные ошибки.
Таблица 1. Динамика накопления Cu2+и Pb2+ в клетках Elodea canadensis в зависимости от длительности воздействия, мг/г сухой массы
|
Время экспозиции, сутки |
Инкубирование |
Реабилитация (5 суток) |
||
|
Cu 2+ |
Pb 2+ |
Cu 2+ |
Pb 2+ |
|
|
1 |
3.9 (3.9) ± 0,6 |
3,0 (3.0) ± 0,4 |
3,0 ± 0,3 |
2,0 ± 0,2 |
|
3 |
6,7 (2.2)± 1,2 |
1,9 (0.6) ± 0,0 |
5,3 ± 1,3 |
1,3 ± 0,4 |
|
10 |
8,5 (0.8) ± 1,5 |
1,5 (0.1) ± 0,5 |
6,3 ± 0,9 |
1,2 ± 0,3 |
Примечание: В скобках указана скорость накопления металла, (мг/г сухой массы в сутки).
Таблица 2. Изменение биомассы Elodea canadensis под влиянием Cu2+и Pb2+ в период инкубирования и реабилитации (время реабилитации 5 суток)
|
Металл |
Время экспозиции, сутки |
Биомасса, г |
Эффект влияния, % |
Биомасса, г |
Эффект влияния, % |
||
|
начало инкубирования |
конец инкубирования |
начало реабилитации |
конец реабилитации |
||||
|
Контроль |
0 |
3,85 ± 0,05 |
4,65 ± 0,02 |
+ 20,8 |
4,00 ± 0,05 |
4,38 ± 0,04 |
+ 9,5 |
|
Cu2+ |
1 |
3,98 ± 0,01 |
3,88 ± 0,08 |
-- 2,5 |
2,15 ± 0,15 |
2,17 ± 0,07 |
+ 0,9 |
|
3 |
4,02 ± 0,07 |
3,82 ± 0,15 |
-- 5,0 |
1,85 ± 0,05 |
1,85 ± 0,05 |
0,0 |
|
|
10 |
3,95 ± 0,05 |
3,73 ± 0,01 |
-- 5,6 |
2,02 ± 0,1 |
2,00 ± 0,10 |
-- 1,0 |
|
|
Pb2+ |
1 |
4,04 ± 0,06 |
4,05 ± 0,06 |
+ 0,2 |
1,99 ± 0,06 |
2,03 ± 0,13 |
+ 2,0 |
|
3 |
3,87 ± 0,03 |
3,98 ± 0,03 |
+ 2,8 |
2,03 ± 0,02 |
2,21 ± 0,06 |
+ 8,9 |
|
|
10 |
4,07 ± 0,02 |
4,22 ± 0,04 |
+ 3,7 |
2,08 ± 0,03 |
2,30 ± 0,12 |
+ 10,6 |
|
Примечание: (—) - уменьшение прироста, (+) – увеличение прироста биомассы, эффект влияния оценивался в % от начального веса.
Результаты
Согласно проведенному атомно-абсорбционному анализу пребывание E. сanadensis в среде, содержащей ионы Cu2+и Pb2+, приводило к накоплению этих металлов в тканях растения. Аккумуляция Cu2+ составила 3,9-8,5 мг/г сухого веса и достигала максимума через 10 суток инкубирования. Скорость поглощения этого металла снижалась с увеличением времени инкубирования (на 3-и сутки -уменьшалась в 1,8 раза по сравнению с первыми сутками, а на 10-е сутки - в 4,6 раза) (табл.1).
В отличие от Cu2+, максимальное накопление Pb2+ зафиксировано в первые сутки инкубирования. В дальнейшем поглощения Pb2+ не только не происходило, но, часть металла по-видимому, элиминировалась, поскольку уровень накопления через 3 и 10 суток был ниже, чем в первые сутки. Как видно, ионы Cu2+ накапливались при инкубации в большей степени, чем ионы Pb2+. Перенесение растений в чистую воду (период реабилитации) приводило к тому, что содержание Cu2+ уменьшалось в растениях, и количество оставшегося металла составляло от 20,9 до 25,9 % от поглощенных металлов. Содержание Pb2+ уменьшалось на 0,3 - 1,0 мг на г сухой массы, что составляло 20,0 - 33,4 % от поглощенных металлов в соответствующее время инкубирования. Следовательно, удаление ионов Cu2+ и Pb2+из тканей растений в период реабилитации в процентном отношении был практически одинаковым для обоих элементов.
Экспозиция растений в среде, содержащей
Cu2+, приводила к снижению интенсивности роста. Так, если в отсутствии солей ТМ в течение всего времени инкубирования E. сanadensis наращивала биомассу, в среднем, на 20,8±1,5% (табл. 2), то в присутствии Cu2+ происходила потеря биомассы на 2,5-5,6%. Максимальное накопление Pb2+, отмеченное в первые сутки, замедляло накопление биомассы в сравнение с контролем, но не исключало его полностью. При более длительной экспозиции прирост биомассы несколько увеличивался и составил 2,8-3,7 %.
После 5 суток выдерживания растений в чистой воде выявлялось неоднородное последействие элементов (табл. 2). В период реабилитации от воздействия Cu2+ в течение 1 суток был отмечен небольшой прирост (0,9%) биомассы. Более длительное воздействие так же негативно сказывалось и в восстановительный период. Последействие Pb2+ проявилось в увеличении биомассы на 2,0-10,6 %.
Таким образом, ТМ снижали интенсивность образования органического вещества E. сanadensis , и это было связано как с динамикой аккумулирования, так и со свойствами элемента.
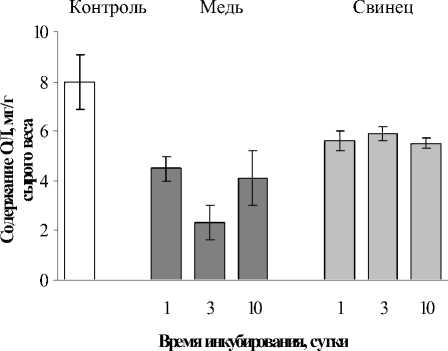
Отличия Cu2+ по действию и последействию, по сравнению с Pb2+, прослеживалось и при анализе липидной компоненты E. сanadensis . Результаты анализа общих липидов показаны на рис. 1. В контрольных образцах, в отсутствии ТМ, содержание ОЛ составляло в среднем 8,0 мг/г сырой массы растений в течение контролируемых 10 суток. В присутствии металлов в первые сутки содержание ОЛ уменьшалось: с Cu2+ – в 1,8 со Pb2+ - в 1,4 раза. В последующие - 3 и 10 суток содержание липидов уменьшалось в случае с Cu2+ - в 1,9-3,5 раза (максимально на 3-и сутки), в случае с Pb2+ - в 1,3-1,4 (рис. 1 А).
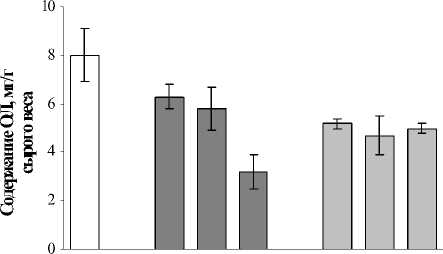
В период реабилитации, в сравнении с инкубационным периодом воздействия меди, наблюдалось восстановление содержания ОЛ в 1,4-2,5 раза после 1 и 3 суточного воздействия. Последствия 10 суточного воздействия Cu2+ проявились в продолжающемся угнетении накопления ОЛ. В случае со свинцом значительных изменений в содержании ОЛ не происходило и оставалось практически на уровне, характерном для периода инкубирования (рис. 1 Б).
Суммарные липиды, экстрагируемые изна 20,8±1,5% (табл. 2), то в присутствии Cu 2+ происходила потеря биомассы на 2,5-5,6%. Максимальное накопление Pb2+, отмеченное в первые сутки, замедляло накопление биомассы в сравнение с контролем, но не исключало его полностью. При более длительной экспозиции прирост биомассы несколько увеличивался и составил 2,8-3,7%.
После 5 суток выдерживания растений в чистой воде выявлялось неоднородное последействие элементов (табл. 2). В период реабилитации от воздействия Cu2+ в течение 1 суток был отмечен небольшой прирост (0,9 %) биомассы. Более длительное воздействие так же негативно сказывалось и в восстановительный период. Последействие Pb2+ проявилось в увеличении биомассы на 2,0-10,6 %.
Таким образом, ТМ снижали интенсивность образования органического вещества E. сanadensis , и это было связано как с динамикой аккумулирования, так и со свойствами элемента.
Отличия Cu2+ по действию и последействию, по сравнению с Pb2+, прослеживалось и при анализе липидной компоненты E. сanadensis . Результаты анализа общих липидов показаны на рис. 1. В контрольных образцах, в отсутствии ТМ, содержание ОЛ составляло в среднем 8,0 мг/г сырой массы растений в течение контролируемых 10 суток. В присутствии металлов в первые сутки содержание ОЛ уменьшалось: с Cu2+ – в 1,8 со Pb2+ - в 1,4 раза. В последующие - 3 и 10 суток содержание липидов уменьшалось в случае с Cu2+ - в 1,9-3,5 раза (максимально на 3-и сутки), в случае с Pb2+ - в 1,3-1,4 (рис. 1 А).
В период реабилитации, в сравнении с инкубационным периодом воздействия меди, наблюдалось восстановление содержания ОЛ в 1,4-2,5 раза после 1 и 3 суточного воздействия. Последствия 10 суточного воздействия Cu2+ проявились в продолжающемся угнетении накопления ОЛ. В случае со свинцом значительных изменений в содержании ОЛ
А
Б
1 3 10
1 3 10
Время инкубирования, сутки
Рис. 1. Влияние Cu2+и Pb2+ на содержание общих липидов Elodea сanadensis в период инкубирования (А) и реабилитации (Б)
не происходило и оставалось практически на уровне, характерном для периода инкубирования (рис. 1 Б).
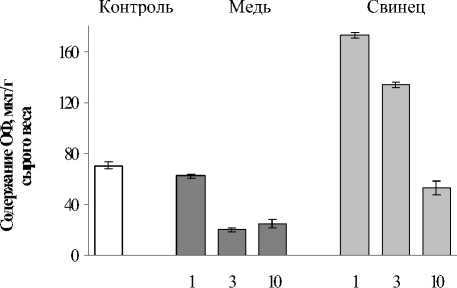
Суммарные липиды, экстрагируемые из растений по используемой нами методике, содержат мембранные ФЛ, ГЛ и запасные НЛ. Количество фосфорсодержащих липидов оценивали по содержанию общего неорганического фосфора (ОФ). Установлено, что в контрольных образцах E. сanadensis содержалось в среднем 70,3 мкг ОФ на г сырой массы растений (рис. 2). Ионы Cu2+ уменьшали содержание ОФ на 11,8-71.6 % в течение 10 суток воздействия. Кратковременное воздействие Pb2+ (1 и 3 суток) приводило к увеличению ОФ на 145,2% и 90,6% соответственно. При олее длительном влиянии Pb2+ (10 суток) одержание ОФ снижалось как в сравнении контролем (на 25%), так и в сравнении с ратковременным воздействием.
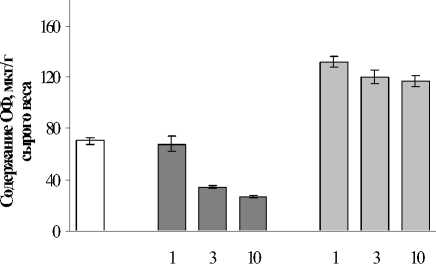
В постстрессовый период после 1 суточ-ого воздействия Cu2+наблюдалось восста-овление количества ОФ практически до зна-ений контроля. После 3 суток воздействия оличество ОФ увеличилось в 1,7 раза отно-ительно данного показателя в период инку-ации. Реабилитация после более длитель-ого воздействия не приводила к изменени-м в содержании ОФ.
У растений, инкубированных в среде с Pb2+ в течении 1 и 3 суток, после перемещения в чистую среду происходило снижение уровня ОФ на 23,4% и 10,5% соответственно, но все еще оставалось неестественно высоким. Последействие 10 суточного инкубирования данным металлом приводило к увеличению содержание ОФ на 122,0% по отношению к инкубационному периоду и на 66,4 % по отношению к контролю.
Среди ФЛ у исследуемого вида растения были индентифицированы следующие компоненты: ФХ, ФЭ, ФГ, ФИ, ДФГ и ФК. Данные рис. 3 демонстрируют, что поведение индивидуальных ФЛ как в период инкубации (А), так и в восстановительный период (Б) было крайне неоднородным. В присутствии Cu2+ наблюдалось снижение основных структурных компонентов - ФХ, ФЭ в сравнении с контролем, которое происходило на фоне увеличения содержания ФИ, ФГ, ДФГ и ФК. Воздействие Pb2+ напротив приводило к достоверному увеличению количества ФХ и уменьшению содержания ФИ. Уровень ФЭ оставался практически на уровне контроля. Незначительное падение количества ФГ было выявлено на 10 сутки воздействия Pb2+, в остальное время оставалось равным значению в контрольных экспериментах. Содержание ФК и ДФГ варьировало в зависимости от продолжительности воздействия.
растений по используемой нами методике, содержат мембранные ФЛ, ГЛ и запасные НЛ. Количество фосфорсодержащих липидов оценивали по содержанию общего неорганического фосфора (ОФ). Установлено, что в контрольных образцах E. сanadensis содержалось в среднем 70,3 мкг ОФ на г сырой массы растений (рис. 2). Ионы Cu2+уменьша-ли содержание ОФ на 11,8-71.6 % в течение 10 суток воздействия. Кратковременное воздействие Pb2+ (1 и 3 суток) приводило к увеличению ОФ на 145,2% и 90,6% соответственно. При более длительном влиянии Pb2+ (10 суток) содержание ОФ снижалось как в сравнении с контролем (на 25 %), так и в сравнении с кратковременным воздействием.
В постстрессовый период после 1 суточного воздействия Cu2+наблюдалось восстановление количества ОФ практически до значений контроля. После 3 суток воздействия количество ОФ увеличилось в 1,7 раза отно-
А
Время инкубирования, сутки
Б
Время инкубирования, сутки
Рис. 2. Влияние Cu2+и Pb2+ на содержание общего фосфора (ОФ) Elodea сanadensis в период инкубирования (А) и реабилитации (Б)
сительно данного показателя в период инкубации. Реабилитация после более длительного воздействия не приводила к изменениям в содержании ОФ.
У растений, инкубированных в среде с Pb2+ в течении 1 и 3 суток, после перемещения в чистую среду происходило снижение уровня ОФ на 23,4% и 10,5 % соответственно, но все еще оставалось неестественно высоким. Последействие 10 суточного инкубирования данным металлом приводило к увеличению содержание ОФ на 122,0% по отношению к инкубационному периоду и на 66,4% по отношению к контролю.
Среди ФЛ у исследуемого вида растения были индентифицированы следующие компоненты: ФХ, ФЭ, ФГ, ФИ, ДФГ и ФК. Данные рис. 3 демонстрируют, что поведение индивидуальных ФЛ как в период инкубации к и в восстановительный период (Б) было крайне неоднородным. В присутствии Cu2+ наблюдалось снижение основных структурных компонентов - ФХ, ФЭ в сравнении с контролем, которое происходило на фоне увеличения содержания ФИ, ФГ, ДФГ и ФК. Воздействие Pb2+напротив приводило к достоверному увеличению количества ФХ и уменьшению содержания ФИ. Уровень ФЭ оставался практически на уровне контроля. Незначительное падение количества ФГ было выявлено на 10 сутки воздействия Pb2+, в остальное время оставалось равным значению в контрольных экспериментах. Содержание ФК и ДФГ варьировало в зависимости от продолжительности воздействия.
Состав ФЛ в постстрессовый период под влиянием Cu2+ имел следующий характер: содержание ФХ возрастало на 16,9% только после самого наименьшего по продолжительности воздействия, но, тем не менее, оставалось ниже значений контрольных экспериментов. В остальных случаях происходило снижение уровня ФХ относительно инкубационного периода на 4,5-9,1 % . Количество ФЭ увеличилось до уровня контроля после 3 и 10 суток инкубации. Содержание ФГ имело тенденцию к восстановлению, а ФИ - к уменьшению. Наибольшие изменения претерпевало содержание ФК, которое возрас-
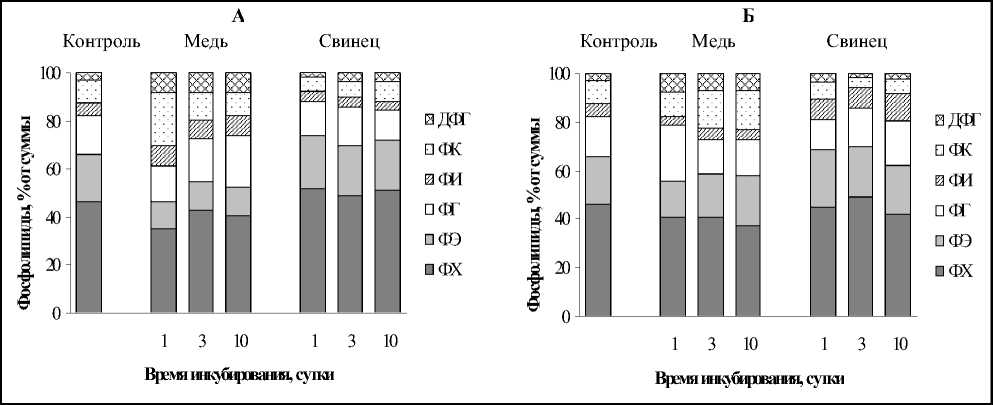
Рис. 3. Влияние Cu2+и Pb2+ на содержание фосфолипидов Elodea сanadensis в период инкубирования (А) и реабилитации (Б)
тало на 41,8-65,6 % по отношению к периоду инкубации.
Последействие Pb2+ проявлялось в снижении ФХ по отношению к периоду инкубации до 16,8 %, содержание ФЭ практически не менялось, уровень ФГ варьировал. Значительно возрастало количество ФИ (на 127,0211,4 %) по отношению к значениям, характерным для инкубационного периода. Количество ФК уменьшалось на 28,6-70,0 %.
Таким образом, изменение состава ФЛ, характеризующих состояние внепластидных мембран, имело разную направленность и зависело от времени воздействия и химических свойств элемента.
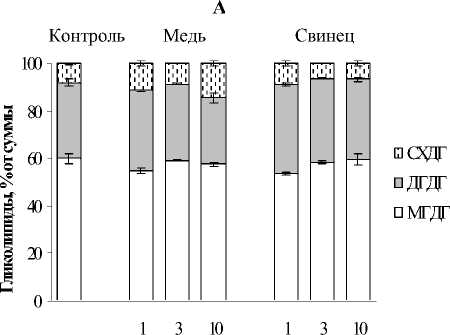
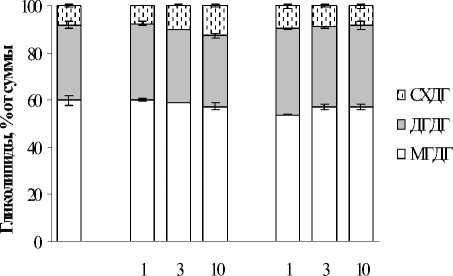
ГЛ - основные структурные компоненты мембран хлоропластов, которые обычно включают моно- (МГДГ) и дигалактозилдиа-цилглицерины (ДГДГ) и сульфолипиды суль-фохиновозилдиацилглицерины (СХДГ). Одной из характерных реакций на действие стрессора является увеличение относительного ДГДГ на фоне снижения МГДГ. Соотношение МГДГ/ДГДГ во многом определяет организацию мембранных структур хлоропласта и, как следствие, интенсивность и продуктивность фотосинтеза [21]. Несмотря на весьма выраженное негативное действие Cu2+ на физиологические и биохимические параметры исследуемого вида водного растения, существенных изменений в содержании ГЛ нами зафиксировано не было (рис. 4). При непосредственном действии данно- го ТМ на растение, содержание МГДГ и ДГДГ
Время инкубирования, сутки
Б
Время инкубирования, сутки
Рис. 4. Влияние Cu2+и Pb2+ на содержание гликолипидов Elodea сanadensis в период инкубирования (А) и реабилитации (Б)
оставалось практически на уровне контроля (рис. 4 А). Однако количество СХДГ увеличивалось на 10,0-77,5%. Высокий уровень сульфолипида оставался и в период реабилитации. Ионы Pb2+ меняли процентное соотношение МГДГ, ДГДГ и СХДГ только в первые сутки воздействия, когда накопление металла было максимальным. Данные перестройки ГЛ сохранились и в период реабилитации. В остальных случаях уровень ГЛ оставался равен контрольному.
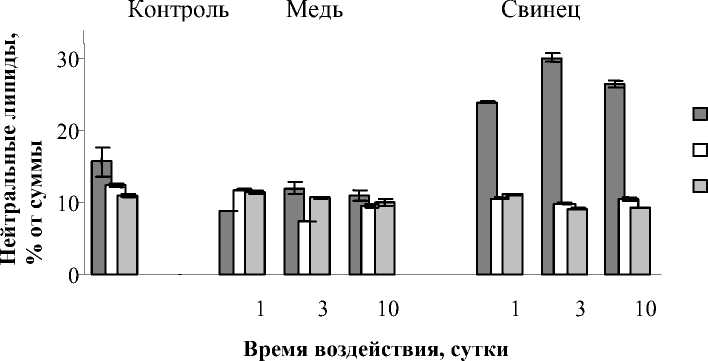
НЛ растений, как правило, содержат такие компоненты как ди- (ДАГ) и триацилг-лицерины (ТАГ), свободные стерины (СС)
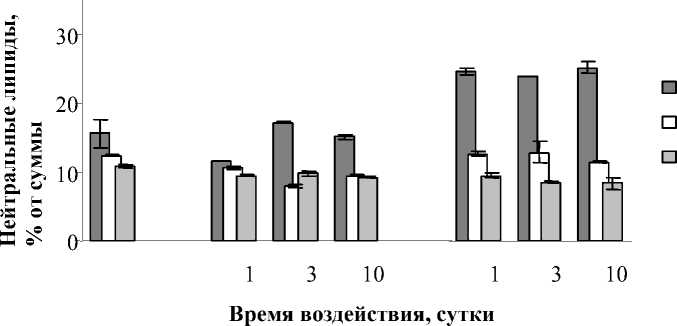
и их эфиры (ЭС), свободные жирные кислоты (СЖК). На рис. 5 показаны результаты по некоторым составляющим данного класса липидов. При влиянии Cu2+ снижалось количество СС на 16,9-36,3 % и ЭС на 11,2-18,5%. Содержание ТАГ не подверглось существенным изменениям. При 10 суточным инкубировании Pb2+ наблюдалось снижение уровня СС на 8,8%, при менее продолжительных воздействиях данным ТМ количество СС соответствовало контрольному. Содержание ЭС однозначно уменьшалось на 14,7-29,8 %, а количество ТАГ увеличивалось и весьма значительно – на 53,2-61,5 %.
Б
ТАГ
СС
ЭС
А
ТАГ
СС
ЭС
Рис. 5. Влияние Cu2+и Pb2+ на содержание нейтральных липидов Elodea сanadensis в период инкубирования (А) и реабилитации (Б)
В период реабилитации у растений, обработанных Cu2+, уровень свободных СС и ЭС практически не изменился. Содержание ТАГ снизилось на 30,0-77,3 % относительно контрольных экспериментов. Последействие Pb2+ выражалось в снижении количества СС до 26,5% и увеличении ЭС до 16,8%. Содержание ТАГ увеличивалось на 4,7-25,9 % (после 3 и 10 суточного инкубирования).
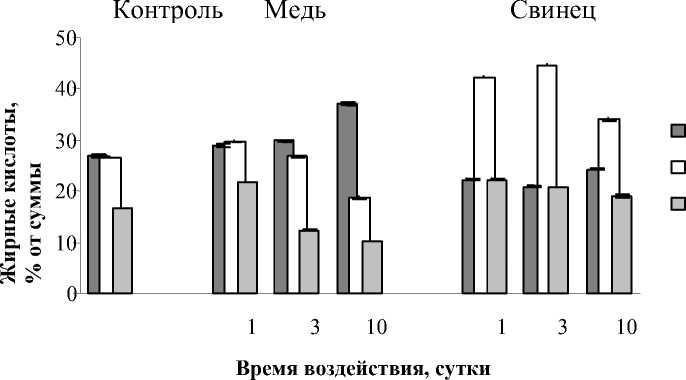
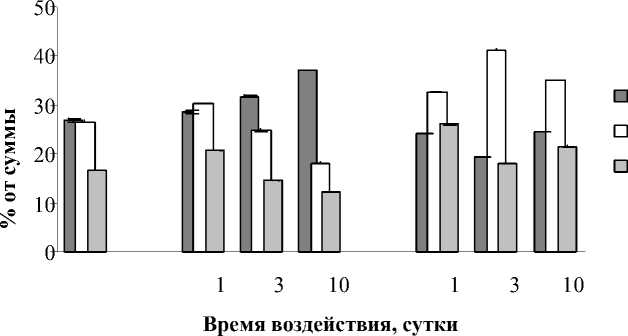
Показателем модификации биологических мембран служит изменение состава ЖК липидов. Как правило, ЖК листьев высших наземных растений включают С16–С18 кислоты [22]. Из данных рис. 6 видно, что воздействие Cu2+ и Pb2+ приводило к различной направленности изменения состава ЖК в периоды накопления и элиминации ТМ. Так, при 3 и 10 суточном влиянии Cu2+ происходило снижение ненасыщенности ЖК за счет снижения уровня кислот С18:2 на 35,5-64,7% и С18:3 на 43,5%. Вместе с тем, 1 суточное влияние данным ТМ приводило к увеличению количества С18:2 и С18:3 кислот на 30,3 и 11,2% соответственно. Количество С16:0 при всех сроках инкубации возрастало на 7,137,5% по отношению к контролю. Совершенно иной характер модификации состава ЖК наблюдался под влиянием Pb2+. Содержание С18:2 и С18:3 возрастало на 13,7-32,1 и 27,367,4% соответственно на протяжении всего
А
16:0
18:3
18:2
Б s в s ч и
§
16:0
18:3
18:2
Рис. 6. Влияние Cu2+и Pb2+на содержание главных жирных кислот Elodea сanadensis в период инкубирования (А) и реабилитации (Б)
времени инкубации. Количество же ненасыщенной кислоты С16:0 не увеличивалось, как в случае с Cu2+, а уменьшалось на 9,7-22,3%.
В восстановительный период после воздействия Cu2+состав ЖК остался практически неизменным за исключением кислоты С18:2 содержание которой возрастало на 17,721,6% после 3 и 10 суточной инкубации. Характер содержания ЖК во время реабилитации от воздействия Pb2+ не менялся относительно инкубационного периода, и содержание ненасыщенных С18:2и С18:3 кислот было выше, а С16:0– ниже, контрольных значений.
Обсуждение
В нашем исследовании показано, что E. сanadensis способна аккумулировать в своих тканях высокие концентрации ТМ в среднем от 1,5 до 8,5 мг/ г сухой массы. Очевидно, такую высокую степень накопления данных элементов можно объяснить отсутствием таких мощных физиологических барьеров, характерных для наземных растений, как корень в системе почва - растение, жесткие клеточные стенки и восковой налета в системе рас- тение – воздушная среда [4, 23]. Вместе с тем, при перенесении растений в среду, не содержащую ТМ, часть накопленного металла удаляется из тканей. Были выявлены следующие закономерности: со временем накопление ТМ замедляется и, чем большее количество металлов было накоплено растением, тем интенсивнее шел процесс их удаления в период реабилитации, а более низкие концентрации ТМ в тканях растения практически не элиминировались.
На фоне накопления ионов ТМ происходило торможение роста биомассы под влиянием ионов Pb 2+ и ее потери под влиянием ионов Cu2+. Замедление интенсивности рос та и его угнетение тесно взаимосвязаны с процессами, происходящими на клеточном, молекулярном уровне, о чем свидетельствует снижение содержания как общих, так и индивидуальных липидов и ЖК. Наиболее характерные изменения в составе исследуемых компонентов липидов E. сanadensis в периоды инкубации ТМ и реабилитации можно представить следующей схемой:
Инкубация
Реабилитация
ОЛ^ ОФ^ ФХ^ ФЭ^ ФИ^ ФК'ТА
МГДГ^ ДГДГ^ СХДГ^ СС ▼ ЭС ▼ ТАГ •
С 16:0 ^ С 18:2^ С 18:3^
ОЛ ▼ ОФ^ ФХ^ ФИ^ ФК ▼
МГДГ^ ДГДГ^ СХДГТА
СС • ЭС ▼ ТАГ ▲
С 16:0 ▼ С 18:2 ^ С 18:3 ^
ОЛ^ ОФ^ ФХ^ ФЭТА ФИ^ ФКА МГДГ^ДГДГ^СХДГА СС ▼ЭС ▼ ТАГ ▼
ОЛ^ ОФ^ ФХТА ФИ^ ФК^ МГДГ^ДГДГ^СХДГТ ▲ СС ▼ ЭС ▲ ТАГ^
С 16:0 ^ С 18:2 ^ С 18:3 ^
Примечание:
Знак « ▼» - указывает на снижение содержания компонента Знак « ▲» - указывает на увеличение содержания компонента Знак « ▼ ▲» - указывает на вариации в содержании компонента Знак « •» - указывает на неизменность содержания компонента (вся динамика приведена относительно контрольных опытов)
Из этой схемы видно, что ионы Cu2+ уменьшали количество ОЛ, ОФ и основных структурных компонентов биологических мембран ФХ, ФЭ, что может говорить о высокой степени повреждений, вызванных данным ТМ. При этом негативное действие ионов Cu2+ продолжалось и в период реабилитации, о чем свидетельствует повышенное содержание свободной ФК и продолжающееся угнетение количества ФХ. Что касается ионов Pb2+, то, вероятно, здесь имел место защитный механизм с участием липидной компоненты биологических мембран, о чем свидетельствует увеличение содержание ОФ и синтеза ФХ. Следует подчеркнуть, что в процессе реабилитации в составе исследуемых компонентов липидов, наблюдалась тенденция к восстановлению исходного, присущего контролю состояния.
Интересно отметить, что уровень ФГ – основного представителя ФЛ в мембранах хлоропластов, оставался практически постоянным, а уровень МГДГ и ДГДГ – главных составляющих всех липидов мембран тилакоидов, вообще не менялся (за исключением варианта с максимальной аккумуляцией ионов Pb2+). Данные факты позволяют предположить, что несмотря на высокий токсический эффект ТМ, такие жизненно важные структуры растительной клетки, как хлоропласты, могут характеризоваться значительной устойчивостью. Следуя этой логике, вероятным фактором нарушения фотосинтетической активности хлоропластов является не прямое действие ТМ на эти органеллы, а опосредованное – связанное с нарушением основных метаболических процессов клетки. На это
Список литературы Влияние ионов Cu2+ и Pb2+ на состав липидов Elodea сanadensis Michx
- Бондарев Л.Г. Ландшафты, металлы и человек. М.: Мысль, 1976.
- Добродеев О.П. Техногенез -мощная геохимическая сила биосферы//Природа, 1978. № 11.
- Башкин В.Н., Касимов Н.С. Биогеохимия. М.: Научный мир, 2004.
- Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам. Институт биологии КарНЦ РАН. Петрозаводск: Карельский научный центр РАН, 2007.
- Mendoza-Cozalt D., Devars S., Loza-Tavera H., Moreno-Sanchez R. Cadmium accumulation in the chloroplast of Euglena gracilis//Physiol. Plantarum. 2002. V. 115.
- Jones A.L., Harwood J.L. Comparative aspects of lipid metabolism in marine algae//Biochem. Soc. Trans. 1987. V. 15.
- Jones G.J., Nichols P.D., Johns R.B., Smith D. The effect of mercury and cadmium on the fatty acid and sterol composition of the marine diatom Asterionella glacialis//Phytochemistry. 1993. V. 26.
- Гавриленко Е.Е., Золотухина Е.Ю. Накопление и взаимодействие ионов меди, цинка, марганца, кадмия, никеля и свинца при их поглощении водными макрофитами//гидробиологический журнал. 1989. Т.25. № 5.
- Guschina I.A. and Harwood J.L. Lipid metabolism in the moss Rhytidiadelphus squarrosus (Hedw.) Warnst. From lead-contaminated and non contaminated populations//Journal of Experimental Botany. 2002. Vol. 53. № 368.
- Rama Deli S., Prasad M.N.V. Membrane lipid alteration in heavy metal exposedplants//Prassad M.N.V., Hagemeyer J. (eds.). Heavy metal stress in plants. From molecules to ecosystems.Berlin: Springer, 1999.
- Maksymiec W., Russa R., Urbanic-Sypnievska T., Baszinski T. Changes in acyl lipid and fatty acid composition in thylakoids of copper non-tolerant spinach exposed to excess copper//Journal of Plant Physiology. 1992. 140.
- Nouairi I., Ben Ammar W., Ben Youssef N., Ben Miled Daoud D., Habib Ghorbal M., Zarrouk M. Comparative study of cadmium effects on membrane lipid composition of Brassica Juncea and Brassica napus leaves//Plant Science. 2006. 170.
- Розенцвет О.А. Изучение особенностей аккумуляции ионов тяжелых металлов водными растениями и роли липидов в адаптации к тяжелым металлам//Изв. Самар. НЦ РАН. 2006. Т.8, № 3.
- Лукаткин А.С. Башмаков Д.И., Кипайкина Н.В. Протекторная роль обработки тидиозуроном проростков огурца при действии тяжелых металлов и охлаждения//Физиология растений. 2003. Т. 50, № 3.
- Полонский А.С. Мир аквариума. Калининградское книжное издательство. 1994.
- Розенцвет О.А., Мурзаева С.В., Гущина И.А. Роль мембранных липидов в устойчивости Potamogeton perfoliatus L. к избытку кадмия в воде//Изв. РАН. Сер. биол. 2004. № 6.
- Bligh E.G., Dyer W.J. A rapid method of lipid extraction and purification//Can. J. Biochem. Physiol. 1959. V. 37.
- Vaskovsky V.E., Latyshev N.A. Modified Jungnickel s reagent for detecting phospholipids and other phosphorus compounds on thin-layer chromatograms//J. Chromatogr. 1975. V. 115.
- Кейтс М. Техника липидологии. М.: Мир, 1975.
- Голубкина Н.А. Флуорометрический метод определения селена//Журн. аналит. химии. 1995. Т. 50.
- Marechal E., Block M.A., Dorne A.J. et al. Lipid synthesis and metabolism in the plastid envelope//Physiol. Plant. 1997.Vol.100. № 1.
- Harwood J.L. The Lipid Handbook//Eds Gunstone F.D., Harwood J.L., Padley F.B. London: Chapman & Hall, 1994. P. 200-204
- Рейвн. П, Эверт Р., Айкхорн С. Современная ботаника: В 2-х т. Т.1: Пер. с англ. -М.: Мир, 1990.


