Влияние ионов кадмия на индукцию ядерных аномалий в эритроцитах карпов
Автор: Крюков В.И.
Журнал: Биология в сельском хозяйстве @biology-in-agriculture
Рубрика: Общие и частные вопросы генетики
Статья в выпуске: 1 (22), 2019 года.
Бесплатный доступ
Изучали частоту возникновения микроядер и других аномалий ядра в эритроцитах карпов после 24-часового воздействия ионов кадмия в концентрации 0 (контроль), 0,0005, 0,001, 0,002, 0,004, 0,005 и 0,008 мг/л. Частоты эритроцитов с микроядрами (в %) составили 0,47 (в контроле), 0,50, 0,51, 0,51, 0,55, 0,63, 0,54, соответственно. Статистически достоверные различия с контрольной величиной установлены при воздействии концентрации 0,005 мг/л (0,63%). Суммарные частоты ядерных аномалий в эритроцитах (микроядра, пузырящиеся, лопастные, зазубренные ядра, двуядерные и амитотически делящиеся клетки) составили 0,75% (в контроле) и 0,80, 0,82, 0,90, 1,02, 1,19, 0,89% в опытных вариантах, соответственно. Статистически достоверные различия от контрольной величины установлены при воздействии концентраций 0,004 и 0,005 мг/л (1,02 и 1,19%), соответственно. Рассмотрены возможные механизмы указанной динамики частот аномалий.
Рыба, кадмий, мутагенность, микроядра, ядерные аномалии
Короткий адрес: https://sciup.org/147230984
IDR: 147230984
Текст научной статьи Влияние ионов кадмия на индукцию ядерных аномалий в эритроцитах карпов
Введение. Последнее 25 лет характеризуются в природоохранной биологии повышенным вниманием к проблемам, связанным с загрязнением водных экосистем тяжёлыми металлами. Реки и озера стали подвергаться сильному загрязнению тяжёлыми металлами из-за поступления в них всё возрастающих объёмов промышленных, сельскохозяйственных и бытовых стоков. В некоторых регионах из-за загрязнения воды резко снижается численность популяций гидробионтов, сокращается их биоразнообразие. Но даже при низких концентрациях некоторые тяжёлые металлы (в их числе и кадмий) способны накапливаться в организмах, проявляя специфическую локализацию в определённых органах.
Если токсические эффекты солей тяжёлых металлов изучают на протяжении двух столетий, то история исследований генетических механизмов воздействия солей тяжёлых металлов на организмы вчетверо короче. Современные исследования мутагенности тяжёлых металлов ведутся на молекулярногенетическом уровне и с каждым годом появляется всё больше сведений о их роли в нарушении самой структуры ДНК, влиянии на репарационные процессы и активацию (и инактивацию) определённых генов. Вместе с тем остаются не исследованными генетические последствия воздействия тяжёлых металлов на наследственность многих таксономических групп животных, не изучены отдалённые генетические по-
The frequency of micronuclei and other nucleus abnormalities in carp erythrocytes after 24 hours of cadmium ions exposure at a concentration of 0 (control), 0.0005, 0.001, 0.002, 0.004, 0.005, and 0.008 mg/l has been studied. The frequencies of erythrocytes with micronuclei were equal to 0.47 (in control), 0.50, 0.51, 0.51, 0.55, 0.63, 0.54%, respectively. The cadmium ions exposure with the concentration of Cd+2 0.005 mg/l caused a statistically significant increase in the frequency of micronuclei (0.63%) in comparison with the control. The total frequencies of all nuclear anomalies in erythrocytes (i.e. micronuclei, blebbed, lobed, notched nuclei, binucle-ar and amitotically dividing cells) were equal to 0.75% (in control) and 0.80, 0.82, 0.90, 1.02, 1.19, 0.89% in the experimental variants, respectively. When fish exposed to cadmium ions concentration of 0.004 and 0.005 mg/l the statistically significant differences of the total frequencies of the anomalies from the control value were established
следствия хронического воздействия повышенных концентраций тяжёлых металлов в окружающей среде. В последнее десятилетием у многих тяжёлых металлов (хром, никель, свинец, медь, ртуть, кадмий, органические соединения олова) обнаружены эпиму-тагенные свойства, т.е. способность воздействовать на эпигеном путём изменений метилирования ДНК и модификации гистоновых белков, влияющие на структуру хроматина и микроРНК. По указанным причинам анализ генетических и эпигенетических эффектов острого и хронического воздействий тяжёлых металлов на живые организмы является очень актуальным [12].
Одним из тяжёлых металлов, загрязняющих окружающую среду, является кадмий. Высокая токсичность кадмия изучена достаточно подробно, но его мутагенные свойства исследованы ещё недостаточно. К настоящему времени опубликован ряд работ, ставящих целью анализ генетических эффектов кадмия, но этих сведений явно недостаточно. По этой причине необходимо дальнейшее изучение мутагенности различных соединений кадмия для организмов разного эволюционного уровня.
В данной статье представлены результаты анализа влияния суточного воздействия ионов кадмия в концентрациях от 0,0005 до 0,008 мг/л на индукцию микроядер и других ядерных аномалий у годовиков карпа.
Материалы и методы исследования
Материалом для исследования служили годовалые карпы (Cyprinus carpio), массой 17-24 г., приобретённые в рыбхозе Орловской области. В лаборатории рыб для их адаптации помещали по 50 экз. в 150литровые аквариумы, заполненные чистой, отстоянной в течение 2 суток водопроводной водой. Воду в аквариумах принудительно аэрировали и фильтровали. Температуру на уровне 22°С и световой режим (10 часов освещения люминесцентными лампами и 14 часов темноты) поддерживали автоматически. Во время адаптации и после выполнения экспериментального воздействия рыб кормили 1 раз в сутки коммерческим комбикормом для карповых рыб. После адаптационного периода, продолжительностью не менее 3 суток, рыбу использовали для проведения экспериментов, после выполнения которых готовили мазки крови для исследования частот микроядер в эритроцитах подопытных животных.
Рыб подвергали 24 часовому воздействию ионов кадмия различной концентрации. Для исследования использовали соль – кадмий азотнокислый 4-водный (Cd(NO 3 ) 2 ×4H 2 O) квалификации «химически чистый». Расчёт концентраций соли выполняли по действующему веществу – Cd+2. В качестве отправной точки была принята ПДК кадмия в питьевой воде – 1 мкг/л (=0,001 мг/л). Весь ряд исследованных концентраций показан в таблице 1:
Таблица 1 – Исследованные концентрации ионов кадмия Cd+2
|
Номер варианта опыта |
0 (К)* |
1 |
2 |
3 |
4 |
5 |
6 |
|
Концентрация Cd+2 в ПДК |
0 |
0,5 |
1 |
2 |
4 |
5 |
8 |
|
Концентрация Cd+2 в мг/л |
0 |
0,0005 |
0,001 |
0,002 |
0,004 |
0,005 |
0,008 |
* – К* – контроль, интактные животные.
Для анализа мутагенности кадмия использовали 25-литровые пластмассовые аквариумы, заполненные растворами нитрата кадмия исследуемых концентраций. Рыб выдерживали в экспериментальных растворах соли кадмия в течение 24 часов. Затем пересаживали в аквариумы с чистой водой, где рыбу содержали следующие 24 часа (для реализации индуцированных аномалий). По истечении указанного времени готовили мазки крови. Действие каждой концентрации проводили в двух независимых повторностях (в двух разных экспериментальных ёмкостях).
Кровь для мазков отбирали из хвостовой вены рыб с помощью одноразового шприца с небольшим количеством (≈0,1 мл) гепарина в физиологическом растворе. Каплю взятой крови выдавливали из шприца на чистое предметное стекло и делали мазок в соответствии с рекомендациями [6]. Мазок высушивали на воздухе в течение 18-36 часов, фиксировали 25-30 минут в 96%-ном этаноле и окрашивали 5%-ным раствором азур-эозина (по Романовскому) на фосфатном буфере при температуре 37 °С. Интенсивность окраски периодически контролировали визуально при малом увеличении микроскопа. При достижении оптимальной интенсивности окраски клеточных ядер краситель сливали, препараты промывали струёй водопроводной воды, затем ополаскивали тремя сменами дистиллированной воды и высушивали. Препараты просматривали под микроскопом марки "AxioImager A1" (Karl Zeiss) с цифровой цветной фотокамерой "ProgRes CFscan" в составе комплекса аппаратнопрограммной визуализации морфологических препаратов для анализа и регистрации показателей «ВидеоТесТ-Морфология» (Санкт-Петербург, «ВидеоТесТ»).
Микроскопический анализ клеток выполняли в соответствии со следующими принципами. Для анализа выбирали такие участки мазка, на которых эритроциты располагались без наложения друг на друга. Микроядрами считали хроматиновые образования, удовлетворяющие следующим условиям: 1) размер микроядра не должен превышать 1/5 размера ядра этого эритроцита; 2) микроядра должны быть четко отделены от основного ядра; 3) микроядро должно находиться в той же плоскости, что и основное ядро, и его оптическая плотность не должна существенно отличаться от оптической плотности основного ядер-ного материала.
Микроядра, размер которых приближался бы к 1/5 размера ядра, практически не встречались. Обычно размер обнаруживаемых микроядер не превышал 1/10 размера клеточного ядра.
Помимо микроядер при анализе фиксировали клетки с нарушенной морфологией ядер. Среди аномалий клеточных ядер выделяли следующие [9, 21]:
– пузырящиеся (blebbed) ядра (BL), имеющие одно или, чаще, несколько небольших выпячиваний ядерной оболочки, содержащих хроматин.
– лопастные (lobed) ядра (LB) с выпячиваниями большого размера, которые в свою очередь могли нести одно или несколько выпячиваний («лепестков») меньшего размера.
– зазубренные (notched) ядра (NT), у которых ядерная оболочка имела остроконечную «вмятину»,
– двуядерные клетки (binuclei) (BN), имеющие два ядра, приблизительно равных размеров и интенсивности окрашивания, находящиеся в пределах цитоплазмы одной клетки, расположенной обособленно от других эритроцитов.
– ядра в стадии амитотического деления (АМ), морфология которых четко указывала на протекающий процесс амитотического деления. Такие ядра обычно имеют гантелеобразную форму.
В каждой из двух повторностей эксперимента анализировали по 3 случайно отборанных рыбы из 4 подвергшихся воздействию исследуемого фактора. В мазке крови каждой рыбы просматривали не менее 3000 эритроцитов. Таким образом, частоту аномалий в каждом варианте опыта рассчитывали после анализа не менее 18000 клеток.
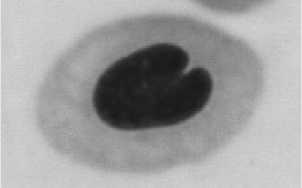
а бв
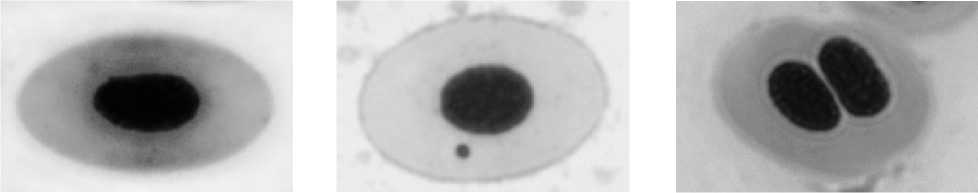
г д е
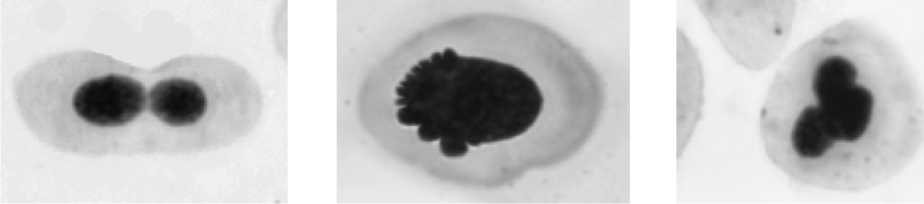
Рис. Эритроциты карпов с различными аномалиями ядер: а – нормальное ядро; б – микроядро; в – двуядерный эритроцит; г – амитоз; д – blebbed (пузырящееся) ядро; е – lobed (лопастное) ядро; ж – notched (зазубренное) ядро.
ж
Статистическую значимость различий в частотах нарушений между контролем и различными вариантами опыта определяли после φ-преобразования частот аномалий [8, с. 166-169]. Все расчёты были реализованы с использованием электронных таблиц MS Excel.
Результаты и обсуждение
Подробное описание мелких хроматиновых телец, обнаруживаемых в эритроцитах крови, было сделано американским физиологом W.Н. Howell [20] и французским гистологом J.М.J Jolly [22]. Поэтому гематологи называют их тельцами Жолли или тельцами Хауэлла-Жолли [30]. В генетике эти образования называют микроядрми. Цитогенетический механизм их образования в клетках подробно рассмотрен в ряде источников [например, 4, 26.]. Стимулом для использования микроядер в исследованиях мутагенеза стала публикация [29]. Изначально микроядерный тест был разработан для изучения мутагенных факторов на млекопитающих. У рыб формирование различных морфологических аномалий ядра в эритроцитах впервые было описано Карраско с сотрудниками [15]. В настоящее время этот тест с успехом используется для генетического тестирования мутагенных факторов с использованием самых различных животных: рыб [10, 13], амфибий [24], пресмыкающихся [2], птиц [5], млекопитающих и человека [7, 11]. Интерес к методу микроядерного тестирования не ослабевает, и в научной периодике систематически появляются обзоры, освещающие новые методические варианты этого анализа [4, 19].
Результаты микроскопического анализа мазков крови карпов после 24-часового воздействия на них различных концентраций кадмия приведены в таблице 2. Результаты статистического анализа этих данных представлены в таблице 3.
Частота эритроцитов с микроядрами у карпов при повышении концентрации кадмия от 0 до 0,005 мг/л воды постепенно возрастала от 0,47 до 0,63%, но при ещё большем повышении концентрации (до 0,008 мг/л) снижалась до 0,54%. Частота микроядер у рыб, подвергнутых в течение 24 часов воздействию кадмия в концентрации 0,005 мг/л (0,63%), статистически значимо отличалась от контрольной частоты микроядер. При возрастании концентрации до 0,008 мг/л частота микроядер снижалась, и различия в частотах вновь становились статистически не значимыми. Одной из возможных причин этого снижения частот нарушений может быть сильная интоксикация рыб и ингибирование важнейших биохимических процессов, обусловливающих деление клеток.
В этой работе приведены усреднённые частоты микроядер в каждой из проанализированных выборок, состоящих из 6 рыб, у каждой из которых анализировали около 3000 эритроцитов. При проведении микроскопического анализа мы обнаружили интересную особенность, состоящую в том, что частота формирования микроядер в эритроцитах рыб, составляющих одну экспериментальную выборку (и, следовательно, подвергнутых действию ионов кадмия одинаковой концентрации) имели существенно различные часто- ты микроядер. Обнаруженный факт позволил нам предположить, что генотип отдельных рыб может сильно влиять на частоту возникновения или интенсивность репарации мутаций, индуцируемых у них ионами кадмия. Позже, уже при подготовке данной статьи, мы обнаружили публикацию об исследования полиморфизма чувствительности цитогенетического аппарата лимфоцитов крови у людей [3], с результатами которой наше предположение полностью согласуется.
Таблица 2 – Сводная таблица результатов микроскопического анализа эритроцитов карпов после их суточного пребывания в воде, содержащей кадмий в различных концентрациях
|
Концентрация Cd+2, мг/л |
Всего изучено клеток |
В том числе клеток |
||||||
|
нормальных |
с микроядрами |
двуядерных |
в стадии амитоза |
пузырящиеся (blebbed) |
лопастные (lobed) |
зазубренные (notched) |
||
|
Контроль |
19813 |
19664 |
94 |
16 |
12 |
1 |
4 |
22 |
|
0,0005 |
18915 |
18763 |
95 |
13 |
10 |
4 |
9 |
21 |
|
0,001 |
19336 |
19178 |
98 |
11 |
17 |
5 |
3 |
24 |
|
0,002 |
18487 |
18321 |
95 |
18 |
17 |
5 |
11 |
20 |
|
0,004 |
19137 |
18941 |
105 |
24 |
20 |
4 |
6 |
37 |
|
0,005 |
18981 |
18756 |
119 |
22 |
24 |
6 |
12 |
42 |
|
0,008 |
19045 |
18875 |
103 |
14 |
19 |
6 |
12 |
16 |
Таблица 3 – Частоты аномалий ядер (%) в эритроцитах карпов после суточного воздействия ионов кадмия в различных концентрациях
|
Концентрация Cd+2, мг/л |
Всего изучено клеток |
Всего аномальных клеток |
В числе аномальных клеток |
|||||
|
с микроядрами |
двуядерных |
в стадии амитоза |
пузырящиеся (blebbed) |
лопастные (lobed) |
зазубренные (notched) |
|||
|
Контроль |
19813 |
0,75±0,02 |
0,47±0,10 |
0,08±0,01 |
0,06±0,01 |
0,005±0,001 |
0,02±0,02 |
0,11±0,05 |
|
0,0005 |
18915 |
0,80±0,02 |
0,50±0,10 |
0,07±0,01 |
0,05±0,01 |
0,021±0,002 |
0,05±0,03 |
0,11±0,05 |
|
0,001 |
19336 |
0,82±0,02 |
0,51±0,10 |
0,06±0,01 |
0,09±0,01 |
0,026±0,002 |
0,02±0,02 |
0,12±0,05 |
|
0,002 |
18487 |
0,90±0,02 |
0,51±0,10 |
0,10±0,01 |
0,09±0,01 |
0,027±0,002 |
0,06±0,04* |
0,11±0,06 |
|
0,004 |
19137 |
1,02±0,02** |
0,55±0,10 |
0,13±0,01 |
0,10±0,01 |
0,021±0,002 |
0,03±0,02 |
0,19±0,05* |
|
0,005 |
18981 |
1,19±0,02*** |
0,63±0,11* |
0,12±0,01 |
0,13±0,01* |
0,032±0,003* |
0,06±0,04* |
0,22±0,07* |
|
0,008 |
19045 |
0,89±0,02 |
0,54±0,10 |
0,07±0,01 |
0,10±0,01 |
0,032±0,003* |
0,06±0,04* |
0,08±0,04 |
Звездочками отмечены величины, статистически значимо отличающиеся от контрольных: * – при Р<0,05, ** – при Р<0,01, *** – при Р<0,001
Помимо микроядер в генотоксических исследованиях на рыбах обычно анализируют возникновение и других ядерных аномалий. Механизмы возникновения ядерных нарушений, сопутствующих микроядрам, пока не объяснены полностью. Тем не менее, эти аномалии считают показателями генотоксического повреждения клеток и, следовательно, они могут дополнять микроядерный тест при изучении мутагенности веществ [14, 31]. Ниже проанализированы частоты этих аномалий.
Частота двуядерных клеток с повышением концентрации от нуля (в контроле) до 0,004 мг/л возрастала с 0,08% до 0,13%, а затем, при концентрациях 0,005 и 0,008 мг/л снижалась до 0,12% и 0,07% соответственно. Во всех вариантах опыта обнаруженные различия в частотах были статистически незначимыми при сравнении с частотой в контроле.
В отличие от полученных нами результатов, в ранее проведённом исследовании [16] было обнаружено существенное увеличение частоты двуядерных клеток в крови и различных тканях у рыб ( Cyprinus carpio , Carassius gibelio и Corydoras paleatus ), обработанных раствором соли кадмия в сублетальных концентрациях 0,005-0,1 мг/л. Возможной причиной расхождения результатов может быть то, что в нашем исследовании были исследованы экологически значимые и существенно более низкие концентрации кадмия.
В контрольной выборке частота амитотически делящихся клеток составила 0,06%. Почти такой же частота амитозов осталась при воздействии на карпов кадмия в концентрации 0,0005 мг/л. Дальнейшее увеличение концентрации кадмия в воде приводил к постепенному росту частот амитозов до 0,09, 0,010 и 0,13% (при концентрациях 0,001 и 0,002, 0,004 и 0,005 мг/л соответственно). Увеличение концентрации ионов кадмия до максимальной исследованной концентрации 0,008 мг/л вызвало некоторое снижение частоты амитозов
При воздействии на рыб кадмия частоты клеток с пузырящимися ядрами сразу возрастают вчетверо, но при концентрациях 0,0005-0,004 мг/л ещё остаются статистически незначимыми. Суточное пребывание карпов в воде с ионами кадмия в концентрациях 0,005 и 0,008 мг/л вызывало более чем 6-кратное увеличение частоты рассматриваемых аномалий, и эти различия были уже статистически значимыми.
Влияние возрастающих концентраций ионов кадмия на индукцию клеток с лопастными ядрами оказалось неоднозначным. При минимальной исследованной концентрации кадмия наблюдали увеличение частоты лопастных ядер в 2,5 раза. Однако у карпов, подвергнутых двукратно увеличенной концентрации ионов кадмия (0,001 мг/л), зафиксировано падение частоты рассматриваемых аномалий до контрольной величины (0,02%). Дальнейшее повышение концентрации кадмия до 0,002 мг/л вызвало новое, уже трёхкратное увеличение частоты аномалий. Вместе с тем, у карпов, проведших 24 часа в воде, содержащей следующую по величине концентрацию (0,004 мг/л) кадмия, частота аномалий оказалась вдвое меньшей и достигла величины лишь 0,03%. Наконец, карпы, подвергшиеся действию ионов кадмия в максимальных концентрациях 0,005 и 0,008 мг/л вновь показали повышение частоты лопастных ядер до 0,06%. Объяснить наблюдаемое изменение частот пока не представляется возможным. Можно предположить, что отсутствие закономерного изменения частоты рассматриваемого типа нарушений с увеличением концентрации кадмия в среде обитания карпов может быть обусловлено либо отсутствием прямой связи механизмов, вызывающих образование ядерных «лопастей» с концентрацией кадмия, либо является следствием случайных изменений числа ядер с данными аномалиями.
Частоты эритроцитов с зазубренными ядрами оставались почти неизменными при воздействии на карпов ионов кадмия первых трёх концентраций (0,0005, 0,001 и 0,002 мг/л). Затем, при увеличении концентрации (до 0,004 и 0,005 мг/л) их частота резко возрастала до 0,19 и 0,22%, соответственно. Дальнейшее увеличение концентрации до 0,008 мг/л приводило к снижению частоты «зазубренных» ядер до частоты, даже меньшей (0,08%), чем в контрольной выборке. Можно предположить наличие в клетках компенсаторных реакций, нейтрализующих вредное действие низких концентраций кадмия. При более высоких концентрациях эти механизмы не способны предотвратить повреждающее действие ионов металла. При максимальной же концентрации кадмия интоксикация клетки, вероятно, достигает такой степени, что ядерные процессы, ведущие к образованию «зазубренных» ядер просто прекращаются. Снижение частоты ядерных аномалий в наблюдаемых случаях происходило, по-видимому, из-за ингибирования ионами кадмия внутриклеточных и внутриядерных процессов. Цитотоксический эффект ионов кадмия был установлен в экспериментах с использованием высокопроизводительного скрининга (анализ γH2AX) в двух клеточных линиях человека (HepG2 и LS-174T), представляющих органы-мишени (печень и толстая кишка) [23].
Определённый интерес представляет анализ суммарных частот всех ядерных нарушений, обнаруженных в эритроцитах карпов, подвергнутых суточному воздействию ионов кадмия в разных концентрациях. Частота таких нарушений в контрольной выборке рыб составила 0,75%. Увеличение концентрации ионов кадмия с 0,0005 до 0,005 мг/л привело к повышению суммарных частот аномалий с 0,80 до 1,19%. При этом частоты аномалий, возникающих при концентрациях ионов 0,004 и 0,005 мг/л (равные 1,02 и 1,19%, соответственно), статистически достоверно отличались от суммарной частоты ядерных аномалий в контрольной выборке рыб. При максимальной исследованной концентрации ионов кадмия (0,008 мг/л) суммарная частота всех ядерных аномалий снижалась до 0,89%. Химические свойства кадмия подобны таковым у цинка. Поэтому кадмий способен замещать цинк в активных центрах металлсодержащих ферментов и вызывать сильные нарушения ферментативных процессов. Возможно, обнаруженное снижение суммарных частот ядерных аномалий при максимальной исследованной концентрации кадмия происходило из-за интоксикации рыбы и нару- шения важных метаболических процессов в их организме.
Механизм действия кадмия обусловлен его включением в различные звенья биохимических процессов. Кадмий способен разрывать связи между нуклеотидами в ДНК, разрушать сшивки ДНК с белком, ингибировать процессы репарации ДНК, вызывать окислительное повреждение ДНК, индуцировать хромосомные аберрации, нарушать регуляцию экспрессии генов. Кадмий способен ингибировать активность ряда ферментов, что может снижать активность иммунной системы и общую резистентность рыб к патогенным и стрессирующим факторам. Это может вести к повышению заболеваемости рыб в хозяйствах индустриального рыбоводства и наносить им экономический ущерб.
Из обнаруженных нами публикаций первой, в которой мутагенность кадмия для рыб (тиляпий) подтверждалась с использованием микроядерного теста, была работа [1]. В другом эксперименте пребывание нильских тиляпий ( Oreochromis niloticus ) в течение 2, 4, 6 и 10 суток в воде, содержащей ионы кадмия концентрациях 0,5 и 1,0 мг/л приводило к значительному увеличению частоты микроядер и других ядерных нарушений [25]. Более поздние эксперименты показали, что действие на тиляпий ( Oreochromis niloticus ) ионов кадмия в концентрации 4,63 мг/л в течение 24, 48, 72 и 96 часов вызывает статистически достоверное увеличение частоты микроядер и других ядерных аномалий в эритроцитах периферической крови [9]. В наших экспериментах 24 часовое воздействие ионов кадмия вызвало статистически достоверное повышение частоты микроядер при значительно более низких концентрациях. У других видов рыб воздействие кадмия также вызывает генетические нарушения. Индукция кадмием большого числа микроядер в различных тканях была обнаружена у форели ( Salmo trutta ) и гольяна обыкновенного ( Phoxinus phoxinus ) [27], а также у тиляпии мозамбикской ( Oreochromis mos-sambicus ) [17]. Внутрибрюшинное воздействие 0,05%-ного раствора хлорида кадмия барбусам лещевидным ( Puntius altus ) на 24, 48, 72 и 96 часов в дозе 1 мл/100 г приводило к изменению частоты микроядер в эритроцитах до 0,023, 0,043, 0,027, 0,013% соответственно при контрольной частоте, равной 0,003% [21]. Внутрибрюшинная инъекция угрям ( Anguilla anguilla L.) хлорида кадмия в дозе 1,7 мг ионов металла на килограмм массы тела вызвала через 24 часа увеличение частоты микроядер в эритроцитах до 5,56‰ при 2,29^ в контроле [28].
Помимо острой генотоксичности кадмия при краткосрочном воздействии интерес представляют результаты хронического влияния кадмия на организмы. В подобном исследовании было показано, что воздействие ионов кадмия на гамбузию в течение 1 недели в концентрациях 0,1-1,0 ppm статистически достоверно увеличивало частоту клеток с микроядрами до 0,6 и 0,8%о при 0,2%о в контроле [18].
В заключение следует подчеркнуть, что кадмий, являющийся одним из тяжёлых металлов, может накапливаться в объектах окружающей среды и в живых организмах. Попадая в организмы, кадмий может оказывать токсическое воздействие на биохимические процессы, модифицируя активность ряда ферментов, играющих важную роль в метаболизме. Образуя комплексы с ДНК, кадмий может нарушать успешность репарационных процессов, а также изменять активность некоторых генов. Эти свойства кадмия обусловливают его мутагенные и канцерогенные свойства. Однако указанные механизмы ещё недостаточно ясны и для получения возможности управления ими и профилактики негативных последствий необходимы дальнейшие исследования.
Выводы
-
1. Суточное пребывание карпов в воде, содержащей ионы кадмия (0,0005, 0,001, 0,002, 0,004, 0,005 и 0,008 мг/л), приводит к увеличению частот микроядер в эритроцитах карпа. Статистически значимые
-
2. Суточное пребывание карпов в воде, содержащей ионы кадмия в концентрациях 0,004, и 0,005 мг/л, приводит к статистически значимому увеличению суммарных частот всех ядерных нарушений (т.е. микроядер, двуядерных клеток, амитотически делящихся клеток, клеток с пузырящимися, лопастными и зазубренными ядрами) в эритроцитах карпа.
отличия от контрольной частоты наблюдали только в одном варианте опыта – 0,005 мг/л. Повышение концентрации кадмия до 0,008 мг/л снижало частоту образования микроядер до величины, не имеющей статистически значимых отличий от контрольной. Предположительно это происходило из-за интоксикации клеток и ингибирования клеточных делений в процессе которых и происходит образование микроядер.
Список литературы Влияние ионов кадмия на индукцию ядерных аномалий в эритроцитах карпов
- Гришанин А.К. и др. Изучение мутагенного действия дихлорофоса, кадмия и нафталина на эритроциты тиляпий (Oreochromis mossambicus, Peters) при помощи метода учёта микроядер / Гришанин А.К., Степанова В.А., Павлов Д.Ф. //Генетика. 1993. Т. 29, № 7. -С. 1213-1217.
- Дробот Г.П., Ремизова О.С. Использование гематологических показателей Lacerta agilis L. для оценки антропогенно нарушенных территорий // Известия Самарского научного центра Российской академии наук. 2012. Т. 14, № 1 (8). -С. 1887-1890.
- Ильинских Н.Н. и др. Генетический полиморфизм чувствительности цитогенетического аппарата лимфоцитов крови у жителей Республики Алтай к мутагенному действию кадмия в окружающей среде / Ильинских Н.Н., Кравцов В.Ю., Ильинских И.Н., Ильинских Е.Н., Юркин А.Ю., Романова М.С. // Бюллетень сибирской медицины, 2011. № 3, -7 с. http://www.international. ssmu.ru/ bull/11/03/08.pdf (Дата обращения: 10-02-2019).
- Ковалева О.А. и др. Нехромосомный цитогенетический анализ соматических клеток млекопитающих / О. А. Ковалева, Н. А. Безденежных, Ю. И. Кудрявей // Biopolymers and Cell.2013. V. 29. № 1. -Р. 33-41.
- Косякова Г.П. Кариотипическая нестабильность эритроцитов мясных, яичных и мясояичных пород кур. //Сборн. тезисов Всеросс. конфер. «50 лет ВОГиС: успехи и перспективы», Москва, 8-10 ноября 2016. - М.: 2016. - 349 с. -С. 194.


