Влияние ионов меди и кадмия на пигментный комплекс водных растений семейства Hydrocharitaceae
Автор: Косицына А.А., Макурина О.Н., Нестеров В.Н., Розенцвет О.А.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Водные экосистемы
Статья в выпуске: 1-1 т.12, 2010 года.
Бесплатный доступ
Исследовано влияние ионов меди и кадмия на пигментный комплекс водных растений семейства Hydrocharitaceae в условиях накопления металлов и в период последействия. Растения представляют собой различные экотипы: Egeria densa и Hydrilla verticillata - искусственно культивируемые растения, а Elodea сanadensis - природный экотип. Показано, что под действием ионов меди и кадмия в концентрации 100 мкМ снижается концентрация хлорофиллов а и b, каротиноидов, меняется содержание хлорофилла в светособирающем комплексе. Хлорофилла b оказался более устойчивым к воздействию ионов меди и кадмия в сравнении с хлорофиллом а и каротиноидами. Длительность воздействия металлов на растения определяет эффективность реабилитации.
Водные растения, тяжелые металлы, хлорофилл, каротиноиды, светособирающий комплекс
Короткий адрес: https://sciup.org/148198880
IDR: 148198880 | УДК: 574.24
Текст научной статьи Влияние ионов меди и кадмия на пигментный комплекс водных растений семейства Hydrocharitaceae
Наиболее информативными для характеристики функционального состояния и продуктивности растений считаются показатели фотосинтетического аппарата [1, 2]. Количество и соотношение пигментов в тканях растений определяют их физиологическое состояние, а также изменения, происходящие в процессе роста, развития и при различного рода стрессах [3, 4].
В последние десятилетия интенсивно изучается влияние на фотосинтетический аппарат растений антропогенных загрязнителей, таких как тяжелые металлы (ТМ) [5, 6]. Накопление ТМ растениями часто приводит к изменениям метаболизма. Среди токсических эффектов, которые ионы ТМ оказывают на фотосинтезирующую активность растений, следует отметить: ингибирование ферментов [7] и различных сайтов реакционных центров фотосистемы II (ФС II), усиление фотоингибирования [8], замедление функций пластоциана и др. [9].
Следует подчеркнуть, что в исследованиях, связанных с изучением влияния ионов ТМ, как правило, изучается их непосредственное действие на те, или иные процессы, оставляя без внимания такой важный аспект, как состояние растений в период последействия.
Медь (Cu) является незаменимым элементом для растений, поскольку входит в состав ряда металлосодержащих ферментов и принимает участие во многих жизненно важных процессах в клетке. Однако при ее содержании в среде в концентрациях, превышающих опти-
мальные, медь становится таким же токсикантом, как и кадмий (Cd), присутствие которого в тканях растений не является необходимым [10].
Целью данной работы стало сравнительное изучение состояния пигментного комплекса водных погруженных растений семейства Hydrocharitaceae при воздействии ионов меди и кадмия, а также в восстановительный период, когда действие металлов прекращается. Исследованные растения представляют собой различные экотипы. В частности, Egeria densa и Hydrilla verticillata выращивали в искусственных условиях, в то время как растения Elodea canadensis отбирались из естественных водоемов.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили водные погруженные сосудистые растение Elodea canadensis Michx., Egeria densa (Planch.) Caspari, Hydrilla verticillata (L. fil.) Royle из семейства Hydrocharitaceae (водокрасовые), порядок Alis-matales (частуховые), подкласс Alismatidae (алисматиды), класс Monocotyledones (однодольные).
Растения E. densa и H. verticillata выращивали в искусственных условиях на специализированных питательных средах, а E. canadensis отбирали из оз. Пляжное, которое находится на территории г. Тольятти.
Постановка эксперимента. Перед началом эксперимента побеги растений разрезали на фрагменты весом 3-4 г и помещали их в вегетационные сосуды объемом 1 дм3, содержащие отстоянную водопроводную воду. В опытные варианты добавляли соли Cu(NO3)2, Cd(NO3)2 в концентрации 100 мкМ. Использованная концентрация нитратных солей металлов вы- брана, исходя из ранее исследованных концентрационных и временных зависимостей влияния ТМ на липидный, белковый и пигментный метаболизм водных растений [11]. Растения инкубировали в условиях освещения -1400±200 лк при 10-часовом световом дне и температуре 24оС. В данных условиях растения выдерживали 1, 3 или 10 суток. По истечении заданного времени часть растений промывали в проточной воде и использовали для анализов, а другую помещали в чистую воду и выдерживали 5 суток (период «реабилитации»). Эта часть растений служила для анализа ТМ и пигментов в постстрессовый период.
Методы исследования. Содержание хлорофиллов а и b проводили спектрометрическим методом на Specol (Чехия) в ацетоновой вытяжке и рассчитывали по формулам Lichten-thaler [12]. Расчет доли хлорофиллов в светособирающем комплексе (ССК) производили с учетом того, что, во-первых, весь хлорофилл b находится в ССК, и, во-вторых, соотношение хлорофиллов a/b в ССК равно 1,2 [4].
Содержание ТМ в тканях растений определяли на атомно-абсорбционном спектрофотометре МГА-915 (Россия) после мокрого озоления [13].
Статистическую обработку данных (среднее значение, стандартное отклонение) проводили с использованием стандартных статистических методов (достоверности Стьюдента).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследования проводились на трех видах растений, которые относятся к одному семейству Hydrocharitaceae и одной и той же экологической группе водных погруженных растений. Следовательно, они являются наиболее близкородственными видами, как в систематическом, так и экологическом плане. E. densa и H. verticillata являются искусственно культивируемыми растениями в России, а E. canadensis — широко распространенным видом для местных водоемов. В данной работе использованы растения из его природной популяции. Можно полагать, что исследованные растения представляют собой разные экотипы.
Согласно атомно-абсорбционному анализу, инкубация выбранных видов макрофитов в среде, содержащей ионы Cu и Cd, приводила к накоплению этих металлов в тканях растений. Аккумуляция Cu у E. canadensis составила 3,98,5 мг/г сухого веса, у H. verticillata — 5,0-9,6 мг/г, у E. densa — 5,9-8,4 (табл. 1) . Максимальное содержание Cu для E. canadensis и E. densa наблюдалось после 10 суток экспозиции, а для H. verticillata — после 3 суток. В отличие от Cu максимальное накопление Cd зафиксировано в первые же сутки у E. canadensis и в третьи — у H. verticillata. В дальнейшем поглощения Cd не только не происходило, но часть металла, по-видимому, элиминировалась, поскольку его содержание через 3 и 10 суток было ниже, чем в первые сутки.
При перенесении растений в чистую воду (период реабилитации) содержание металлов в тканях уменьшалось. Доля оставшейся Cu составляла 21-26% от поглощенной за весь период инкубации для E. canadensis и свыше 30% — для H. verticillata в период реабилитации от 1 и 3 сутки воздействия . Уменьшение содержания металлов свидетельствовало в пользу их элиминации из растений, что подтверждалось анализами содержания ТМ после 5 суток реабилитации. Например, максимальное содержание Cu в тканях E. densa наблюдалось на 10 сутки эксперимента. Это превышало содержание металла в первые сутки на 30%, а на 3 сутки — на 18%. Анализируя данные по содержанию Cu во всех опытных растениях после периода реабилитации, можно увидеть, что наиболее эффективно процесс элиминации протекает для растений, выращиваемых в среде, содержащей Cu, в течение 3 суток (20-60%). Влияние ТМ на пигментный комплекс растений оценивали по концентрации хлорофиллов и каротиноидов, их соотношению, а также по содержанию хлорофилла в ССК.
Таблица 1. Содержание меди и кадмия в клетках растений семейства Hydrocharitaceae в зависимости от длительности воздействия (мг/г сухой массы)
|
Вид |
Экспозиция, сутки |
Инкубирование |
Реабилитация |
||
|
медь |
кадмий |
медь |
кадмий |
||
|
Elodea ñanadensis |
0 |
<0,1 |
< 0,1 |
< 0,1 |
< 0,1 |
|
1 |
3,9 ± 0,6 |
9,2 ± 0,6 |
3,0 ± 0,3 |
2,2 ± 0,4 |
|
|
3 |
6, ± 1,2 |
5,6 ± 0,8 |
5,3 ± 1,3 |
2,7 ± 0,1 |
|
|
10 |
8,5 ± 1,5 |
4,6 ± 0,4 |
6,3 ± 0,9 |
2,3 ± 0,2 |
|
|
Egeria densa |
0 |
<0,1 |
<0,1 |
<0,1 |
<0,1 |
|
1 |
5,9 ± 0,2 |
3,7 ± 0.1 |
4,4 ± 0,3 |
1,2 ± 0,1 |
|
|
3 |
6,9 ± 0,4 |
4,2 ± 0,3 |
5,2 ± 0,3 |
0,6 ± 0,1 |
|
|
10 |
8,4 ± 0,3 |
- |
7,6 ± 0,4 |
0,7 ± 0,1 |
|
|
Hydrilla verticillata |
0 |
< 0,1 |
< 0,1 |
< 0,1 |
< 0,1 |
|
1 |
5,0 ± 0,6 |
8,0 ± 0,4 |
3,5 ± 0,7 |
3,1 ± 0,2 |
|
|
3 |
9,6 ± 1,1 |
10,2 ± 0,5 |
3,8 ± 0,6 |
5,4 ± 0,2 |
|
|
10 |
5,1 ± 0,4 |
6,6 ± 0,6 |
4,8 ± 0,1 |
4,5 ± 0,5 |
|
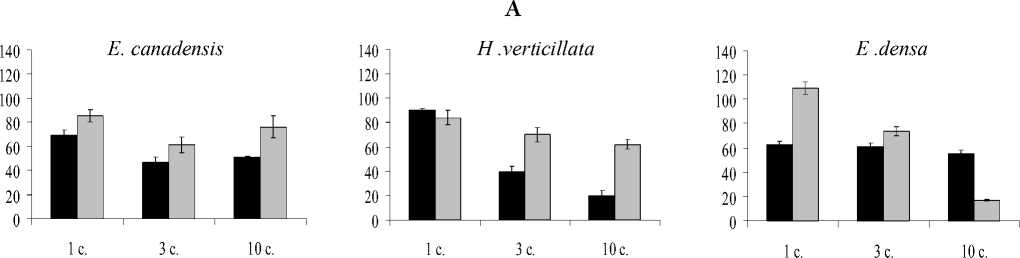
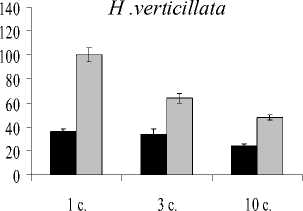
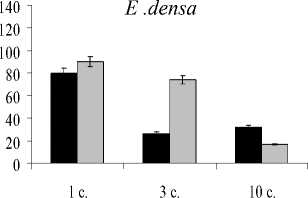
Изменение количества зеленых пигментов в сравнении с контрольными вариантами представлено на рис. 1. При экспозиции растений с ионами Cu количество хлорофилла а снижалось на 10-80% в зависимости от вида растений и времени экспозиции. Наибольшая деградация хлорофилла а наблюдалась при более длительной экспозиции для H. verticillata. Подобная тенденция, хотя и не столь интенсивная при кратковременной экспозиции в сравнении с ионами Cu, наблюдается и при действии Cd.
Б
С
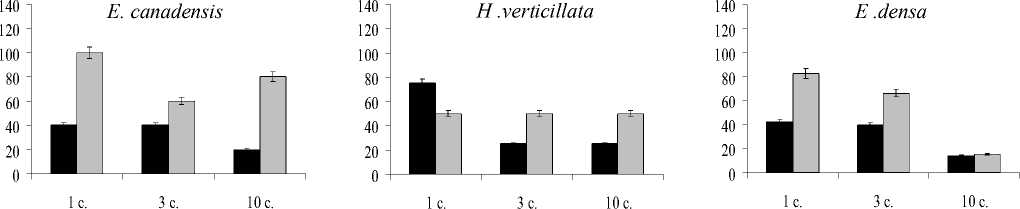
Рис. 1. Влияние ионов меди и кадмия на содержание хлорофилла а (А) , b (Б) и каротиноидов (С), % от контроля. Я-Медь, □ — кадмий.
Содержание хлорофилла b также менялось под действием обоих металлов, однако изменения имели более умеренный и видоспецифичный характер. Например, под действием Cu уровень хлорофилла b для E. canadensis снизился на 19%, начиная с первых суток воздействия. У E. densa под действием этого же металла содержание хлорофилла b к 3 суткам эксперимента уменьшилось на 23%, а в дальнейшем проявилась тенденция к незначительному увеличению содержания данного пигмента.
При кратковременном влиянии Cd отмечено достоверно значимое увеличение содержания хлорофилла b для H. verticillata (1-3 сутки воздействия) и E. densa (1 сутки). Но при более длительном воздействии уровень хлорофилла b снижался для E. canadensis и E. densa как в сравнении с контролем, так и в сравнении с кратковременным воздействием (рис. 1Б). Необходимо подчеркнуть, что для растений вида E. canadensis, которые представляют природный экотип, резкого изменения в содержании хлорофилла b отмечено не было.
В целом хлорофилл b оказался более устойчивым к действию Cu и Cd, чем хлорофилл a. Однако суммарное содержание хлорофилла a и b снижалось во всех экспериментах (табл. 2).
140 E. canadensis

1 с. 3 с. 10 с.
A
Б
С
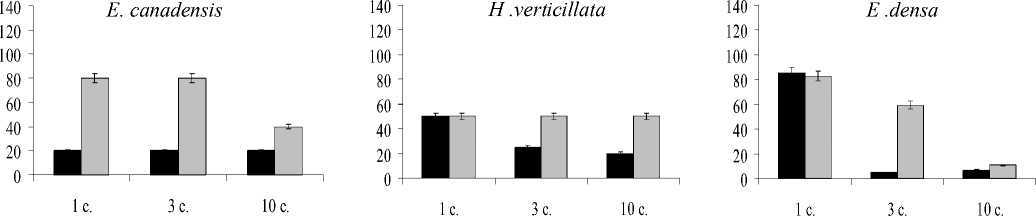
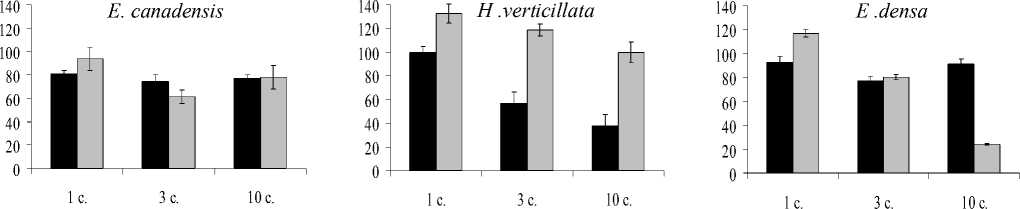
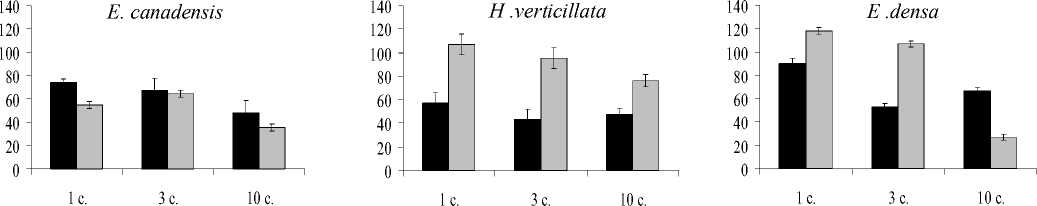
Рис. 2. Изменение содержания хлорофилла a (A), b (Б) и каротиноидов (С), % от контроля в период последействия. ^И- Медь,□ - кадмий.
Динамика содержания каротиноидов, как и хлорофиллов, зависела от вида экзогенного металла и вида растений. При действии Си их количество снижалось по отношению к контролю более чем на 50%, начиная с первых суток воздействия для E. canadensis и для E. densa и с 3 суток — для H. verticillata. Аналогичная динамика содержания пигментов наблюдается и для растений при добавлении Cd.
Отношение хлорофилла а к b в контрольных опытах у разных видов варьировало в небольшом интервале — от 2,4 до 2,6. Под действием Си отношение хлорофиллов a/b снижалось для всех видов растений. Под действием Cd изменение этой величины имело аналогичный характер для искусственно культивируемых растений (E. densa и H. verticillata) и оставалось практически неизменным для E. canadensis, представляющих природный экотип. Согласно представлениям X. Лихтенталлера [12], изменения этого соотношения свидетельствует о перестройке ультраструктуры хлоропластов, направленной на увеличение доли тилакоидов стромы или гран. Преобладание хлорофилла a формирует хлоропласты светового типа с преобладанием тилакоидов стромы, а хлорофилла b — хлоропласты с преобладанием тилакоидов гран. Можно предположить, что в условиях наших экспериментов также возможны аналогичные изменения в ультраструктуре хлоропластов. В изменении данного показателя просматривается зависимость от вида металла и экотипа растения.
Одним из показателей состояния пигментного комплекса хлоропластов, наравне с рассмотренными выше, является расчетная величина содержания хлорофилла в ССК от суммы хлорофиллов. При отсутствии металла в среде доля ССК для исследованных видов водных растений составляла 61,0-65,1% от суммы хлорофиллов. Анализ данных по величине пигментов ССК в условиях накопления металлов по- казал, что эта величина лабильна, а ее изменение зависело от металла и вида растения. Под действием Cu отмечен одинаковый характер изменения — увеличение уровня пигментов ССК. Увеличивалась доля ССК и под действием Cd, но только для искусственно культивируемых растений, в то время как у E. canadensis эта величина практически не менялась. Основная функция пигментов ССК состоит в поглощении и передачи энергии квантов света в реакционные центры. Полученные нами результаты показывают, что у растений, испытывающих влияние ионов Cu и Cd, происходит изменение соотношения между комплексами реакционных центров фотосистем и ССК, что не может не сказаться на эффективности фотосинтеза.
Таблица 2. Влияние ионов меди и кадмия на содержание хлорофиллов в фотосинтетическом аппарате водных погруженных растений семейства Hydrocharitaceae
|
S ад |
Me-талл/ время |
Аккумуляция |
Реабилитация |
||||
|
Хл a + b |
Хл a / b |
% Хл ССК * |
Хл a + b |
Хл a / b |
% Хл ССК * |
||
|
к "У О К О О |
Cu 0 |
1,06 |
2,4 |
64,3 |
1,06 |
2,4 |
64,3 |
|
Cu 1 |
0,77 |
2,1 |
71,4 |
0,66 |
1,9 |
77,7 |
|
|
Cu 3 |
0,58 |
1,5 |
87,2 |
0,55 |
1,6 |
84,0 |
|
|
Cu 10 |
0,62 |
1,6 |
54,2 |
0,38 |
1,5 |
86,8 |
|
|
Cd 0 |
1,06 |
2,4 |
64,3 |
1,06 |
2,4 |
64,3 |
|
|
Cd 1 |
0,93 |
2,2 |
68,6 |
0,90 |
2,5 |
41,5 |
|
|
Cd 3 |
0,65 |
2,4 |
64,3 |
0,71 |
2,5 |
62,0 |
|
|
Cd 10 |
0,81 |
2,4 |
65,2 |
0,37 |
2,4 |
65,4 |
|
|
о '1 i |
Cu 0 |
0,71 |
2,4 |
65,1 |
0,71 |
2,4 |
65,1 |
|
Cu 1 |
0,73 |
2,5 |
63,3 |
0,30 |
1,5 |
88,0 |
|
|
Cu 3 |
0,32 |
1,7 |
82,5 |
0,26 |
1,9 |
76,1 |
|
|
Cu 10 |
0,18 |
1,2 |
97,8 |
0,22 |
1,2 |
99,0 |
|
|
Cd 0 |
0,71 |
2,4 |
65,1 |
0,71 |
2,4 |
65,1 |
|
|
Cd 1 |
0,70 |
1,5 |
88,0 |
0,80 |
1,7 |
82,5 |
|
|
Cd 3 |
0,60 |
1,4 |
91,7 |
0,52 |
1,6 |
84,6 |
|
|
Cd 10 |
0,52 |
1,5 |
88,8 |
0,40 |
1,5 |
88,0 |
|
|
О К "У ’о |
Cu 0 |
0,54 |
2,6 |
61,0 |
0,50 |
2,8 |
58,0 |
|
Cu 1 |
0,39 |
1,8 |
79,0 |
0,52 |
1,3 |
96,0 |
|
|
Cu 3 |
0,26 |
1,4 |
92,0 |
0,12 |
1,4 |
92,0 |
|
|
Cu 10 |
0,27 |
1,1 |
107 |
0,17 |
1,1 |
106,0 |
|
|
Cd 0 |
0,54 |
2,6 |
61,0 |
0,50 |
2,8 |
58,0 |
|
|
Cd 1 |
0,39 |
2,2 |
66,7 |
0,16 |
1,7 |
81,2 |
|
|
Cd 3 |
0,28 |
2,1 |
71,4 |
0,20 |
1,5 |
90,0 |
|
|
Cd 10 |
0,1 |
1,5 |
90,0 |
0,04 |
1,0 |
99,0 |
|
Примечание * - %от суммы хлорофиллов
Таким образом, анализ фотосинтетических пигментов показал, что оба металла в выбранной нами концентрации оказывают негативный эффект на содержание пигментов водных растений. Хотя у всех растений наблюдалось уменьшение суммы хлорофиллов и содержания каротиноидов по сравнению с контролем, для E. с anadensis , представляющих природную популяцию , уровень изменений был наименьшим .
В реабилитационный период увеличение количества хлорофилла а в сравнении с периодом накопления отмечено после краткосрочно го (1 сутки) воздействия обоих металлов на растения вида E. densa. При более длительной экспозиции происходит дальнейшее снижение концентраций данного пигмента в тканях этого вида растений. Для H. verticillata достоверное увеличение количества хлорофилла а происходило после 1 суток воздействия кадмия. В случае с E. canadensis восстановления хлорофилла а не наблюдали.
В отношении хлорофилла b можно отметить, что он оказался более устойчивым в сравнении с хлорофиллом а , поскольку в реабилитационный период его уровень менялся незначительно. В результате, сумма хлорофиллов а и b , а также их отношение практически не менялось в сравнении с периодом накопления металлов. Не менялось также относительное содержание пигментов ССК в общем пуле хлорофиллов.
Изменение в количественном содержании каротиноидов в восстановительный период носит видоспецифический характер. У E. canadensis и H. verticillata происходит дальнейшее снижение содержания пигментов, а для E. densa — увеличение содержания каротиноидов при реабилитации от 1-суточного воздействия металлов.
Полученные нами результаты согласуются с многочисленными исследованиями, в которых отмечается, что при накоплении растениями ТМ часто происходит деградация хлорофилла [6, 14-16]. Одной из причин снижения количества пигментов является окисление хлорофиллов активными формами кислорода [5]. При малых концентрациях Cu в среде возможна замена ионов Mg 2+ в хлорофилле на Cu 2+ . При более высоких концентрациях Cu может приводить к редукции синтеза аминолевуленовой кислоты — предшественника хлорофиллов и протохлорофеллид редуктазы, которая катализирует восстановительное формирование хлор-филида из протохлорфелида при биосинтезе хлорофиллов [17]. Cd, кроме того, подавляет активность донорного участка ФС II, ингибирует ферменты цикла Кальвина [18]. Конечным результатом негативного влияние металлов является изменение внутриклеточного состава. Известно, что уже при невысоком содержании ионов Сd в среде происходит уменьшение размеров хлоропластов клетки, а при высоких концентрация металла наблюдается снижение и числа зеленых пластид клетки [19]. Полученные нами данные свидетельствуют о существенном изменении метаболизма, связанном, по-видимому, с изменением ультраструктуры хлоропластов и количеством пластид.
Список литературы Влияние ионов меди и кадмия на пигментный комплекс водных растений семейства Hydrocharitaceae
- Головко Т.К. Актуальные вопросы экофизиологии растений//Структурно-функциональные особенности биосистем Севера (особи, популяции, сообщества): Материалы конф. Петрозаводск, 2005. Ч. 1(А-Л). С. 88-91.
- Мокроносов А.Т. Фотосинтетическая функция и целостность растительного организма. М., 1983. 64 с.
- Головко Т.К., Далькэ И.В., Бачаров Д.С. Мезоструктура и активность фотосинтетичес-кого аппарата трех видов растений сем. Crassulaceae в холодном климате//Физиология растений. 2008. Т. 55, № 5. С. 671-680.
- Маслова Т.Г., Мамушина Н.С., Шерстнева О.А., Буболо Л.С., Зубкова Е.К. Структурно-функциональные изменения фотосинтетического аппарата у зимневегетирующих хвойных растений в различные сезоны года//Физиология растений. 2009. Т. 56, № 5. 672-681.
- Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам. Петрозаводск, 2007. 172 с.
- Rama Devi S., Prasad M.N.V. Heavy metal stress in plants. From molecules to ecosystems//Berlin, 1999. P. 99-117.
- Stobart A.K., Griffiths W.T., Ameen-Bukhuri I., Sherwood R.P. The effect of Cd2+ on the biosynthesis of chlorophyll in leaves of barley//Physiol. Plant. 1985. V. 63. P. 293-298.
- Vavilin D.V., Polynov V.A., Matorin D.N., Venediktov P.S. Sublethal concentration of copper stimulate photosystem II photoinhibition in Chlorella pyrenoidosa//Plant Physiol. 1995. V. 146. P. 609-614.
- Kimimura M., Kathon S. Studies on electron transport associated with photosystem I. I. Functional site of plastocyanin, inhibitory effects of HgCl2 on electron transport and plastocyanin in chloroplasts//Biochim. Biophys. Acta. 1972. V. 282. P. 279-292.
- Kanoun-Boule M., Vicente J.A.F., Nabais C., Prasad M.N.V., Freitas H. Ecophysiological tolerance of duckweeds exposed to copper//Aquatic Toxicology. 2009. V. 91. Р. 1-9.
- Розенцвет О.А., Мурзаева С.В., Гущина И.А. Роль мембранных липидов в устойчивости Potamogeton perfoliatus L. к избытку кадмия в воде//Изв. РАН. Сер. биол. 2004. № 6. С. 232-239.
- Lichtenthaller H.K. Chlorophylls and Carotenoids: Pigments of Photosynthetic Biomembranes//Methods in enzymology. 1987. V. 148. Р. 350-382.
- Голубкина Н.А. Флуорометрический метод определения селена//Журн. аналит. химии. 1995. Т. 50. С. 492-497.
- Рrasad M.N.V., Malec P., Waloszek A., Bojko M., Strzalka K. Physiological responses of Lemnz trisulca L. (duckweed) to cadmium and copper bioaccumulation//Plant Sci. 2001. V. 161. P. 881-889.
- Chatterjee C., Sinha P., Dube B.K., Gopal R. Excess copper-induced oxidative damages and changes in radish physiology//Commun. Soil. Sci. Plant Anal. 2006. V. 37. P. 2069-2076.
- Perales-Vela H.V., Gonsalez-Moreno S., Montes-Horeasitas C., Canizares-Villanueva R.O. Growth, photosynthetic and respiratory responses to sub-lethal copper concentrations in Scenedesmus incrassatulus (Chlorophyceae)//Chemosphere. 2007. V. 67.. P. 2274-2281.
- Stiborova M., Doubravova M., Brezinovaet A., Friedrich A. Effect of heavy metal ions on growth and biochemical characteristics of photosynthesis of barley (Hordeum vulgare L.)//Photosynthetica. 1986. V. 20. P. 418-425.
- Teige M., Huchzermeyer B., Schultz G. Inhibitio of chloroplasts ATP-synthase/ATP-ase is a primary target of heavy metal toxicity in spinach plants//Biochem. Physiol. Pflanzen. 1990. V. 186. P. 165-171.
- Казнина Н.М., Лайдинен Г.Ф., Венжик Ю.В., Титов А.Ф. Влияние кадмия на некоторые анатомо-морфологические показатели листа и содержание пигментов ячменя//Материалы междунар. науч. конф., посвящ. 200-летию Казан. бот. школы. Функциональная ботаника. Институт биологии КарНЦ РАН, Петрозаводск, 2009.


