Влияние экспрессии белков ROR1, BMI-1 и мутации PIK3CA на прогноз люминального рака молочной железы
Автор: Вторушин С.В., Тараканова В.О., Бабышкина Н.Н., Гервас П.А., Крахмаль Н.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.24, 2025 года.
Бесплатный доступ
Рак молочной железы (РМЖ) остается одной из ведущих причин онкологической смертности среди женщин. Люминальные подтипы РМЖ, характеризующиеся экспрессией гормональных рецепторов, составляют около 70 % всех случаев. Однако, несмотря на чувствительность к эндокринной терапии, часть пациенток демонстрирует прогрессирование заболевания, что связано с молекулярными особенностями опухоли. Изучение прогностических маркеров, таких как ROR1, BMI-1 и мутация PIK3CA, является важным направлением в понимании механизмов устойчивости к терапии и метастазирования. Цель исследования - оценка прогностической значимости экспрессии белков ROR1, BMI-1 и мутации гена PIK3CA у пациенток с люминальным РМЖ, получавших гормонотерапию ингибиторами ароматазы, а также их влияние на клинические исходы, включая 5-летнюю безрецидивную выживаемость. Материал и методы. В исследование были включены 80 пациенток с первично-операбельным люминальным Нег2-негативным РМЖ (T1-2N0-1M0). Все пациентки получали адъювантную гормонотерапию ингибиторами ароматазы. В опухолевой ткани оценивали экспрессию ROR1, BMI-1, циклина D1 (метод иммуногистохимии) и наличие мутации PIK3CA (метод полимеразной цепной реакции в реальном времени). Результаты. Позитивная экспрессия ROR1 выявлена в 57,5 %, BMI-1 - в 82,5 %, гиперэкспрессия циклина D1 - в 37,5 % случаев. Мутация PIK3CA установлена у 30 % пациенток. Экспрессия ROR1 выявлялась в 100 % случаев при люминальном B подтипе (14 из 14) и в 48 % при подтипе A (32 из 66) (p=0,001). При наличии экспрессии ROR1 гиперэкспрессия циклина D1 отмечалась в 58,7 % против 8,8 % при ее отсутствии, p<0,0001. Высокий уровень экспрессии ROR1 (-50 %) ассоциировался с гиперэкспрессией циклина D1 в 100 % случаев (p=0,044). Аналогично при высоком уровне экспрессии BMI-1 (-50 %) гиперэкспрессия циклина D1 регистрировалась у 64,7 % пациенток против 31,6 % при низком уровне (p=0,03). У пациенток с мутацией PIK3CA 5-летняя безрецидивная выживаемость была значимо ниже (p=0,03), прогрессирование наблюдалось у 29 % против 13 % без мутации (p=0,07). Заключение. Исследование подтверждает значимость ROR1, BMI-1 и мутации PIK3CA как потенциальных прогностических маркеров у пациенток с люминальным РМЖ. Выявленные взаимосвязи с циклином D1 и молекулярными подтипами подчеркивают их роль в опухолевом прогрессировании. Полученные данные могут быть использованы для дальнейшей персонализации лечения, включая комбинированные подходы с ингибиторами PI3K и гормонотерапией.
Люминальный рак молочной железы, ROR1, BMI-1, цикпин D1, мутация PIK3CA, безрецидивная выживаемость, ингибиторы ароматазы
Короткий адрес: https://sciup.org/140309140
IDR: 140309140 | УДК: 618.19-006.6-037:577.112:575.224 | DOI: 10.21294/1814-4861-2025-24-2-46-55
Текст научной статьи Влияние экспрессии белков ROR1, BMI-1 и мутации PIK3CA на прогноз люминального рака молочной железы
Рак молочной железы (РМЖ) продолжает стабильно занимать лидирующие позиции по показателям онкологической заболеваемости и смертности среди женского населения [1]. К люминальным опухолям молочной железы относятся те новообразования, которые демонстрируют положительную экспрессию эстрогеновых и/или прогестероновых рецепторов, данный вид опухолей составляет около 70 % от всех случаев РМЖ [2]. Существует ряд молекулярно-биологических факторов, оказывающих влияние на рост и пролиферацию злокачественных опухолей молочной железы, кроме того, обозначенные факторы способствуют формированию неэффективности проводимой лекарственной терапии.
Ключевую роль в синтезе эстрадиола играет фермент ароматаза. Экспрессия данного фермен- та встречается как в здоровых тканях (яичники, молочные железы, жировая ткань, костная ткань), так и в тканях опухолей, в частности при РМЖ [3–5]. В норме при синтезе ароматазы используется преимущественно промотор 1.4, в жировой ткани здоровой молочной железы он активируется минимально для поддержания базового уровня экспрессии этого фермента. Существует ряд других промоторов, которые могут участвовать в процессе экспрессии ароматазы. Переключение промотора ароматазы с 1.4 на 1.3/II является основным механизмом, который опосредует повышенную экспрессию ароматазы и локальное образование эстрогена в жировой ткани, прилегающей к ткани карциномы молочной железы, а также в самой опухоли. Смена использования промотора ароматазы в злокачественно измененных тканях является основным механизмом, вызывающим аномальную сверхэкспрессию ароматазы и избыток эстрогена, что, в свою очередь, ухудшает прогноз гормончувствительного РМЖ [6–8].
Одной из отличительных особенностей злокачественных опухолей является способность поддержания передачи сигналов к пролиферации. Ген CCND1 кодирует белок циклин D1, который потенцирует пролиферацию опухолевых клеток. Данный ген является вторым по частоте амплификации онкогеном среди порядка 26 гистологических типов опухолей различных локализаций. При взаимодействии циклина D1 с циклин-зависимой киназой 4/6 (CDK 4/6) происходят фосфорилирование и инактивация белка ретинобластомы (Rb), что является важным регуляторным шагом для перехода G1-S и прохождения клеточного цикла. Частота амплификации гена CCND1 при РМЖ, по разным данным, составляет от 9–15 до 35 %, при этом гиперэкспрессия белка циклина D1 встречается примерно в 50 % случаев (до 70 %, по данным метаанализа S.A. Jeffreys et al. [10]), отмечена связь с люминальным подтипом РМЖ [9–11]. Данные литературных источников, касающиеся роли и значения амплификации CCND1 в развитии резистентности к эндокринной терапии (ингибиторы ароматазы и тамоксифен) у пациенток с ER+ РМЖ, неоднозначны [12].
Особый интерес представляет роль белков BMI-1 и ROR1 в патогенезе РМЖ и его люминального подтипа в частности. Белок ROR1 – ор-фановый рецептор, играющий важнейшую роль в период эмбрионального развития в процессах дифференцировки и роста тканевых элементов, у взрослого человека в норме его экспрессия в тканях практически не встречается [20]. Гиперэкспрессия ROR1 выявляется при ряде злокачественных опухолей, таких как рак легкого, хронический лимфолейкоз и РМЖ [21]. Важно отметить, что при опухолях молочной железы наиболее часто гиперэкспрессия данного белка встречается при люминальных подтипах и коррелирует с более высокой степенью злокачественности и худшим прогнозом [22, 23]. Существуют данные о том, что экспрессия белка ROR1 в моделях клеточных линий люминального РМЖ ассоциирована с процессом эпителиально-мезенхимального перехода опухолевых клеток и, как следствие, развитием метастазирования [24].
BMI-1 является белком семейства поликомб, одна из его основных функций – регуляция генов, способствующих дифференцировке и самообновлению стволовых клеток [25]. Повышенная экспрессия белка встречается во многих опухолях, включая карциномы молочной железы, и связана с более агрессивным течением опухолевого процесса, а также с неэффективностью проводимой гормонотерапии и неблагоприятным прогнозом для пациентов [26, 27].
Исследования показали, что ко-экспрессия белков ROR1 и BMI-1 может усиливать процессы роста и пролиферации клеток люминального РМЖ, тем самым ухудшая прогноз течения данного заболевания. Одновременный нокдаун обоих белков приводит к синергическому ингибирующему действию на рост злокачественно трансформированных опухолевых клеток [28].
Учитывая уже имеющиеся фундаментальные знания о роли белков ROR1 и BMI-1 при карциномах молочной железы, несомненный интерес вызывает комплексное изучение данных факторов и их связь с прогнозом течения РМЖ и формированием неэффективности гормонотерапии.
Цель исследования – оценить прогностическую значимость экспрессии белков ROR1, BMI-1 и мутации гена PIK3CA в опухоли у пациенток с люминальным раком молочной железы, получавших гормонотерапию ингибиторами ароматазы.
Материал и методы
Группу исследования составили 80 пациенток (средний возраст – 62,1 ± 8,1 года) с первичнооперабельным РМЖ стадии T1–2N0–1M0, находившихся на лечении в отделении общей онкологии НИИ онкологии ФГБНУ Томский НИМЦ РАН, во всех случаях больным выполнен оперативный этап лечения в объеме мастэктомии или секторальной резекции молочной железы, проводились лучевая терапия и гормонотерапия ингибиторами ароматазы в адъювантном режиме. Критерии включения в исследование: гистологически и иммуногистохимически подтвержденный люминальный Her2-негативный подтип РМЖ, постменопауза и адъювантная гормонотерапия ингибиторами ароматазы. Критерии исключения: наличие неоадъювантной терапии, адъювантная химиотерапия и первично-множественные злокачественные опухоли. Период наблюдения составил 5 лет.
В данном исследования проводилось морфологическое изучение ткани опухоли и всех удаленных лимфатических узлов аксиллярной клетчатки, полученных в результате хирургического лечения (операционный материал). Во всех случаях диагноз люминального Her2-негативного подтипа РМЖ был установлен на основании ряда гистологических и иммуногистохимических критериев, представленных в классификации опухолей молочной железы 5-го пересмотра (классификация ВОЗ, 2019). В исследование включены только опухоли, имеющие люминальный А и люминальный В Her2-негативный молекулярный подтип. При морфологическом исследовании на светооптическом уровне в препаратах ткани первичной опухоли определяли гистологический тип и степень злокачественности, в лимфатических узлах оценивали наличие метастазов. Для оценки указанных параметров применяли световой микроскоп Nikon ECLIPSE Ci.
Во всех случаях проводили иммуногистохимическое исследование с применением антител к ROR1 (ROR1 antibody, polyclonal, 1:100, ThermoFisher), BMI-1 (BMI-1 antibody, polyclonal, 1:100, ThermoFisher) и циклину D1 (Cyclin D1 antibody, monoclonal, 1:100, Abcam). Иммуногистохимическое окрашивание выполняли с использованием автоматического иммуногистостейнера Bond-MAX (Leica Biosystem) в соответствии со стандартным протоколом. В срезах первичной опухоли в каждом случае оценивали наличие иммунного окрашивания белков ROR1 и BMI-1, свидетельствующего о позитивной экспрессии данных маркеров, а также степень ее выраженности. В соответствии с установленными критериями слабая степень экспрессии определялась при наличии иммунного окрашивания от 1 до 25 % опухолевых клеток, умеренная – при окрашивании от 25 до 50 % клеток, а высокая степень – при окрашивании более 50 % опухолевых клеток. Гиперэкспрессию циклина D1 оценивали по наличию ядерного иммунного окрашивания в опухолевых клетках, используя пороговое значение более 25 %. Оценка окрашивания проводилась в наиболее представительных полях зрения двумя независимыми патологами, в случаях расхождений применялся консенсусный метод.
Для определения наличия мутации гена PIK3CA выделяли ДНК из фиксированных в формалине и залитых в парафин образцов ткани с использованием набора ДНК cobas® DNA Sample Preparation Kit. Тест на мутации гена PIK3CA проводили с применением набора cobas® PIK3CA Mutation Test. Набор cobas® PIK3CA Mutation Test основан на полимеразной цепной реакции в реальном времени, для качественного обнаружения и идентификации 17 мутаций (E542K, E545A, E545D, E545G, E545K, E545Q, Q546E, Q546R, Q546K, N345K, C420R, H1047L, H1047R, H1047Y, M1043I, G1049R и E726K) в экзонах 2, 5, 8, 10 и 21 гена каталитической субъединицы альфа фосфо-инозитид-3-киназы (PIK3CA) в ДНК образцов ткани с использованием амплификатора cobas® 4800.
Прогрессирование заболевания определяли на основании анализа медицинской документации. В ходе динамического наблюдения на различных этапах обследования фиксировали появление и проводили верификацию отдаленных гематогенных метастазов. В случаях их выявления пациентку относили к группе с зарегистрированным фактом прогрессирования заболевания.
Статистический анализ проведен с использованием пакета Statistica 10.0. Проверка нормальности распределения переменных осуществлялась с применением критерия Колмогорова–Смирнова. Для оценки различий между группами использовались непараметрический критерий χ2 для категориальных переменных. Оценка 5-летней безрецидивной выживаемости проводилась методом Каплана– Майера, статистическая значимость различий между группами определялась с использованием log-rank теста. Различия считались статистически значимыми при p<0,05.
Результаты
В результате проведенного исследования в изучаемой когорте пациенток (n=80) у 14 (17,5 %) больных зарегистрировано прогрессирование заболевания (группа 1), тогда как в 66 случаях ретроспективный анализ выявил стабилизацию опухолевого процесса (группа 2). Сформированные группы были сопоставимы по ключевым клинико-морфологическим характеристикам новообразования, включая стадию заболевания, гистологический тип, за исключением степени злокачественности РМЖ (р=0,047). Распределение случаев в обеих группах представлено в табл. 1, где отчетливо видна выявленная корреляция между молекулярным подтипом РМЖ и прогрессированием заболевания.
Òàблицà 1/Table 1
Êлиниêî-мîðфîлîгичåñêиå пàðàмåтðы îпóõîлåé мîлîчнîé жåлåзы в зàвиñимîñти îт нàличия или îтñóтñтвия пðизнàêîв пðîгðåññиðîвàния зàбîлåвàния
Clinical and morphological parameters of breast tumors depending on the presence or absence of signs of disease progression
|
Параметры/Parameters |
Наличие признаков прогрессирования/ Presence of signs of disease progression |
Отсутствие признаков прогрессирования/ Absence of signs of disease progression |
р |
|
|
Стадия заболевания/ |
I |
7/14 (50,0 %) |
32/66 (49,0 %) |
0,96 |
|
Stage of the disease |
IIA |
5/14 (36,0 %) |
26/66 (39,0 %) |
|
|
IIB |
2/14 (14,0 %) |
8/66 (12,0 %) |
||
|
Гистологический тип/ |
Инвазивный дольковый рак/ Invasive lobular carcinoma Инвазивный протоковый рак/ |
2/14 (14,0 %) |
6/66 (9,0 %) |
0,56 |
|
Histology type |
12/14 (86,0 %) |
60/66 (91,0 %) |
||
|
Invasive ductal carcinoma |
||||
|
Степень |
I |
6/14 (43,0 %) |
42/66 (64,0 %) |
|
|
злокачественности/ |
II |
7/14 (50,0 %) |
24/66 (36,0 %) |
р=0,047 |
|
Grade |
III |
1/14 (7,0 %) |
0/66 (0,0 %) |
|
|
Люминальный А/ |
7/14 (50,0 %) |
59/66 (89,0 %) |
||
|
Молекулярный подтип/ |
Luminal A |
0,0004 |
||
|
Molecular type |
Люминальный В/ |
7/14 (50,0 %) |
7/66 (11,0 %) |
|
|
Luminal B |
||||
Примечание: таблица составлена авторами.
Note: created by the authors.
При анализе экспрессии маркеров ROR1 и BMI-1 в ткани первичной опухоли РМЖ иммуногистохимическим методом позитивная экспрессия белка ROR1 была обнаружена в 57,5 % случаев (n=46/80), белка BMI-1 – в 82,5 % случаев (n=66/80). Детальное исследование выраженности степени экспрессии BMI-1 в выборке пациенток (n=66) выявило следующую картину распределения: слабая экспрессия наблюдалась у 43 пациенток (65,2 %), умеренная – у 6 пациенток (9,1 %), высокая – у 17 пациенток (25,7 %). Таким образом, доминирующим паттерном экспрессии BMI-1 являлся низкий уровень, идентифицированный у двух третей обследованных, в то время как высокий уровень экспрессии был выявлен примерно у четверти исследуемой когорты. Также был проведен анализ степени экспрессии маркера ROR1 в группе пациенток с наличием позитивного иммунного окрашивания (n=46). Распределение уровней экспрессии имело следующие показатели: слабая экспрессия – 34 (73,9 %), умеренная – 8 (17,4 %), высокая экспрессия – 4 (8,7 %) случая. Подобно BMI-1, для ROR1 было характерно преобладание низкого уровня экспрессии, зафиксированного почти у трех четвертей исследуемых пациенток. Необходимо подчеркнуть, что частота встречаемости высокого уровня экспрессии ROR1 была существенно ниже в сравнении с BMI-1, составляя менее одной десятой части выборки.
Мутация гена PIK3CA была идентифицирована в 30 % опухолей (n=24/80), с наибольшей частотой локализации в экзонах H1047X (37,5 %) и E545X
(33 %), реже – в экзонах Q546X и N345K (по 12,5 %) и E542K (4,5 %). Гиперэкспрессия циклина D1 в клетках первичной опухоли была верифицирована у 30 пациенток (37,5 %).
Полученные данные о частоте позитивной экспрессии маркеров ROR1 и BMI-1, уровнях их экспрессии в опухолевой ткани, а также сведения о наличии мутации гена PIK3CA и гиперэкспрессии циклина D1 были ретроспективно сопоставлены с клинико-морфологическими параметрами первичной опухоли (стадия заболевания, гистологический тип, степень злокачественности, молекулярный подтип), а также с фактом наличия либо отсутствия признаков прогрессирования заболевания на протяжении периода наблюдения.
Проведенное исследование установило отсутствие значимых различий между частотой позитивной экспрессии белка ROR1 в опухолевой ткани, стадией заболевания, гистотипом и степенью злокачественности новообразования. Однако выявлена отчетливая связь экспрессии данного маркера с молекулярным подтипом РМЖ. У всех пациенток с люминальным B (14 из 14, 100 %) выявлена экспрессия ROR1, в то время как среди пациенток с подтипом А – в 32 из 66 (48 %) случаев (p=0,001). При наличии позитивной экспрессии ROR1 гиперэкспрессия циклина D1 наблюдалась у 27 из 46 (58,7 %) пациенток, тогда как при отсутствии экспрессии ROR1 – только у 3 из 34 (8,8 %) (p<0,0001). Кроме того, при высоком уровне экспрессии ROR1 (>50 %) гиперэкспрессия циклина D1 регистрировалась у 4 из 4 (100 %) пациенток,
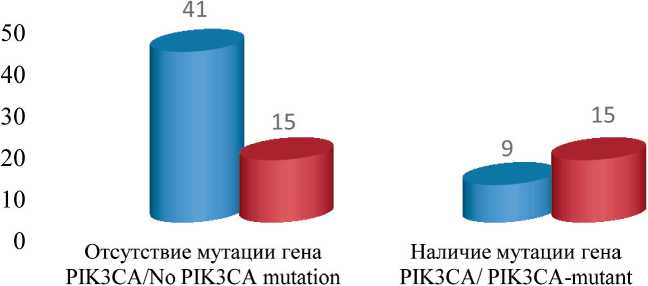
-
■ Отсутствие гиперэкспрессии циклина Dl/No cyclin DI overexpression
-
■ Наличие гиперэкспрессии циклина DI/Cyclin DI overexpression: present
Рис. 1. Распределение больных люминальным РМЖ в зависимости от наличия либо отсутствия мутаций гена PIK3CA и гиперэкспрессии ци-клина D1 в ткани первичной опухоли.
Примечание: рисунок выполнен авторами
Fig. 1. Distribution of patients with luminal breast cancer depending on the presence or absence of PIK3CA gene mutations and cyclin D1 hyperexpression in the primary tumor tissue.
Note: created by the authors при уровне 25–50 % – у 17 из 26 (65 %) и при уровне <25 % – у 6 из 16 (37,5 %) (p=0,044). В исследовании не была идентифицирована связь между экспрессией ROR1 и наличием признаков прогрессирования заболевания.
Анализ особенностей экспрессии белка BMI-1 аналогичным образом продемонстрировал отсутствие статистически значимых различий между частотой его позитивной экспрессии в опухолевой ткани, стадией заболевания, гистотипом и степенью злокачественности новообразования. Для маркера BMI-1 также отмечалась тенденция к связи с молекулярным подтипом, не достигшая статистической значимости: у всех пациенток с люминальным B подтипом (14 из 14, 100 %) выявлена позитивная экспрессия, тогда как среди пациенток с люминальным A подтипом экспрессия отмечалась в 52 из 66 (78,8 %) случаев (p=0,13).
При наличии экспрессии BMI-1 в опухоли позитивная экспрессия ROR1 была зарегистрирована у 44 из 66 (66,7 %) пациенток, а при отсутствии – у 2 из 14 (14,3 %) (p=0,001). Хотя в целом между частотой экспрессии BMI-1 и гиперэкспрессией ци-клина D1 значимой связи не отмечено, при высоком уровне экспрессии BMI-1 (>50 %) гиперэкспрессия циклина D1 выявлялась у 11 из 17 (64,7 %) пациенток, в то время как при уровне <25 % – у 18 из 57 (31,6 %) (p=0,03). Кроме того, в группе пациенток с прогрессированием заболевания (n=14) в 100 % случаев (14 из 14) зарегистрирована позитивная экспрессия BMI-1, по сравнению с 52 из 66 (78,8 %) в группе без признаков прогрессирования; однако данная разница не достигла статистической значимости (p=0,13).
В ходе выполненной работы не обнаружено значимой связи между наличием/отсутствием мутаций гена PIK3CA и всеми исследуемыми клинико-морфологическими параметрами первичной опухоли, частотой позитивной экспрессии и уровнем экспрессии белков ROR1 и BMI-1. Продемонстрировано, что при отсутствии в опухоли гиперэкспрессии циклина D1 мутация гена PIK3CA идентифицировалась значимо реже (р=0,003) (рис. 1). Выявлена отчетливая тенденция к взаимосвязи между наличием мутации гена PIK3CA и фактом прогрессирования заболевания, а также молекулярным подтипом опухоли (p=0,07 в обоих случаях) (табл. 2).
Таблица 2/Table 2
Распределение случаев мутации гена PIK3CA среди пациенток с люминальным РМЖ в зависимости от факта прогрессирования заболевания и молекулярного подтипа опухоли
Distribution of PIK3CA gene mutation among patients with luminal breast cancer depending on the evidence of disease progression and molecular tumor subtype
|
Параметры/Parameters |
Мутация гена PIK3CA / PIK3CA gene mutation |
|
|
Наличие мутации/ Presence of mutation (n=24) |
Отсутствие мутации/ Absence of mutation (n=56) |
|
|
Наличие признаков прогрессирования/ Presence of signs of disease progression (n=14) |
7 (50 %) |
7 (50 %) |
|
Отсутствие признаков прогрессирования/ Absence of signs of disease progression (n=66) |
17 (26 %) |
49 (74 %) χ2=3,23; p=0,07 |
|
Люминальный A молекулярный подтип/ Luminal A molecular subtype (n=66) |
17 (26 %) |
49 (74 %) |
|
Люминальный В молекулярный подтип/ Luminal B molecular subtype (n=14) |
7 (50 %) |
7 (50 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
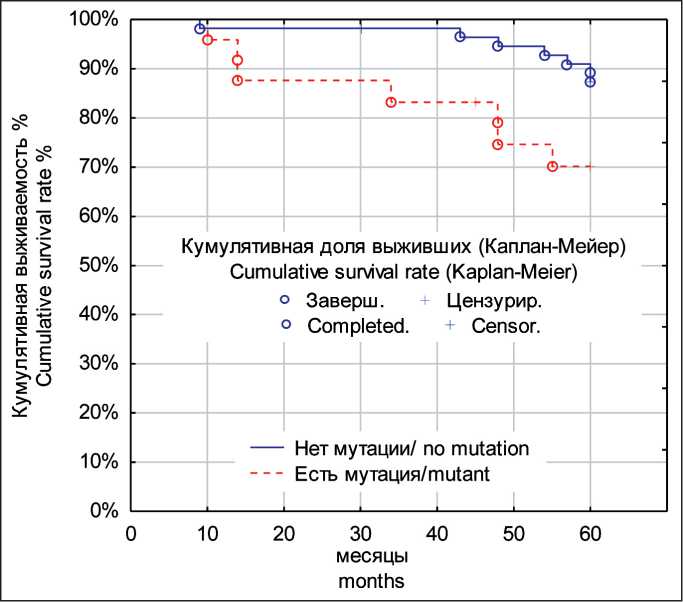
Рис. 2. 5-летняя безрецидивная выживаемость пациенток с люминальным РМЖ в зависимости от наличия в первичной опухоли мутации гена PIK3CA.
Примечание: рисунок выполнен авторами
Fig. 2. The 5-year relapse-free survival of patients with luminal breast cancer depending on the presence of a PIK3CA gene mutation in the primary tumor. Note: created by the authors
Кроме того, нами проведена оценка 5-летней безрецидивной выживаемости пациенток в зависимости от наличия мутации PIK3CA . Статистический анализ выявил достоверные различия между группами: log-rank test: χ2=2,72, p=0,03 (рис. 2). Полученные результаты свидетельствуют о влиянии мутации PIK3CA на прогноз заболевания, что может указывать на ее роль в формировании устойчивости к терапии и повышении риска рецидива.
Наши данные не выявили значимой зависимости 5-летней безрецидивной выживаемости от гиперэкспрессии циклина D1 (p>0,05), что позволяет предположить, что этот маркер не является прогностически значимым у пациенток, получающих ингибиторы ароматазы.
Обсуждение
Выявленная нами корреляция между экспрессией исследованных маркеров ROR1 и BMI-1 и частотой отдаленных метастазов при люминальном РМЖ, наиболее вероятно, может быть обусловлена функциями этих белков, определяющими их ключевую роль как в лимфогенном, так и в гематогенном распространении опухоли. Нам удалось показать, что белки ROR1 и BMI-1 ассоциированы с люминальным В молекулярным подтипом РМЖ. Интерес также представляет выявленная значимая связь между наличием гиперэкспрессии циклина D1 и наличием мутации гена PIK3CA, а также позитивной экспрессии
ROR1. В отличие от данных, полученных в исследованиях с использованием тамоксифена, в нашем исследовании гиперэкспрессия циклина D1 не была ассоциирована с достоверным снижением безрецидивной выживаемости у пациенток, получавших ингибиторы ароматазы. Это может свидетельствовать о различии в молекулярных механизмах эндокринной резистентности при различных режимах гормонотерапии. Дополнительно, наши данные подтверждают опубликованные результаты о том, что ко-экспрессия ROR1 и BMI-1 может усиливать процессы инвазии и миграции опухолевых клеток, тем самым способствуя прогрессированию заболевания. Проведенный анализ 5-летней безрецидивной выживаемости показал значимое снижение выживаемости пациенток с мутацией гена PIK3CA , что согласуется с данными о роли мутаций данного гена в развитии резистентности к эндокринной терапии. Это подчеркивает необходимость дальнейших исследований по уточнению прогностической значимости PIK3CA-ассоциированной активации сигнального пути PI3K/AKT/mTOR в люминальном РМЖ. Кроме того, выявленная нами связь между экспрессией BMI-1 и наличием прогрессирования заболевания может указывать на важную роль этого белка в поддержании стволовоподобных свойств опухолевых клеток и их устойчивости к терапии. В этом контексте перспективным направлением может быть изучение комбинированных стратегий, направленных на ингибирование BMI-1, в сочетании с традиционными методами лечения.
Заключение
Проведенное исследование подтверждает значимую роль белков ROR1 и BMI-1 в патогенезе люминального РМЖ. Установлена их ассоциация с люминальным В подтипом опухоли, что может объяснять более агрессивное течение заболевания у данной группы пациенток. Обнаруженная связь между гиперэкспрессией циклина D1 и мутацией гена PIK3CA дополнительно свидетельствует о комплексном взаимодействии различных сигнальных путей, влияющих на пролиферацию и резистентность опухолевых клеток. Выявленная связь между мутацией гена PIK3CA и сниженной 5-летней безрецидивной выживаемостью подчеркивает необходимость дальнейшего изучения возможности таргетной терапии, направленной на ингибирование PI3K/AKT/mTOR-сигнального пути. В этом аспекте особый интерес представляет комбинированное использование ингибиторов PI3K и гормональной терапии для улучшения клинических исходов у пациенток с люминальным РМЖ.


