Влияние экспрессии гена PgCDPK2ds1 на продукцию резвератрола в клеточных культурах винограда амурского ( Vitis amurensis Meyer)
Автор: Шумакова О.А., Киселв К.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Растениеводство
Статья в выпуске: 1, 2013 года.
Бесплатный доступ
Исследовано влияние вставки регуляторного гена кальциевой сигнальной системы гена кальций-зависимые протеинкиназы PgCDPK2ds1 из женьшеня Panax ginsens Meyer. на биосинтез резвератрола в культурах клеток винограда амурского ( Vitis amurensis Rupr). В полученных PgCDPK2ds1-трансгенных клеточных линиях винограда продукция резвератрола была в 1, 2-5, 8 раза выше, чем в контрольной культуре клеток винограда. Эти результаты впервые свидетельствуют о том, что кальций-зависимые протеинкиназы участвуют в регуляции биосинтеза резвератрола в клетках винограда.
Виноград амурский, кальций-зависимые протеинкиназы, резвератрол, культура клеток
Короткий адрес: https://sciup.org/14082689
IDR: 14082689 | УДК: 581.1
Текст научной статьи Влияние экспрессии гена PgCDPK2ds1 на продукцию резвератрола в клеточных культурах винограда амурского ( Vitis amurensis Meyer)
Введение. Виноград амурский ( Vitis amurensis Rupr.), произрастающий на территории Приморского края России, является источником стильбенов. Самый ценный и известный из них – это транс -резвератрол (3,5,4’-тригидроксистильбен). Резвератрол обладает широким спектром биологической активности, обладает превентивными свойствами против нескольких форм злокачественных образований – рака желудочнокишечного тракта [1, 2], рака кожи [3], предотвращает развитие рака молочной железы [4], также резвератрол препятствует инвазии и метастазированию [5]. Помимо этого резвератрол обладает антибактериальной [6] и противовирусной активностью [7, 8].
В настоящее время встает вопрос о получении резвератрола в промышленных масштабах, однако получение резвератрола из растительного сырья представляется экономически невыгодным, потому что содержание его крайне низкое. Для создания организмов, активно продуцирующих резвератрол, необходимо изучить молекулярные механизмы регуляции биосинтеза этого стильбена.
В настоящее время регуляторы биосинтеза стильбенов полностью не изучены, но установлено, что некоторые вторичные мессенджеры, особенно катионы Са2+, вовлечены в регуляцию биосинтеза стильбенов [9]. У растений сенсорами цитоплазматического кальция могут быть кальций-зависимые протеинкиназы (CDPK). Секвенирование геномов двух таксономически далеких видов Oryza sativa и Arabidopsis thaliana показало, что эти растения содержат 27 и 34 гена CDPK соответственно. Это может свидетельствовать о наличии разнообразных функций белков семейства CDPK. Например, недавно показано, что увеличение накопления фитоалексинов коррелирует с повышением активности CDPK [10]. Также известно, что в женьшене Panax ginsens Meyer. повышение экспрессии гена PgCDPK2d коррелирует с увеличением продукции гинзенозидов – биологически активных веществ «корня жизни» [11, 12]. Учитывая все вышесказанное, целью настоящей работы было изучить влияние экспрессии гена женьшеня PgCDPK2ds1 на продукцию резвератрола в культуре клеток винограда амурского.
Материалы и методы исследований
Растительный материал и клеточные культуры. В нашей работе для изучения влияния экспрессии гена PgCDPK2ds1 на продукцию резвератрола решили использовать для агробактериальной трансформации клеточную культуру V. amurensis V2 с содержанием резвератрола (0,001% от сухой массы). Каллусная культура V2 получена в 2002 году из молодого стебля взрослого дикорастущего растения V. amurensis Rupr. ( Vitaceae ), которое было собрано на Дальнем Востоке (юг Приморского края) и определено в отделе ботаники Биолого-почвенного института ДВО РАН [13].
Компоненты питательных сред. Для проведения экспериментов использовали агаризованную питательную среду W B/A [14] с добавлением 0,5 мг/л 6-бензиламинопурина (БАП) и 2 мг/л α-нафтилуксусной (АНУ) кислоты, которую разливали в пробирки 200*20 мм по 15 мл. Интервал субкультивирования составлял 35–40 дней в темноте при 24±1oС.
Определение содержания стильбенов в образцах ткани V. amurensis . Определение качественного и количественного содержания стильбенов производилось методом высокоэффективной жидкостной хроматографии (ВЭЖХ) в Горно-таежной станции ДВО РАН, куда были переданы образцы высушенной ткани векторной культуры клеток винограда КА-0 и PgCDPK2ds1 -трансгенных клеточных линий V. amurensis КА-01-I, КА-01-II и КА-01-III в соответствии с методикой, описанной ранее [13]. Количество резвератрола определяли путем сравнения со стандартом резвератрола (Sigma-Aldrich, Сент-Луис, США).
Получение последовательности гена PgCDPK2ds1 . Для получения нуклеотидной последовательности гена PgCDPK2ds1 экстрагировали тотальную РНК из клеточных культур женьшеня P. ginseng на 30–35 день культивирования при помощи метода с использованием LiCl, оптимизированного для работы с тканями растений, богатыми вторичными метаболитами [15]. кДНК получали, используя 1–3 мкг тотальной РНК (предварительно обработав ДНКазой, Fermentas, Вильнюс, Литва), с помощью набора для обратной транскрипции (Силекс M, г. Москва, Россия). Для проведения обратной транскрипции (ОТ) использовали 50 мкл реакционной смеси, содержащей 10х ОТ буфер, по 0,24 мM каждого из dNTP, 0,2 мкM олиго-(dT) 15 праймера, 200 единиц активности M-MLV-ревертазы. Реакцию проводили при 37°C в течение 1,5 ч.
Получение трансгенных клеток винограда V. amurensis, сверх экспрессирующих гены PgCDPK2ds1 . Для создания генетических конструкций для трансформации клеточной культуры винограда амурского амплифицировали с кДНК культуры клеток женьшеня амурского ген PgCDPK2ds1 (номер доступа в ГенБанк EU881984), используя пару праймеров 5'-ATG GGW AAY TGY TGY MG и 5'-CTA TTC AGT TTC TGC CC. Полученные ампликоны гена PgCDPK2ds1 были выделены из геля при помощи набора Glass Milk (Силекс, г. Москва, Россия) и клонированы в вектор pTZ57R/T согласно протоколу фирмы-производителя (Fermentas, Вильнюс, Литва). Затем, используя пару праймеров 5'-GCT AAG CTT ATG GGT ATT GTT GTC GCA CGT, содержащий в своей последовательности сайт рестрикции для рестриктазы Hind III, и 5'-AGC GGA TCC CTA TTC AGT TTC TGC CCA AAA TGG, содержащий сайт для рестриктазы BamH I, амплифицировали полную последовательность PgCDPK2ds1 . В качестве матрицы использовали предварительно полученную генетическую конструкцию pTZ57-PgCDPK2ds1. Полученный ПЦР продукт перенесли по рестрикционным сайтам Hind III и BamH I в вектор pSAT1 [16]. В этой конструкции ген PgCDPK2ds1 находился под контролем двойного 35S промотора вируса мозаики цветной капусты (35S CaMV). После перенесли кассету, содержащую PgCDPK2ds1 , из pSAT1 в вектор pZP-RCS2-nptII [16], используя сайт для рестрикции рестриктазы PalA I. Далее генетическая конструкция pZP-RCS2- PgCDPK2ds1 была перенесена в агробактерии A. tumefaciens GV3101. Рестриктазы, используемые в данном исследовании, были заказаны из СибЭнзим, г. Новосибирск, Россия, полимераза и реактивы для ПЦР из Силекс (Москва, Россия).
Суспензионную культуру клеток винограда V. amurensis V2 трансформировали полученным штаммом агробактерий по методике, описанной ранее [13]. После трансформации каллусы культивировали в течение трех месяцев в присутствии 250 мг/л цефотаксима для подавления роста агробактерий. Отбор трансгенных клеток проводили при помощи селекции на канамицине (15–20 мг/л) в течение 5 месяцев.
Проверка трансгенности полученных клеточных линий винограда. Трансгенность полученных линий была доказана по наличию вставки гена nptII с помощью праймеров 5'-GAG GCT ATT CGG CTA TGA CTG; 5'-ATC GGG AGC GGC GAT ACC GTA по условиям, описанным ранее [13]. Отсутствие сигнала после ПЦР на ген virB2 служило доказательством того, что агробактерий не было в анализируемых пробах. ПЦР на ген virB2 проводили с использованием праймеров 5'-AAT GCG CGT GAT ATC GAG CTG CG; 5'-ATA CTA CCG CCA GTG AGC GTT TGG.
Статистический анализ. Статистическую обработку результатов проводили при помощи программы Statistica, версия 10.0. Все данные представлены как среднее значение ± стандартная ошибка. Полученные данные проверены по спаренному критерию Стьюдента. Уровень значимости в 0,05 был выбран как минимальное значение статистической разницы во всех экспериментах.
Результаты и их обсуждение. Для изучения функций PgCDPK2ds1 в растении были получены векторная культура клеток винограда КА-0, несущая только ген устойчивости к канамицину, и три клеточные линии клеток винограда (KA-01-I, KA-01-II и KA-01-III), экспрессирующие ген PgCDPK2ds1 . Было показано, что культура клеток КА-0 и клеточные линии KA-01-I, KA-01-II и KA-01-III несут ген устойчивости к канамицину nptII , что свидетельствует о факте вставки генетической конструкции, содержащей ген PgCDPK2ds1 в клетки винограда амурского. Кроме того, отсутствие сигнала на ген virB2 говорит о том, что в образцах нет примеси клеток агробактерий, и полученный сигнал на nptII идет именно с ДНК винограда.
Трансгенные клеточные линии, сверхэкспрессирующие PgCDPK2ds1, имели светлый серо-зеленый цвет, в то время как векторная культура КА-0, сверхэкспрессирующая ген устойчивости к канамицину, имела желто-зеленую окраску, характерную для нетрансформированной культуры клеток винограда. Прирост сырой биомассы векторной и PgCDPK2ds1- трансгенных клеточных линий винограда был сходен: наблюдалось достоверное ингибирование при культивировании на питательных средах, содержащих только АНУ или не содержащих фитогормоны (рис.). Однако стоит отметить, что прирост сырой биомассы клеточной линии КA-01-III на средах, содержащих только БАП, был достоверно в 1,3 раза выше, чем при культивировании данной линии на средах, содержащих БАП и АНУ (рис.).
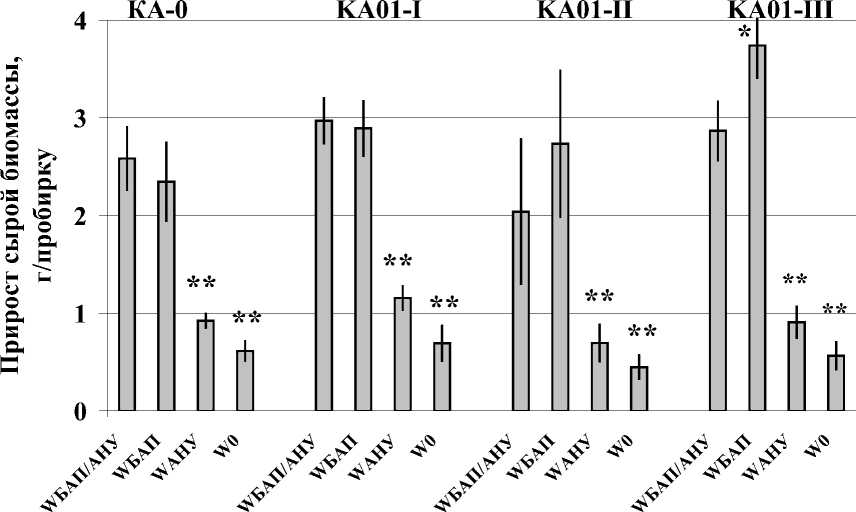
Прирост сырой биомассы культур клеток винограда КА-0, KA-01-I, KA-01-II и KA-01-III:
W бап / ану - прирост клеток винограДа на питательных среДах, содержащих фитогормоны БАП и АНУ; W БАП – с добавлением в питательные среды 0,5 мг/л БАП; W АНУ – с добавлением 2 мг/л АНУ;
W 0 – питательные среды без фитогормонов. * P < 0,05, ** P < 0,01 от значений в культуре клеток КА-0
Далее с помощью ВЭЖХ было определено содержание резвератрола во всех культурах клеток, используемых в работе: KA0-1, KA-01-I, KA-01-II и KA-01-III. Содержание резвератрола во всех трех PgCDPK2ds1- трансгенных клеточных линиях было выше, чем в векторной культуре KA-0. Наивысшее содержание резвератрола было в клеточной линии КA-01-II: 0,052 ±0,005 % от сухого веса ткани, что в 5,8 раза достоверно выше, чем в векторной культуре KA-0 (табл.). Содержание резвератрола в двух других PgCDPK2ds1- трансгенных культурах винограда KA-01-I и KA-01-III была в 1,2 – 1,8 раза выше, чем в векторной культуре KA-0 (см. табл.).
Содержание резвератрола в культуре клеток КА-0 и в клеточных линиях KA-01-I, KA-01-II и KA-01-III
|
Клеточная линия |
Состав питательной среды |
|||
|
W БАП/АНУ |
W БАП |
W АНУ |
W 0 |
|
|
КА-0 |
0,009 ±0,001 |
0,008 ±0,002 |
0,007 ±0,001 |
0,003 ±0,001 |
|
КА-01-I |
0,016 ±0,002* |
0,014 ±0,005 |
0,005 ±0,002 |
0,006 ±0,002 |
|
КА-01-II |
0,052 ±0,005** |
0,040 ±0,003* |
0,023 ±0,010* |
0,012 ±0,007 |
|
КА-01-Ш |
0,011 ±0,002 |
0,022 ±0,009 |
0,007 ±0,001 |
0,003 ±0,001 |


