Влияние экстремальных значений pН на морфологические особенности дрожжей Saccharomyces cerevisiae
Автор: Исламмагомедова Эльвира Ахмедовна, Халилова Эсланда Абдурахмановна, Котенко Светлана Цалистиновна, Гасанов Расул Закирович, Аливердиева Динара Алиевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 5-2 т.20, 2018 года.
Бесплатный доступ
Изучено влияние экстремальных условий на физиологическое состояние клеток дрожжей Saccharomyces. В работе использовались штамм S. cerevisiae Y-503, гетерозиготный тетраплоид, полученный методом селекции в результате лазерного воздействия на смешанную культуру клеток промышленных штаммов, и S. cerevisiae DAW-3a - гетероталличный гаплоид, потомок линии штамма Y-503. Показано, что функциональное состояние дрожжей тесно связано с их морфологическими параметрами. В условиях рН - стресса происходят изменения формы и размеров клеток Y-503 и DAW-3a, обнаружено наличие зернистой цитоплазмы, крупные вакуоли в отдельных клетках. Обнаружено, что экстремальные условия влияют на морфологические особенности гигантских колоний. Оптимальным для роста колоний исследуемых дрожжей является рН 4.5, при этом клетки Y-503 и DAW-3a были достаточно устойчивы к экстремально высоким (11.0) и низким (3.0) рН. В условиях экстремальных концентраций NaCl и pH клетки приобретали округлую форму, для гигантских колоний было характерно уменьшение размеров, изменение поверхности, профиля и структуры. Показано, что исследуемые штаммы S. cerevisiae по-разному реагируют на вариации концентраций соли и значений рН. Возможно, это объясняется различной плоидностью Y-503 и DAW-3a. Показана способность S. cerevisiae Y-503 и S. cerevisiae DAW-3a к росту в неблагоприятных условиях, что делает эти штаммы дрожжей перспективными для использования в различных биотехнологиях.
Дрожжи saccharomyces, морфология, клетки, гигантские колонии, экстремальные условия, стресс
Короткий адрес: https://sciup.org/148314057
IDR: 148314057 | УДК: 663.125/663.252.4
Текст научной статьи Влияние экстремальных значений pН на морфологические особенности дрожжей Saccharomyces cerevisiae
центрациями солей, микроорганизмы располагают комплексом адаптационных механизмов. Так, уравновешивание внешнего осмотического давления происходит либо за счет накопления или синтеза цитоплазматических осморегуляторов, либо в результате накопления заряженных ионов из окружающей среды [5]. В биотехнологических процессах жизнеспособность штаммов дрожжей, устойчивых к экстремальным условиям, может быть повышена в результате предварительного воздействия небольших доз стрессоров [6].
Известно, что при выращивании дрожжей на средах с высоким рН и содержанием NaCl клетки становятся более округлыми; происходит стабилизация липидного состава митохондриальных мембран, накопление ионов натрия, свободных жирных кислот и аминокислот, что дает возможность клетке нейтрализовать повышенное содержание соли в среде культивирования [7]. В ответ на стресс при низких значениях pH происходит изменение клеточного метаболизма дрожжей S. cerevisiae: перегруппировка липидов и уменьшение фосфатидилхолина, одного из основных компонентов клеточной мембраны; перераспределение углеводов в клеточной стенке; значительное изменение белков агрегации, ответственных за снижение темпов ро- ста клеток [8]. Одним из механизмов адаптации некоторых культур микроорганизмов, существующих в природе при низких рН, являются происходящие изменения в последовательности нуклеотидов в хромосомной ДНК [9, 10]. В щелочной среде культивирования происходит увеличение содержания белков митохондрий относительно белков цитоплазмы [11], проявляется способность ферментов функционировать при высоких значениях рН. Так, оптимумы рН большинства ферментов галоалкалофильных микроорганизмов находятся в области щелочных значений.
Независимо от вида воздействия, в экстремальных условиях происходят индукция стресс – белков, накопление полифосфатных и появление липидных гранул, появление в составе липидов жирных кислот с длинной цепью, однотипные изменения ультраструктуры клеток дрожжей - увеличение размеров митохондрий, повышение численности и размеров пероксисом [9, 12].
Дрожжи обладают высокой адаптивной способностью, обеспечивающей их существование в экстремальных условиях среды. В этом плане представляет интерес изучение физиологического состояния клеток дрожжей в условиях стресса. Целью работы является исследование влияния различных значений рН на морфологические особенности Saccharomyces cerevisiae.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследований являлись штаммы S. cerevisiae Y-503 и S. cerevisiae DAW-3a из коллекций лаборатории биохимии и биотехнологии ПИБР ДНЦ РАН и Всероссийской коллекции промышленных микроорганизмов ФГУП Гос-НИИГенетика. Штамм S. cerevisiae Y-503 получен в результате лазерного воздействия на промышленный штамм S. cerevisiae 73 в Прикаспийском институте биологических ресурсов ДНЦ РАН [13]. Штамм Y-503 является гетерозиготным те-траплоидом, штамм DAW-3а – гетероталличным гаплоидом, потомком линии штамма Y-503 [14]. Принадлежность штаммов S. cerevisiae Y-503 и S. cerevisiae DAW-3а к таксону S. cerevisiae была подтверждена с помощью молекулярно-генетических методов [14].
Штаммы дрожжей выращивались на твердой стандартной среде YPD: дрожжевой экстракт – 0.5 % (BD, США), пептон – 0.5 % (BD, США), глюкоза (D-глюкоза) – 2.0 % (Merk, Германия), агар-агар – 2.5 % (Difco, Нидерланды) на чашках Петри в течение двадцати суток при температуре 30оС при значениях рН: 3.0, 4.5, 7.0, 9.0, 11.0. Кислотность среды корректировалась 1N HCl или 4М KOH (Россия). Для приготовления агаризованной среды с рН 3.0 растворы YPD и агар-агара автоклавировались отдельно, а затем стерильно объединялись [15].
В работе использовались приборы: ламинарный бокс ВЛ-12 1000 (Россия), сушильный шкаф SNOL 67/350 (Utenos, Литва), микроскоп C Х21 ( Olympus, Япония), pH - метр Анион 4100 (Анион, Россия); весы аналитические DV215CD (Ohaus Discovery, Швейцария).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Показано, что в условиях рН – стресса происходят морфологические изменения клеток и гигантских колоний штаммов S. cerevisiae Y-503 и S. cerevisiae DAW-3a. Морфологические параметры клеток дрожжей тесно связаны с их функциональным состоянием. Обнаружено наличие зернистой цитоплазмы, подтверждающей присутствие запасных питательных веществ; 15 % клеток содержало крупную вакуоль. Проведенный морфометрический анализ исследованных штаммов показал, что изменение рН среды отразилось на форме и размерах клеток (рис. 1). Обнаружено, что при культивировании на твердых средах для клеток штамма Y-503 характерно появление R – форм, в отличие от штамма DAW-3a. При выращивании дрожжей на средах с низким содержанием pH 3.0 количество клеток R – формы составляло почти 50 %, и по мере увеличения рН количество таких клеток уменьшалось. В щелочной среде культивирования (pH 11.0) клетки R – формы полностью отсутствовали. Во всех вариантах форма клеток Y-503 в основном овальная, но имелись и округлые клетки небольшого размера. Клетки DAW-3a были более однородны и имели в основном округлую форму. Можно сделать вывод, что значение рН 4.5 среды являлось оптимальным для роста обоих штаммов дрожжей.
При культивировании на средах с низким значением pH 3.0 наблюдалось уменьшение размеров клеток дрожжей, особенно штамма DAW-3a. В щелочных условиях обнаружено разнообразие клеток Y-503, однородность и небольшое уменьшение размеров DAW-3a (таблица).
Одним из параметров, по которому оценивали действие рН на физиологические особенности штаммов Y-503 и DAW-3a, была морфология гигантских колоний. Нами исследованы двадцатисуточные культуры, выращенные в чашках Петри при 30ºС на плотной питательной среде при pH 3.0,4.5, 7.0, 9.0 и 11.0. Обнаружено, что происходящие в экстремальных условиях трансформации в биохимических процессах и скорости клеточного деления дрожжей оказывают влияние и на морфологические особенности колоний.
Морфологические исследования показали незначительное изменение формы (округлая,
Таблица. Изменение формы и размеров (мкм) клеток S. cerevisiae Y-503 и S. cerevisiae DAW-3a при выращивании на питательной среде с различными значениями рН
|
з начения pH Штаммы\ |
pH 3.0 |
pH 4.5 |
pH 7.0 |
pH 9.0 |
pH 11.0 |
|
S. cerevisiae Y-503 |
Форма : R-; овальная; округлая Размеры: 4x15; 8x10; 6x7; 3x3;2x3 |
Форма : R-; овальная; округлая Размеры : 4x15; 8x9; 7x8;5x6; 3x3 |
Форма: овальная; R- Размеры: 4x15;4x10; 4x9;8x9;6x7; 5x6;3x3 |
Форма: овальная; R- Размеры: 8x8; 6x8; 4x9;4x6 |
Форма: овальная Размеры: 7x9; 5x6;4x6; 2x3 |
|
S. cerevisiae DAW-3a |
Форма : округлая Размеры: 10x12;6x7; 5x6; 3x3; 2x3 |
Форма : округлая; овальная Размеры: 10x12; 7x8; 5x6; 3x3 |
Форма : округлая Размеры: 8x9; 6x7;5x6; 3x3 |
Форма : округлая; овальная Размеры: 7x9; 8x8:6x7;5x6 |
Форма : округлая Размеры: 6x7; 5x5; 4x5;2x3 |
|
^N^k v XTVI ’ ‘ W00 ^ ^ '■§№ "(Ik • . ^ |
е"СГ='- |
° ОО - - Оо 0 °о О |
О 4 О о°о |
У= о |
|
tiSgTSStcsS^^fvi l^ aVz'V;- I'^yVCwJL ^^^^^^^^ W> . ° ' гО$ч& ^Жг |
«О ° |
оО . О—0--^9 |
0 ОА |
0 0 $ 0 п |
a)
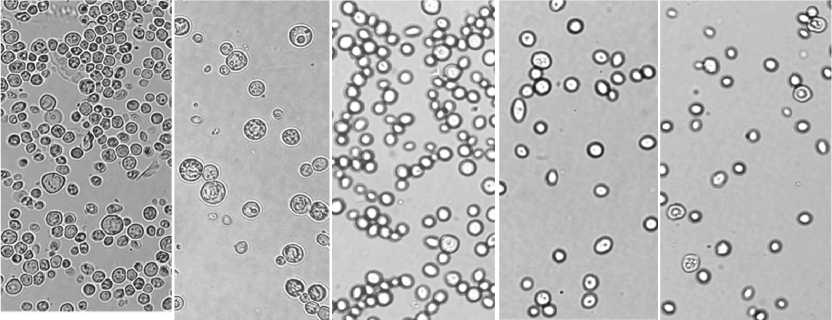
рНЗ pH 4.5 pH 7.0 p H 9.0 pH 11.0
Рис. 1. Влияние различных значений рН на морфологию клеток S. cerevisiae Y-503 (а) и S. cerevisiae DAW-3a (б)
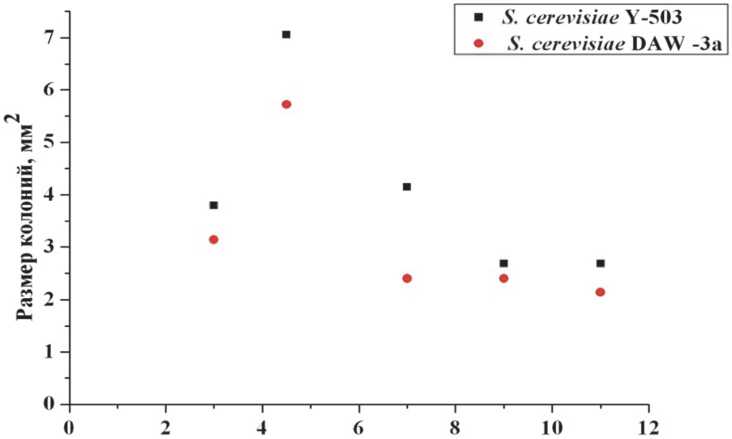
в виде цветка), поверхности (радиально исчерченная), профиля (плоский, со слегка выпуклым центром), цвета (бежевый с сероватым оттенком) и структуры (пастообразная, мажущаяся) макроколоний. Установлено, что в процессе роста оба штамма проявили достаточную устойчивость к экстремальным значениям pH. При этом выявлено существенное изменение размеров гигантских колоний Y-503 и DAW-3a в зависимости от pH среды (рис. 2).
Обнаружено, что значение рН 4.5 являлось оптимальным для роста колоний обоих штаммов дрожжей. Дрожжевые клетки достаточно устойчивы к значительным изменениям рН окружающей среды. Однако внутриклеточные процессы обладают высокой чувствительностью к рН, постоянная величина которой поддерживается с помощью эффективных буферных систем. По сравнению с оптимальными значениями повышение или уменьшение рН среды культивирования сначала снижает, а затем приостанавливает рост дрожжевых клеток.
При выращивании дрожжей на средах с экстремально низким значением pH 3.0 размер колоний по сравнению с оптимальным рН уменьшался почти в 1.9 (Y-503) и 1.8 раза (DAW-3a).
Установлено, что при культивировании дрожжей на средах с pH 7.0 размер колоний по сравнению с рН 4.5 уменьшился в 1.7 (Y-503) и 2.4 раза (DAW-3A). Среда с нейтральным значением рН для исследуемых штаммов не являлась оптимальной, однако существенного ингибирования роста дрожжей не наблюдалось.
В щелочных условиях (pH 9.0 и 11.0) нами так- же обнаружена способность дрожжевых клеток к адаптации. При этом установлено уменьшение размеров гигантских колоний при выращивании на средах с экстремально высокими рН в 2.6 раз (Y-503) и в 2.4 – 2.7 раза (DAW-3a) соответственно по сравнению с оптимальным рН.
Проведенный нами анализ морфологических особенностей гигантских колоний и клеток Y-503 и DAW-3a в зависимости от экстремальных значений рН среды показал, что изученные дрожжи обладают способностью активно развиваться в неблагоприятных условиях: на средах с экстремально высокими (11.0) и низкими (3.0) рН, что делает эти штаммы перспективными для использования в биотехнологии производства спирта, целлюлозы, осмотически активных веществ, биополимеров, ферментов.
Обнаружено, что морфологические особенности исследуемых дрожжей зависят не только от условий культивирования, но и от свойств различных штаммов. Как было сказано выше, при критических значениях рН клетки штамма DAW-3a были более однородны и имели в основном округлую форму. Гигантские колонии также имели отличия, в том числе размеры колоний Y-503 были несколько больше по сравнению с другим вариантом (рис. 3). Возможно, это объясняется различной плоидностью штаммов Y-503 и DAW-3a. Известно, что одним из механизмов адаптации дрожжей является полиплоидия [16], часто приводящая к диверсификации генетической информации [17] и обеспечивающая преимущество определенного фенотипа в условиях стресса [18].

a )

pH 3.0 p H 4.5 pH 7 . 0 pH 9.0 pH 11.0
Рис. 2. Влияние различных значений рН на морфологию гигантских колоний S. cerevisiae Y-503
pH среды
Рис. 3. Динамика изменения размеров гигантских колоний дрожжей Saccharomyces в зависимости от экстремальных значений рН

pH 9.0
pH 9.0 + N aCl
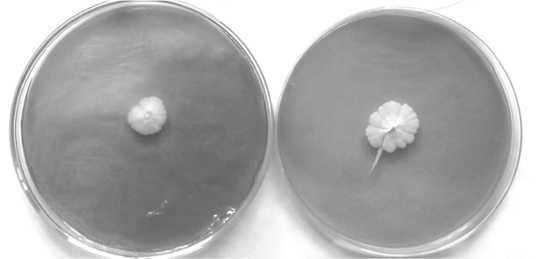
Рис. 4. Особенности роста клеток (а) и гигантских колоний (б) S. cerevisiae Y-503 на средах при рН 9.0 в присутствии и отсутствии 5% NaCl
В целях исследования адаптации дрожжей в условиях многофакторного влияния окружающей среды были изучены морфологические показатели дрожжей Y-503 при культивировании на средах с экстремальными значениями NaCl и pH (рис. 4). Показано, что, в отличие от колоний, культивируемых при рН 9.0, гигантские колонии, выращенные на средах с содержанием NaCl 5% при pH 9.0, характеризуются уменьшением размеров (более чем в 2 раза), изменением по- верхности (радиально исчерченная, с каймой) и профиля (более выпуклый), уплотнением структуры. Клетки приобретали более округлую форму, что находит подтверждение в литературе [7].
Таким образом, экстремальные значения рН существенно влияют на морфофизиологические и культуральные свойства дрожжей Saccharomyces. Показаны морфологические изменения клеток и гигантских колоний штаммов Y-503 и DAW-3a в условиях рН – стресса. Оптимальным для роста дрожжей является рН 4.5, при этом клетки исследованных штаммов были достаточно устойчивы к экстремальным значениям рН 3.0 и рН 11.0. Представленные результаты выполнены в рамках исследований по адаптации микроорганизмов к стрессу и могут быть полезны для решения практических задач, связанных с разработкой биотехнологий, основанных на использовании устойчивых к экстремальным условиям штаммов дрожжей.
Список литературы Влияние экстремальных значений pН на морфологические особенности дрожжей Saccharomyces cerevisiae
- Caspeta L., Nielsen J. Thermotolerant yeast strains adapted by Laboratory evolution show trade-off at ancestral temperatures and preadaptation to other stresses // MBio. 2015. 6(4): 431-446. DOI: 10.1128/mBio.00431-15
- Аливердиева Д.A. Мамаев Д.В., Лагутина Л.С., Шольц К.Ф. Ocобенности изменения содержания субстратов эндогенного дыхания в клетках Saccharomyces cerevisiae при низкой температуре // Биохимия. 2006. 71(1): 50-58. DOI: 10.1134/S0006297906010056
- Borrull A., Lopez-Martínez G., Miro-Abella E., Salvado Z., Poblet M., Cordero-Otero R., Rozes N. New insights into the physiological state of Saccharomyces cerevisiae during ethanol acclimation for producing sparkling wines // Food Microbiology. 2016. 54: 20 - 29.
- Zhao X.Q., Bai F.W. Mechanisms of yeast stress tolerance and its manipulation for efficient fuel ethanol production. Biotechnology. 2009. 144(1): 23-30. DOI: 10.1016/j.jbiotec
- Деткова Е.Н., Болтянская Ю.В. Осмоадаптация галоалкалофильных бактерий: роль осморегуляторов и возможности их практического применения // Микробиология. 2007. 76(5): 581-593. DOI: 10.1134/S0026261707050013


