Влияние электроактивированных водных растворов на морфофункциональные показатели поджелудочной железы и почек крыс с экспериментальной моделью сахарного диабета
Автор: Гайдарова Анна Павловна, Хорина Юлия Александровна, Корощенко Галина Анатольевна, Серкина Оксана Александровна, Хачатрян Ашот Папикович, Ларионов Петр Михайлович, Айзман Роман Иделевич
Журнал: Science for Education Today @sciforedu
Рубрика: Биологические, химические, медицинские науки
Статья в выпуске: 4 (8), 2012 года.
Бесплатный доступ
В статье анализируется влияние электроактивированных водных растворов на морфофункциональные показатели поджелудочной железы и почек крыс с экспериментальной моделью сахарного диабета. Отмечается положительное влияние анолита на концентрацию глюкозы в плазме, морфофункциональные показатели поджелудочной железы и почек крыс с исследуемой патологией. Подчеркивается необходимость дальнейшего исследования биохимических процессов, определяющих гипогликемический эффект анолита.
Электроактивация, католит, анолит, водно-солевой обмен, сахарный диабет, почка, поджелудочная железа, крыса
Короткий адрес: https://sciup.org/147137409
IDR: 147137409 | УДК: 591.133
Текст научной статьи Влияние электроактивированных водных растворов на морфофункциональные показатели поджелудочной железы и почек крыс с экспериментальной моделью сахарного диабета
Электроактивация – сравнительно новая отрасль в медицине, открывающая широкие возможности применения водных растворов, обработанных электрическим током, в качестве лекарственных средств в эксперименте и в клинике [1, с. 88–91; 3, с. 54;
4, с. 26; 6, с. 23–25]. Электрохимически активные водные растворы (ЭВР) образуются при определенном режиме электрического воздействия в анодной или катодной камерах диафрагменных электротехнических установок [2, с. 36–107].
Серкина Оксана Александровна – старший лаборант кафедры анатомии, физиологии и безопасности жизнедеятельности ИЕСЭН, Новосибирский государственный педагогический университет.
Хачатрян Ашот Папикович – доктор медицинских наук, профессор кафедры анатомии, физиологии и безопасности жизнедеятельности ИЕСЭН, Новосибирский государственный педагогический университет Ларионов Петр Михайлович – доктор медицинских наук, профессор кафедры фундаментальной медицины, Новосибирский государственный университет.
Все права защищены

4(8) 2012 ISSN 2226-3365
При пропускании электрического постоянного тока через водный раствор в нем происходит электроактивация молекул, атомов, ионов и перераспределение ионов в электрическом поле [5, с. 93]. В результате вода, находящаяся в катодной зоне (ЭВР-К), приобретает восстановительные свойства и запасает потенциальную энергию. Католит обладает высокой биологической активностью, поскольку повышает интенсивность биохимических процессов, постоянно протекающих в живой клетке. Он обладает противовоспалительными и общетонизирующими свойствами, нормализует энергетический потенциал клеток и повышает интенсивность и эффективность тканевого дыхания. Анолит (ЭВР-А) обладает анальгезирующим, антиаллергическим, противовоспалительными свойствами, а также мощным антисептическим действием (противогрибковым, антивирусным и антибактериальным), что объясняется высокими окислительными свойствами раствора и содержанием химических соединений, выделяющих хлор, кислород и озон [2, с. 36–107; 3, с. 54; 4, с. 26; 6, с. 23–25].
В этой связи представлялось интересным изучить механизм влияния вышеперечисленных электрохимически активных водных растворов на организм при развитии сахарного диабета, как одной из наиболее распространенных и социально значимых патологий человека.
Методика . С этой целью был проведен эксперимент на взрослых крысах линии Wistar массой 200–250 г. Все животные были поделены на 2 группы – контрольную и экспериментальную, каждая из которых, в свою очередь, была разделена на три подгруппы: животные, получающие воду, раствор католита (ЭВР-К) или анолита (ЭВР-А) (рис.1).
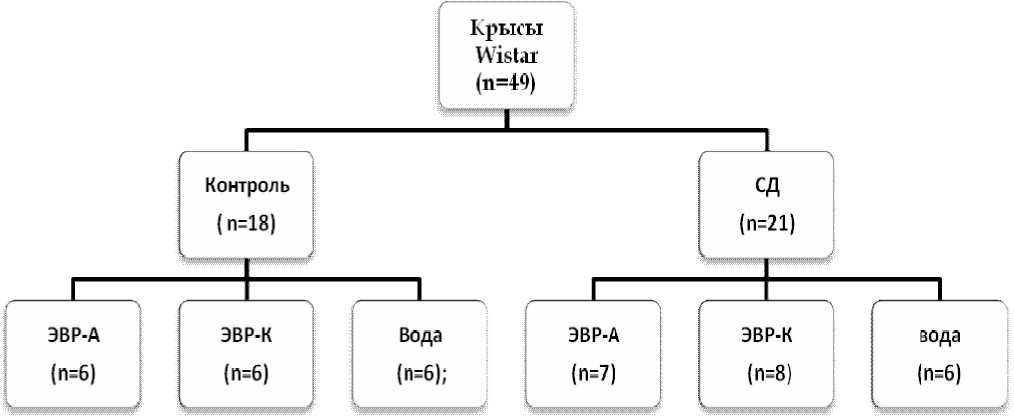
Рис. 1.
Распределение животных по группам наблюдения.
Для моделирования сахарного диабета животным подкожно вводили 10 % раствор аллоксана из расчета 0,1мл/100г массы тела.
На 1, 3 и 6 сутки эксперимента у животных
Все права защищены

4(8) 2012
ISSN 2226-3365
брали пробы крови путем надсечки хвоста для определения уровня глюкозы. На 6 сутки животных высаживали в обменные клетки для сбора мочи. В конце эксперимента у всех животных из нижней полой вены брали пробы крови для последующего определения ионноосмотических показателей, а также образцы тканей поджелудочной железы и почки.
Концентрацию глюкозы в плазме крови и моче определяли пикриновым методом на спектрофотоколориметре «Spekol» при длине волны 560 нм.
Концентрацию ионов натрия и калия в моче, плазме крови определяли методом пламенной фотометрии с использованием фотометра «BMW Technologies», производства США.
Для определения осмотической концентрации мочи и плазмы крови использовали метод криоскопии. Измерения выполняли на миллиосмометре «OSMOMAT», производство Германия в диапазоне от 300 до 2000 мосм/л.
Парциальные функции почек (табл.1) рассчитывали по общепринятым формулам [7, с. 293].
Для светооптического исследования образцы поджелудочной железы и почек фиксировали в 10 % растворе нейтрального формалина, обезвоживали в серии спиртов возрастающей концентрации и заключали в парафин. Срезы толщиной 5-6 микрон, окрашивали гематоксилином Майера, эозином, альциановым синим и заключали в канадский бальзам.
Таблица 1
Расчет парциальных функций почек
М- масса тела (г),
U cr и P cr – концентрация креатинина в моче и плазме (мг%);
U NA иP NA – концентрация натрия в моче и плазме (ммоль/л);
U K и P k – концентрация калия в моче и плазме (ммоль/л);
U osm и P osm – концентрация осмотически активных веществ в моче и плазме (мосмоль/л).

4(8) 2012
ISSN 2226-3365
Статистический анализ результатов исследования проводили на основе определения среднеарифметических (М) и их ошибок (±m). Различие показателей оценивали методами вариационной статистики по t-критерию Стьюдента и критерию ANOVA (для непараметрических данных) и считали достоверными при p≤0,05. Расчеты производили по общепринятым формулам с использованием стандартных программ пакета Microsoft Office (Statistica-6.0).
Все животные находились в стандартных условиях вивария при свободном доступе к воде или соответствующему раствору и пище.
Результаты. На первом этапе исследования был проведен анализ концентрации глюкозы в плазме крови крыс в динамике развития экспериментального сахарного диабета (табл.2).
Таблица 2
Концентрация глюкозы в плазме крови крыс (M±m), ммоль/л
|
Время эксперимента, сутки |
Контроль (интактные) |
СД |
||||
|
вода |
ЭВР-А |
ЭВР-К |
вода |
ЭВР-А |
ЭВР-К |
|
|
1 |
6,7±0,39 |
6,5±0,35 |
6,6±0,18 |
14,7±3,4* |
7,06±1,15 ▲ Δ |
23,06±4,03* |
|
3 |
18,1±4,0* |
9,3±1,4 ▲ Δ |
23,18±5,01* |
|||
|
6 |
16,1±5,3 |
11,2±3,2 |
12,05±2,8 |
|||
Примечание (здесь и далее):
* - достоверные отличия от аналогичных показателей контроля (р ≤0,05 ) ;
Δ – достоверные отличия между экспериментальными группами (католит, анолит) (р ≤0,05);
▲ - достоверные отличия по сравнению с группой «вода» (р ≤0,05 )
Из данных таблицы 2 видно, что у здоровых животных католит и анолит не вызывали изменения уровня глюкозы в крови на протяжении всего периода наблюдения. У животных экспериментальной группы уже на первые сутки после инъекции аллоксана уровень глюкозы был достоверно выше аналогичных показателей контроля, что свидетельствовало о развитии сахарного диабета. Только в группе «ЭВР-А» этот показатель был достоверно ниже показателей остальных групп и достоверно не отличался от контроля. Подобная ситуация сохранилась на 3 сутки эксперимента. На 6 сутки наблюдения уровень глюкозы у всех экспериментальных животных достоверно не различался между группами и был в 2 раза выше интактных животных.
Таким образом, можно заключить, что у здоровых животных электрохимически активные водные растворы не вызывали изменений уровня глюкозы в крови, тогда как на фоне сахарного диабета ЭВР-А оказывал выраженный гипогликемический эффект, вызывая задержку развития сахарного диабета, тогда как ЭВР-К не проявлял протективного сахаропонижающего эффекта.
При анализе ионно-осмотических показателей плазмы крови и мочи крыс было выявлено, что у интактных животных различные водные растворы не вызывали существенных изменений концентрации ионов и показателей функций почек, кроме
Все права защищены

4(8) 2012
ISSN 2226-3365
снижения мочевины в плазме крови после приема ЭВР-А. На фоне сахарного диабета концентрация натрия и калия не изменялись, а содержание мочевины имело тенденцию к повышению, и уровень креатинина был достоверно выше аналогичных показателей здоровых животных. Полученные изменения могут свидетельствовать о нарушении функционального состояния почек и развитии почечной недостаточности в условиях СД. При этом существенных отличий среди животных, принимавших разные электрохимически активированные водные растворы, не обнаружено, за исключением некоторого увеличения концентрации креатинина и гипокалиемии после приема ЭВР-К (табл. 3).
Таблица 3
Ионно-осмотические показатели плазмы крови крыс (M±m)
|
Концентрация, ммоль/л |
контроль |
СД |
||||
|
вода |
ЭВР-А |
ЭВР-К |
вода |
ЭВР-А |
ЭВР-К |
|
|
натрия |
139,4±13,5 |
138,3±12,1 |
129,7±13,0 |
148,0±23,7 |
124,0±8,6 |
131,0±34,1 |
|
калия |
4,1±0,2 |
3,9±0,2 |
4,0±0,3 |
3,8±0,2 |
3,6±0,3 |
3,0±0,3*▲ |
|
креатинина |
1,14±0,04 |
1,1±0,05 |
1,09±0,02 |
1,4±0,03* |
1,4±0,04* |
1,5±0,01*▲ Δ |
|
мочевины |
54,0±4,9 |
33,8±5,6▲ Δ |
49,8±4,8 |
60,0±7,7 |
64,8±7,2* |
63,6±8,7 |
Примечание: см. таблицу 2
Изучение гидро- и ионоуретической функций почек позволило выявить увеличение уровня диуреза на фоне сахарного диабета в группах животных, принимавших как анолит, так и католит (табл. 3). Скорость клубочковой фильтрации и уровень канальцевой реабсорбции не отличались между группами СД и контроля. Параллельно возрастала экскретируемая фракция калия, что, вероятнее всего, отражало увеличение секреции катиона. Указанные факты свидетельствуют в пользу усиления экскреции осмотически активных веществ (например, глюкозы) под влиянием ЭВР в условиях СД, в результате чего повышалась скорость мочеотделения и очищение калия.
Поскольку функциональные изменения органа обусловлены изменением его морфологической структуры, на следующем этапе нашего исследования был проведен анализ морфологической структуры поджелудочной железы и почек животных.
Таблица 4
Гидро- и ионоуретическая функции почек крыс (M±m)
|
Показатель |
контроль |
СД |
||||
|
вода |
ЭВР-А |
ЭВР-К |
вода |
ЭВР-А |
ЭВР-К |
|
|
V, мл/100г*час |
0,05±0,02 |
0,03±0,01 |
0,04±0,01 |
0,06±0,01 |
0,11±0,02*▲ |
0,11±0,03* |
|
СКФ, мл/100г*час |
13,7±3,4 |
20,6±2,12 |
12,2±2,5 Δ |
10,4±2,0 |
15,2±3,7 |
12,2±4,9 |
Все права защищены

4(8) 2012
ISSN 2226-3365
|
R H 2 O, % |
99,6±0,1 |
99,7±0,03 |
99,6±0,09 |
99,6±0,04 |
99,7±0,1 |
99,0±0,6 |
|
U Na *V, мкмоль/100г*ч ас |
4,0±1,5 |
13,7±0,6▲ Δ |
7,0±2,8 |
4,3±1,6 |
6,8±2,4* |
16,5±5,5 Δ |
|
U K *V, мкмоль/100г*ч ас |
15,6±6,4 |
12,0±1,5 |
8,9±3,1 |
17,1±8,6 |
16,6±1,07 |
17,1±6,7 |
|
EF Na , % |
0,2±0,1 |
0,4±0,05 |
0,4±0,2 |
0,3±0,09 |
0,3±0,10 |
2,11±0,97 |
|
EF K , % |
22,8±10,2 |
15,03±3,3 |
13,06±2,8 |
54,2±6,2 |
40,6±2,2* |
58,5±11,8* |
Примечание: см. таблицу 2
Анализ структурной организации поджелудочной железы крыс контрольной группы показал, что структура органа соответствует норме: клетки расположены довольно равномерно с хорошо контурируемыми ядрами.
Было установлено, что во всех экспериментальных группах по сравнению с контролем наблюдались некротические изменения, вызванные интоксикацией аллоксаном. При анализе структурной организации поджелудочной железы крыс после приема ЭВР-А обнаружена только кольцевидная трансформация ацинуса, гипертрофия островков Лангерганса, субнекроз. Иная картина наблюдалась в структурной организации поджелудочной железы крыс, употреблявших ЭВР-К при аллоксановой модели сахарного диабета. Наряду с кольцевидной трансформацией ацинуса, гипертрофией островков Лангерганса, субнекрозом, которые наблюдались в группе СД+ЭВР-А, отмечена также гипертрофия и гиперплазия островков Лангерганса, междольковый отек, очаговые некрозы ткани, псевдокистоз, а также соединительнотканное замещение ацинусов, элементы жировой атрофии, тяжелый протеолиз в сочетании с липолизом (рис.2). Таким образом, прием ЭВР-А на фоне СД способствовал минимальным структурным изменениям поджелудочной железы по сравнению с водой и ЭВР-К.
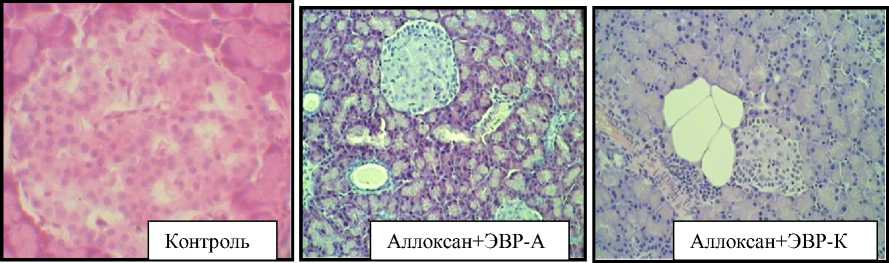
Рис. 2.
Морфологическая структура поджелудочной железы.
Все права защищены

4(8) 2012
ISSN 2226-3365
Почки практически всех животных контрольной группы имеют нормальную структурную организацию. Отчетливо обозначены корковое и мозговое вещество почечной паренхимы. Клубочки коры представлены капиллярными петлями, заключенными в эпителиальные капсулы со слегка различимыми просветами. Анализ структурной организации почек крыс с аллоксановой моделью сахарного диабета после приема ЭВР-А показал кистозную множественную трансформацию, гидрофическую дистрофию канальцев, выраженную полифибропластическую реакцию на уровне капилляров, канальцевые некрозы, начинающиеся фибропластические реакции.
В почках крыс после приема ЭВР-К обнаружен слабо выраженный кистоз, гидрофическая дистрофия, акцентированная на проксимальных канальцах, ячеистая структура на фоне тотальных некрозов, очаговый некроз с плазматическим пропитыванием интерстиция (рис. 3).
Следовательно, на фоне аллоксанового диабета в почках животных всех экспериментальных групп по сравнению со здоровыми животными обнаружены тяжелые последствия аллоксановой интоксикации. Регенерирующее действие ЭВР на почки в ходе эксперимента не установлено (рис.3).
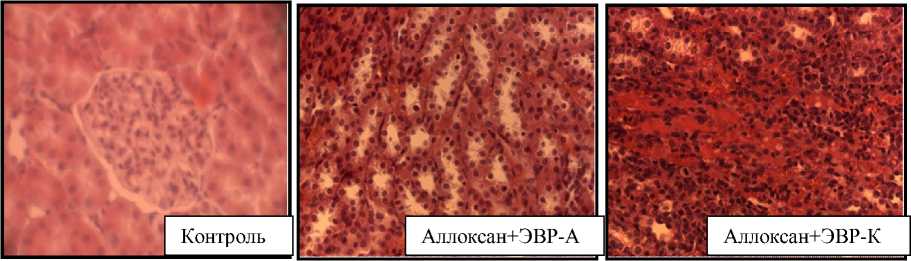
Рис. 3.
Морфологическая структура почки.
Таким образом, прием электрохимически активных водных растворов не вызывает изменений функций почек и водно-солевого обмена у здоровых животных, тогда как при сахарном диабете увеличение диуреза и экскретируемой фракции калия после приема ЭВР требует дальнейшего изучения. В то же время анолит на фоне изучаемой патологии способствует задержке развития данного заболевания, что проявляется в более низких показателях уровня глюкозы в крови, тогда как католит не оказывает подобного протективного эффекта. Гистологический анализ показал положительное влияние анолита на структуру поджелудочной железы крыс с аллоксановой моделью сахарного диабета. Полученные данные требуют исследования биохимических процессов, определяющих подобный гипогликемический и протективный эффекты анолита.
Все права защищены

4(8) 2012
ISSN 2226-3365
Список литературы Влияние электроактивированных водных растворов на морфофункциональные показатели поджелудочной железы и почек крыс с экспериментальной моделью сахарного диабета
- Зарезаев О. А., Корнева Т. К., Паничева С. А. Обработка рук хирурга электрохимическими активированными растворами и микробиологический контроль метода//Электрохимическая активация в медицине, сельском хозяйстве, промышленности: тезисы докл. всерос. конф. -М., 1994.
- Электрохимическая активация: История, состояние, перспективы. Академия медико-технических наук Российской Федерации/под ред. В. М. Бахира. -М.: ВНИИИМТ, 1999. -107 с.
- Петросян Э. А. Патогенетические принципы и обоснование лечения гнойной хирургической инфекции методом непрямого электрохимического окисления: автореферат на соискание ученой степени доктора мед. наук. -М.,1991. -54 с.
- Метод непрямой электрохимической детоксикации организма с использованием гипохлорита натрия в практической медицине//Добриянец А. И., Жидков С. А., Кузьмин Ю. В. Методические рекомендации. -Минск, 2000. -26 с.
- Вахидов В.В., Мамаджанов У. Д., Касымов А. Х. и др. Способ получения жидкости с биологически активными свойствами/Авторское свидетельство СССР. -М., 1982. -93 с.
- Гительман Д. С., Збрижер Э. Р. Исследование влияния электроактивированного раствора католита на иммунный ответ и кроветворение у сублетально облученных мышей//Электрохимическая активация в медицине, сельском хозяйстве, промышленности: тезисы докл. всерос. конф. -М., 1994.
- Лакин Г.Ф. Биометрия. -М.: Высшая школа, 1980. -293 с.


