Влияние электромагнитного излучения на течение экспериментальной раневой инфекции
Автор: Пронина Елена Александровна, Райкова Светлана Владимировна, Швиденко Инна Григорьевна, Шуб Геннадий Маркович
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Микробиология
Статья в выпуске: 3 т.6, 2010 года.
Бесплатный доступ
В статье изложены результаты исследований влияния электромагнитного излучения (ЭМИ) на частоте молекулярного спектра поглощения и излучения (МСПИ) оксида азота (150 ГГц) и атмосферного кислорода (129 ГГц) на течение экспериментальной гнойной инфекции, вызванной антибиотикочувствительными и анти-биотикорезистентными штаммами Pseudomonas aeruginosa. В работе использовался панорамно-спектрометрический измерительный комплекс, разработанный в ОАО «ЦНИИИА» г. Саратова, в котором возбуждались электромагнитные КВЧ-колебания, имитирующие структуру молекулярного спектра поглощения и излучения атмосферного кислорода и оксида азота. Проведенные эксперименты свидетельствуют, что облучение на частоте молекулярного спектра поглощения и излучения (МСПИ) оксида азота (150 ГГц) положительно влияет на течение раневого процесса
Атмосферный кислород, оксид азота, экспериментальная инфекция, электромагнитное излучение
Короткий адрес: https://sciup.org/14917113
IDR: 14917113
Текст научной статьи Влияние электромагнитного излучения на течение экспериментальной раневой инфекции
1Введение. Лечение гнойно-воспалительных заболеваний является одной из наиболее актуальных проблем современной медицины. Анализ отечественных и зарубежных проспективных исследований свидетельствует о том, что число больных с гнойновоспалительными заболеваниями и осложнениями не имеет тенденции к снижению, что обусловливает социальную значимость проблемы [1]. Значительную угрозу представляют внутрибольничные инфекции, полимикробное инфицирование, высокая устойчивость возбудителей гнойной инфекции к антибиотикам. Все это делает очевидной необходимость совершенствования известных и поиска новых методов лечения гнойно-воспалительных заболеваний [2].
В настоящее время на передний план выдвигается задача изучения процессов, в которых участвуют активные короткоживущие молекулы, являющиеся
регуляторами на различных уровнях организации живых организмов. К таким соединениям относятся оксид азота (ΝО) и активные формы кислорода (АФК). В последние годы появляется все больше данных о новых физиологических функциях оксида азота и кислорода.
Важным регулятором биологических процессов в клетках и тканях также является кислород и его так называемые реактивные формы (РФК). Именно РФК рассматривают как одну из систем внутриклеточных и межклеточных мессенджеров.
Кроме того, активные формы кислорода и оксид азота участвуют в развитии патологий, связанных с окислительным стрессом.
В последние годы все большее внимание исследователей, работающих над проблемой стимуляции заживления ран и профилактики их нагноений, привлекает ΝО-терапия. ΝО-терапия ран, по данным ряда авторов [3-10], является мощным стимулятором раневого процесса, особенно в осложненных ранах
(гнойные, огнестрельные, трофические и диабетические язвы, длительно незаживающие раны в онкологии и др.).
Немедикоментозные методы лечения ряда заболеваний, в том числе и гнойно-воспалительных заболеваний, не только альтертативны лекарственным, но в ряде случаев имеют значительные преимущества как методы функциональной регулирующей терапии.
В последние десятилетия в результате фундаментальных исследований и экспериментальных работ в России было создано новое перспективное направление медицины – КВЧ-терапия (крайне высокочастотная терапия, микрорезонансная терапия, миллиметровая терапия). Это метод воздействия электромагнитным излучением миллиметрового диапазона крайне высокой частоты (30-300 ГГц) и низкой интенсивности (менее 10 мВт/см). Использование данного метода в лечении и профилактике ряда заболеваний человека является одним из перспективных и активно развивающихся направлений современной клинической медицины.
В 1987-1990 гг. применение метода КВЧ-терапии апробировано в экстремальных условиях при наиболее тяжелых видах боевой патологии опорно-двигательного аппарата и получило положительную оценку в Центральном военном госпитале Министерства обороны РФ.
В КВЧ-терапии наиболее часто используются следующие частоты: 42,19ГГц и 53,3ГГц, 60,12 ГГц . Но в миллиметровом диапазоне находятся молекулярные спектры излучения и поглощения различных клеточных метаболитов, в том числе и оксида азота и кислорода, поэтому изучение биологических эффектов электромагнитного излучения в перечисленных частотах представляет значительный интерес как для теоретической, так и для практической медицины.
Целью исследования было изучение влияния ЭМИ на частотах МСПИ О2(129 ГГц) и МСПИ ΝО (150 ГГц) на течение экспериментальной раневой инфекции.
Методы. В работе был использован квазиоптиче-ский генератор, разработанный в ОАО «ЦНИИИА», в котором возбуждались электромагнитные КВЧ-колебания, имитирующие структуру молекулярного спектра поглощения оксида азота и атмосферного кислорода.
Точное значение заданной частоты определяли в соответствии с международной базой данных молекулярных спектров высокого разрешения HITRAΝ (созданной с участием космического агентства и с учетом поправок на атмосферное давление и температуру окружающей среды.
В экспериментах использовали клинические штаммы Pseudomonas aeruginosa (табл.). Выбор культур бактерий определялся их ролью в возникновении госпитальной инфекции. P. aeruginosa относятся к «проблемным» микроорганизмам, так как являются частыми возбудителями госпитальных инфекций, особенно в отделениях реанимации и интенсивной терапии. Летальность от инфекций, вызванных P. aeruginosa, достигает 75%.
По литературным данным, к числу современных антипсевдомонадных антибиотиков относят цефтазидим и амикацин. Эти антибиотики имеют разный механизм действия на бактериальную клетку: цефтазидим является ингибитором синтеза клеточной стенки, амикацин – подавляет синтез белка микробных клеток. Поэтому в экспериментах были взяты эти два антибиотика.
Таблица
МПК антибиотиков в отношении взятых в опыт штаммов
|
Культура бактерий |
МПК антибиотика, мг/л |
|
|
цефтазидим |
амикацин |
|
|
P. aeruginosa AmikSCefS |
8 |
16 |
|
P. aeruginosa AmikRCefR |
128 |
64 |
Чувствительность выделенных штаммов к различным антибиотикам определяли методом серийных разведений.
Экспериментальные исследования проводили на белых беспородных мышах, самцах массой 18-20 г в соответствии с требованиями Федерального закона от 01.01.1997 г. «О защите животных от жестокого обращения» и положениями Европейской конвенции по защите позвоночных животных (Страсбург, 18.03.1986 г.). Все животные содержались в одинаковых условиях виварного режима и прошли карантинный отбор. Было проведено 4 серии экспериментов. В каждом эксперименте сформировано 9 групп, по 5 мышей в каждой группе: 1-я группа – контрольная, где животные не получали никакого лечения; 2-я и 3-я группы получали лечение одним из антибиотиков; 4-я и 7-я – облучение ЭМИ на частотах МСПИ атмосферного кислорода и оксида азота; 5, 6, 8, 9-я – сочетанное применение ЭМИ на частотах МСПИ атмосферного кислорода и оксида азота с антибиотиками.
У животных моделировались на предварительно выбритых участках кожи в области спины кожные раны длиной и шириной 10,0 мм, глубиной 0,2 см. Для получения одинаковых по размеру дефектов использовали трафарет, размером 10 на 10 мм, который накладывали на операционное поле и скальпелем делали разрезы на коже. Полнослойные кожные лоскуты указанного размера и формы выкраивали с использованием глазных ножниц и скальпеля. Раневая инфекция воспроизводилась путем инфицирования поверхности раны взвесью суточной агаровой культуры в количества 0,1 мл микробной взвеси (109 КОЕ/мл). Дефекты кожи оставались открытыми в течение всего периода наблюдения. Через 3 дня формировалась гнойная рана, и тогда приступали к лечению. Лечение осуществляли ежедневно. Раны предварительно механически очищали стерильными ватно-марлевыми тампонами, смоченными стерильным физиологическим раствором.
Клиническая оценка течения раневого процесса у экспериментальных животных производилась с учетом выраженности и продолжительности воспалительных явлений в области раны (отек, гиперемия, количество и характер гнойного отделяемого, сроки появления грануляции и эпителизации, состояние дна и стенок раны, сроки отторжения струпа и полного заживления).
Планиметрическое исследование выполнено с целью определения сроков заживления раны и включало измерение площади раневой поверхности по методу Л.Н. Поповой (1942) и К.И. Фенчина (1979). Методика исследования заключалась в следующем: на рану накладывали стерильную целлофановую пленку и на ней маркером обрисовывали контуры ран, затем переносили ее на миллиметровую бумагу. Площадь ран определяли в квадратных миллиметрах внутри обведенного контура. Измерения проводили на 5, 10, 15 и 20-е сутки.
Лечение антибиотиками и электромагнитным излучением проводили ежедневно, в течение десяти дней, с 11-го по 14-й день использовали только облучение. Чтобы приблизить условия эксперимента к реальным условиям практического использования генератора электромагнитного излучения в лечебной практике, максимальное время облучения не превышало 10 минут. Рупор-излучатель генератора помещали на расстоянии 2 см от раневой поверхности экспериментального животного. Дозы антибиотиков составляли: цефтазидим - 50 мг/кг/сутки (Ceftazidim-Akos производства ОАО «Синтез»), амикацин (производства ОАО «Синтез») - 10 мг/кг/сутки. Препараты вводили внутримышечно, 2 раза в сутки. Срок наблюдения за животными составлял 30 дней.
Статистическую обработку и анализ данных проводили с помощью компьютерных программ Microsoft Excel (7.0 для Windows XP) и Statistica 6.0.
Результаты. Результаты планиметрических исследований раневой поверхности животных контрольных и опытных групп представлены на рисунке 1-4.
Сравнительный анализ динамики площади заживления ран показал, что в контрольный срок – через 20 суток после заражения - у животных с экспериментальной инфекцией, вызванной P. aeruginosa AmikSCefS – штаммом, чувствительным к амикацину и цефтазидиму, площадь поражения сократилась и в контрольной группе составляла 35,17% от исходной; при лечении амикацином – 17,93% (p<0,05); цефтазидимом – 26,76% (p<0,05); при ЭМИ на частоте МСПИ О2 – 33,8% (p>0,05); ЭМИ на частоте МСПИ ΝО – 14,49% (p<0,05); при сочетанном применении амикацина и ЭМИ на частоте МСПИ О2 – 24,83% (p<0,05); амикацина и ЭМИ на частоте МСПИ ΝО – 0% (p<0,05); при сочетанном применении цефтазидима и ЭМИ на частоте МСПИ О2 –30,3% (p<0,05); цеф- тазидима и ЭМИ на частоте МСПИ ΝО – 0% (p<0,05). Относительная погрешность измерений в эксперименте составляла не более 2%.
У животных с экспериментальной инфекцией, вызванной P. aeruginosa AmikRCefR – штаммом, устойчивым к амикацину и цефтазидиму, на 20-е сутки от момента нанесения и инфицирования ран площадь поражения в контрольной группе составляла 31,25%; в группе животных, получавших лечение только амикацином или цефтазидимом, – 32,5% (p>0,05) и 30,63% (p>0,05) соответственно; в группе животных, подвергшихся облучению ЭМИ на частотах МСПИ О2 и МСПИ ΝО, – 35,63% (p>0,05) и 16,25% (p<0,05); при сочетанном лечении амикацином и ЭМИ на частоте МСПИ О2 и амикацином с ЭМИ на частоте МСПИ ΝО – 30,62% (p<0,05) и 7,5% (p<0,05) соответственно; в группах животных, получавших лечение цефтазидимом и ЭМИ на частотах МСПИ О2 и МСПИ ΝО, – 34,38% (p>0,05) и 13,13% (p<0,05). Относительная погрешность измерений в эксперименте составляла не более 2%.
Исследование сроков заживления гнойно-воспалительных ран показало, что заживления ран (рис. 5-6) экспериментальной инфекции, вызванной P. aeruginosa AmikSCefS – штаммом, чувствительным к амикацину и цефтазидиму, средние сроки заживления составляли в контрольной группе 26,8±2,1 суток; при лечении амикацином – 21,2±1,8 (p<0,05); цефтазидимом – 21,7±1,8 (p<0,05); при ЭМИ на частоте МСПИ О2 – 25,8±2,6 (p>0,05); ЭМИ на частоте МСПИ ΝО – 21,5±1,4 (p<0,05); при сочетанном применении амикацина и ЭМИ на частоте МСПИ О2 – 24,43±1,9 (p<0,05); амикацина и ЭМИ на частоте МСПИ ΝО – 16,2±0,7 (p<0,05); при сочетанном применении цефтазидима и ЭМИ на частоте МСПИ О2 – 24,63±1,9
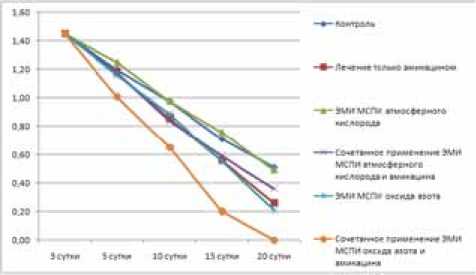
Рис. 1. Результаты планиметричеких исследований лечения гнойных ран, вызванных P. aeruginosa AmikS
Рис. 3. Результаты планиметричеких исследований лечения гнойных ран, вызванных P. aeruginosa AmikR
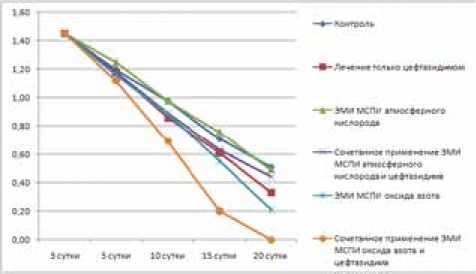
Рис. 2. Результаты планиметричеких исследований лечения гнойных ран, вызванных P. aeruginosa CefS
Рис. 4. Результаты планиметричеких исследований лечения гнойных ран, вызванных P. aeruginosa CefR
(p>0,05); цефтазидима и ЭМИ на частоте МСПИ ΝО – 16,4±0,9 (p<0,05) дня.
У животных во второй серии с экспериментальной инфекцией, вызванной P. aeruginosa AmikRCefR– штаммом, устойчивым к амикацину и цефтазидиму, средние сроки заживления ран в контрольной группе составляла 28,4±2,4; в группе животных, получавших лечение только амикацином или цефтазидимом, – 30,1±2,3 (p>0,05) и 27,9±2,4 (p>0,05) соответственно; в группе животных, подвергшихся облучению ЭМИ на частотах МСПИ О2и МСПИ ΝО, – 30,1±2,7 (p>0,05) и 23,2±2,2(p<0,05); при сочетанном лечении амикацином и ЭМИ на частоте МСПИ О2и амикациномс ЭМИ на частоте МСПИ ΝО – 25,3±2,2 (p<0,05) и 19,8±0,9 (p<0,05); в группах животных, получавших лечение цефтазидимом и ЭМИ на частотах МСПИ О2 МСПИ ΝО, – 28,7±2,4 (p>0,05) и 19,0±0,8 (p<0,05).
Обсуждение. При сравнении результатов влияния электромагнитного излучения на частоте молекулярного спектра поглощения и излучения атмосферного кислорода и оксида азота на течение раневого процесса установлено, что применение ЭМИ на частоте МСПИ О2 практически не влияло на показатели планиметрии и скорость заживления инфицированных ран. С другой стороны, использование ЭМИ на частоте МСПИ ΝО положительно влияло на течение и скорость заживления ран во всех сериях эксперимента. При облучении на частоте оксида азота у всех животных значительно сокращались сроки заживления и площадь раневой поверхности. Это касалось инфекции, вызванной как антибиотикочувствительным, так и антибиотикоустойчивым штаммом синегнойной палочки.
Одинаковый положительный эффект наблюдался при сочетанном применении ЭМИ на частоте МСПИ ΝО как с антибиотиком, нарушающим синтез клеточной стенки (цефтазидим), так и с антибиотиком, ингибитором синтеза белка (амикацин).
Заключение. Таким образом, выполненные нами исследования свидетельствуют, что на фоне применения электромагнитного излучения на частоте молекулярного спектра поглощения и излучения оксида азота (150 ГГц) существенно ускоряется течение раневого процесса. С этих позиций можно рекомендовать данный способ воздействия в комплексное лечение раневых процессов.
Список литературы Влияние электромагнитного излучения на течение экспериментальной раневой инфекции
- Иванов В.К., Иванова Ю.В., Силин А.О. Влияние СВЧ-облучения на показатели иммунологической резистентности и транспорта кислорода при экспериментальном перитоните//Биомедицинские технологии и радиоэлетроника. 2006. Т. 3. С. 8-12.
- Иванова Ю.В., Гусак И.В. Электромагнитное облучение СВЧ-диапазона в комплексе лечения гнойных ран//Украинский медицинский альманах. 2006. Т. 3. С. 12-17.
- Использование NO-содержащего газового потока в лечении гнойных ран: NO-терапия, теоретические аспекты, клинический опыт и проблемы применения экзогенного оксида азота в медицине/В.К. Гостищев, К.В. Липатов, А.Б. Шехтер, А. Ю. Емельянов//Русский врач. 2001. С. 79-82.
- Применение воздушно-плазменного аппарата «Пла-зон» в режимах коагуляции и NO-терапии при реконструктив-но-пластических операциях у онкологических больных/И.В. Решетов, А.Б. Шехтер, Р.К. Кабисов [и др.]//Анналы пластической реконструкции и эстетической хирургии. 2000. Т. 4. С. 24-38.
- Толстых М.П. Теоретические и практические аспекты заживления ран. М.: Дипак, 2007. С. 27-39.
- Применение экзогенного оксида азота в медицине: медико-биологические основы, клинико-морфологические аспекты, механизмы и перспективы: NO-терапия теоретические аспекты, клинический опыт и проблемы применения экзогенного оксида азота в медицине/А.Б. Шехтер, СВ. Грачев, З.П. Милованова, Т.Г. Руденко//Русский врач. 2001. № 5. С. 14-17.
- Beneficial effect of gaseous nitric oxide on the healing of skin wound/A.B. Shekhter, T.G. Rudenko, V.A. Serezhenkov [et al.]//Nitric oxide: Biol. Chem. 2005. Vol. 12. P. 210-219.
- The function of nitric oxide in wound repair: inhibition of inducible NO-synthase severely impairs wound reepitalization/B. Stallmeyer, H. Kampfer et al.//J. Invest. Dermat. 1999. Vol. 113. P. 1090-1098.
- Опыт применения экзогенной NO-терапии для лечения послеоперационных ран и лучевых реакций у онкологических больных/Р.К. Кабисов, В.В. Соколов, А.Б. Шехтер [и др.]//Российский онкологический журнал. 2000. Т. 1. С. 24-29.
- Чирикова Е.Г Плазмодинамическая санация оксидом азота (N0) в комплексном лечении трофических язв венозной этиологии: Автореф. дис.... канд. мед. наук. М., 2002. 134 с.


