Влияние электромагнитного излучения терагерцового диапазона частотой молекулярного спектра оксида азота 150+0,75 ГГц на морфофункциональные нарушения микроциркуляции у белых крыс в состоянии острого и длительного стресса
Автор: Бугаева И.О., Киричук Вячеслав Федорович, Иванов А.Н., Куртукова М.О.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Физиология и патофизиология
Статья в выпуске: 4 т.5, 2009 года.
Бесплатный доступ
Изучено влияние электромагнитного излучения терагерцового диапазона на частотах молекулярного спек- тра излучения и поглощения оксида азота 150+0,75 ГГц на морфофункциональные изменения микроциркуля- ции и структуры тканей у животных в состоянии острого и длительного иммобилизационного стресса. Показано, что воздействие электромагнитных волн на указанных частотах вызывает ограничение активности гипоталамо- гипофизарно-надпочечниковой и тиреоидной осей стрессорной реакции. Установлено, что волны терагерцового диапазона на частотах оксида азота способны восстанавливать нарушения внутрисосудистого, сосудистого и внесосудистого компонентов микроциркуляции, а также обладают гистопротекторным действием.
Микроциркуляция, электромагнитное излучение, терагерцовый диапазон, оксид азота, стресс
Короткий адрес: https://sciup.org/14916960
IDR: 14916960
Текст научной статьи Влияние электромагнитного излучения терагерцового диапазона частотой молекулярного спектра оксида азота 150+0,75 ГГц на морфофункциональные нарушения микроциркуляции у белых крыс в состоянии острого и длительного стресса
Изменения регионарного, в частности, коронарного, мозгового, почечного кровотока и системной гемодинамики, в том числе недостаточность кровообращения, связаны, прежде всего, с нарушениями микроциркуляции.
Для коррекции различных компонентов микро-циркуляторных нарушений используют широкий спектр препаратов: вазодилататоры, антиагреганты, дезагреганты, прямые и непрямые антикоагулянты, антиоксиданты и др. Однако фармакотерапия всегда сопровождается возникновением различной степени выраженности побочных эффектов. В связи с этим
в настоящее время ведутся поиски новых немедикаментозных методов коррекции указанных нарушений. Одним их таких методов является низкоинтенсивное излучение миллиметрового и субмиллиметрового диапазона частот [1].
Однако в доступной литературе представлены только исследования влияния ТГЧ-излучения на частотах оксида азота 150 + 0,75 ГГц на отдельные функциональные показатели различных составляющих микроциркуляции, в частности ее внутрисосудистого компонента [2]. При этом нет комплексных сведений о морфофункциональных изменениях в системе микроциркуляции под влиянием данного диапазона волн, и их роли в гистофизиологии тканей.
Цель работы: установить влияние электромагнитного излучения терагерцового диапазона частотой молекулярного спектра излучения и поглощения оксида азота 150+0,75 ГГц на морфофункциональ- ные нарушения микроциркуляции и структуры тканей в различных органах у белых крыс, находящихся в состоянии острого и длительного стресса.
Материалы и методы. Исследования проведены на 155 белых нелинейных крысах-самцах массой 180-220 г. В качестве модели нарушения микроциркуляции нами использовался острый иммобилизацион-ный стресс: жесткая фиксация животных на спине в течение 3-х часов. В качестве длительно действующего стрессора использовали ежедневную 3-часовую иммобилизацию животных в положении на спине в течение 5 суток [2].
Облучение животных проводилось малогабаритным медицинским аппаратом «КВЧ-ΝО», разработанным в Медикотехнической ассоциации КВЧ (г. Москва) совместно с ФГУП «НПП-Исток» (г. Фрязино) и ОАО ЦНИИИА (г. Саратов) [3].
Облучалась поверхность кожи площадью 3 см2 над областью мечевидного отростка грудины. Облучатель располагался на расстоянии 1,5 см над поверхностью тела животного. Мощность излучения генератора составляла 0,7 мВт, а плотность мощности, падающей на участок кожи размером 3 см2, составляла 0,2 мВт/см2. Продолжительность однократного облучения составляла 30 минут.
Исследование морфофункциональных изменений в тканях проведено на 5 группах животных по 15 особей в каждой: 1 группа – контрольная (15 интактных крыс-самцов); 2 группа – крысы-самцы, находящиеся в состоянии острого иммобилизационного стресса; 3 группа включала животных, подвергнутых облучению терагерцовыми волнами на частотах молекулярного спектра излучения и поглощения оксида азота 150 + 0,75ГГц в течение 30 минут на фоне острого стресса; 4 группа – крысы-самцы, находящиеся в состоянии длительного иммобилизационного стресса; 5 группа включала животных, подвергнутых ежедневному 30-минутному облучению терагерцо-выми волнами на частотах молекулярного спектра излучения и поглощения оксида азота 150 + 0,75ГГц в течение 5 дней, на фоне длительного стресса (облучение животных проводили после каждого сеанса иммобилизации).
Материал для гистологического исследования забирался после декапитации животных. В остром стрессе животных декапитировали через 24 часа от начала действия стрессора, а при длительном стрессе – через 24 часа после 5-й иммобилизации (на 6-е сутки эксперимента).
Ткани головного мозга, эндокринных желез (гипофиза, надпочечников, щитовидной железы), висцеральных органов (сердце, печень, легкие, желудок, брыжейка тонкой кишки, почки) фиксировались в 10% - м растворе нейтрального формалина, после чего доводились до парафиновых блоков. Окраску препаратов проводили гематоксилином и эозином, а для элективного выявления фибрина использовался гистохимический метод ОКГ (оранжевый Ж, красный 2С, водный голубой).
Результаты. Проведенные нами исследования показали, что у животных в состоянии острого иммо-билизационного стресса происходят морфофункциональные изменения гипофиза, надпочечников и щитовидной железы, сопровождающиеся повышенным кровенаполнением гипофиза, щитовидной железы и надпочечников. В щитовидной железе происходит изменение эпителия фолликулов и коллоида. Во многих фолликулах отмечалась повышенная митотическая активность интрафолликулярного эпителия.
В надпочечниках выявлено истончение клубочковой зоны, выраженное в различной степени истощение клеток пучковой зоны коры надпочечников, что проявлялось диффузным или очаговым обеднением этих клеток липидами.
У животных в состоянии длительного стресса также отмечалось повышенное кровенаполнение гипофиза. В щитовидной железе обнаружено, что большинство фолликулов не содержало коллоида, а эпителий фолликулов высокий, многорядный (рис. 1). В состоянии длительного стресса развивается гипертрофия коры надпочечников, происходит измене-
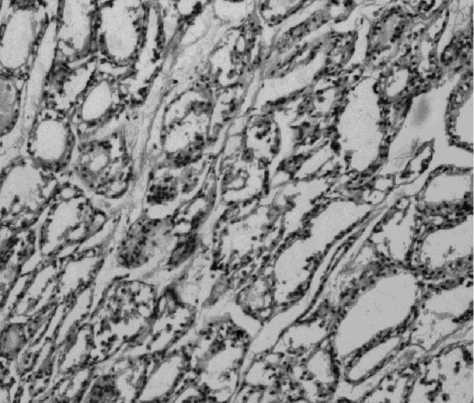
Рис. 1. Щитовидная железа крысы-самца, находящегося в состоянии длительного стресса. Разжижение коллоида и образование вакуолей, большинство фолликулов коллоида не содержат. Многорядный, высокий эпителий фолликулов. Окр. Г-Э. Ув. 200
ние соотношения между зонами (гипертрофируется пучковая зона коры надпочечников). Морфологические изменения, выявленные в надпочечниках у этой группы животных (уменьшение липидных включений, изменение соотношения между зонами коры за счет увеличения пучковой зоны), и выраженное полнокровие являются структурным эквивалентом усиления продукции кортикостероидов и их секреции в условиях стресс-реакции.
В центральной нервной системе и в висцеральных органах обнаружены нарушения всех компонентов микроциркуляции у животных в состоянии острого и длительного иммобилизационного стресса, которые возникают уже после однократной иммобилизации и прогрессируют в ходе длительного стресса.
У животных в состоянии острого и длительного стресса происходит также нарушение сосудистого компонента микроциркуляции, что проявляется изменением тонуса сосудов и кровенаполнения органов. Следует отметить, что у животных, подвергнутых однократной трехчасовой иммобилизации, во многих
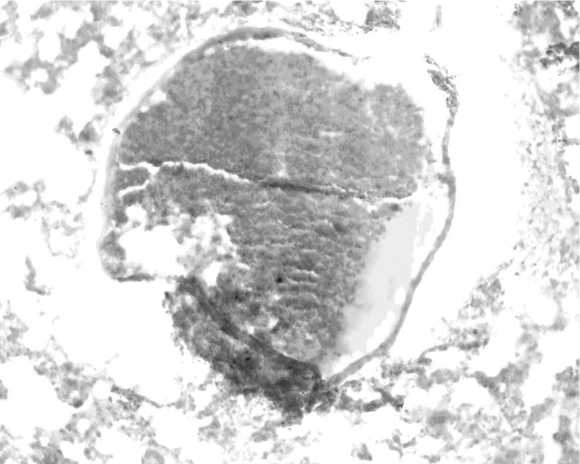
Рис. 2. Сепарация крови и образование пристеночных тромбов в просвете сосуда легкого крысы-самца, находящегося в состоянии длительного стресса. Окр. ОКГ. Ув. 400

Рис. 3. Фибриноидное набухание стенок артерий легких крысы-самца, находящегося в состоянии длительного стресса. Окр. ОКГ. Ув. 300
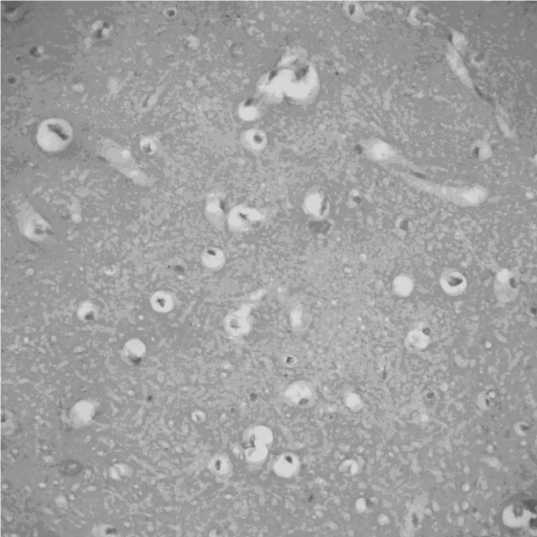
Рис. 4. Полнокровие сосудов, расширение периваскулярных и перицеллюлярных пространств ткани головного мозга крысы-самца, находящегося в состоянии длительного стресса. Окр. Г-Э. Ув. 200
органах (печень, почки, желудок, легкие) наблюдаются явления ишемии, что в целом организме отражает явления централизации кровотока. Нарушение сосудистого компонента микроциркуляции также проявляется увеличением проницаемости сосудов (фибриноидное набухание их стенок) и грубыми нарушениями целостности микрососудов (кровоизлияния в головном мозге и его мягкой оболочке, легких, брыжейке тонкого кишечника). Фибриноидное набухание стенок сосудов (рис. 3) и кровоизлияния (в мягкой мозговой оболочке, головном мозге, брюшине, легких) наиболее часто встречаются в гистологических препаратах органов животных, находящихся в состоянии длительного стресса.
Выявленные нами внесосудистые нарушения микроциркуляции, проявляющиеся отеками, отмечаются прежде всего в головном мозге и выражаются в увеличении периваскулярных и перицеллюлярных пространств (рис. 4). Они более выражены у животных в состоянии длительного стресса. Изменение внесосудистого компонента микроциркуляции еще больше усугубляют нарушения в других ее компонентах. В ряде органов (сердце, легкие, печень, почки, желудок) микроциркуляторные нарушения приводят к развитию дистрофических и некротических изменений.
Наши исследования показали, что нарушения микроциркуляции в головном мозге приводили к развитию дистрофических изменений нейронов у животных в состоянии длительного стресса. В сердце животных, подвергнутых однократной трехчасовой иммобилизации, обнаруживались признаки дистрофии миокарда: зернистость цитоплазмы, нечеткие ее контуры, отмечалась фрагментация мышечных волокон. При длительном стрессе признаки дистрофии миокарда нарастали: многие кардиомиоциты находились в состоянии зернисто-глыбчатого распада с исчезновением поперечно-полосатой исчерченности, в ряде случаев ядра не определялись (рис. 5).
У животных в состоянии острого иммобилизаци-онного стресса происходит нарушение внутрипече-ночной гемодинамики, приводящее к ишемии. При длительном стрессе нарушение внутрипеченочной гемодинамики проявляется застойными явлениями, при этом происходят дистрофия и некроз гепатоцитов.
В почках животных, подвергнутых однократной трехчасовой имообилизации, отмечены явления ишемии, которые приводят к дистрофическим изменениям в канальцах почек. При длительном стрессе у них развивается некроз эпителия почечных канальцев.
В результате проведенных исследований установлено, что электромагнитное излучение терагер-цового диапазона на частотах молекулярного спектра излучения и поглощения оксида азота 150+0,75 ГГц умеренно снижает активность гипоталамо-гипофизарно-надпочечниковой и тиреоидной осей стрессорной реакции, что проявляется отсутствием или уменьшением выраженности характерных для стресс-реакции морфо-функциональных изменений в гипофизе, надпочечниках и щитовидной железе. Так, у животных, подвергнутых ТГЧ-воздействию на фоне острого и длительного стресса, не обнаружены морфологические изменения гипофиза, снижается активность надпочечников, на что указывает отсутствие выраженной делипидизации их коры, и менее выражены изменения коллоида и эпителия фолликулов щитовидной железы (рис. 6), наблюдаемые соответственно при остром и длительном иммобилизаци-онном стрессе.
Электромагнитное излучение терагерцового диапазона на частотах молекулярного спектра излучения и поглощение оксида азота 150 + 0,75ГГц оказывает нормализующее влияние на микроциркуляцию и структуру тканей различных органов у белых крыс самцов, подвергнутых острому и длительному стрессу. Так, на фоне ТГЧ-воздействия восстанавливается внутрисосудистый компонент микроциркуляции у животных, подвергнутых ТГЧ-облучению на фоне острого и длительного стресса, при этом не обнаружено признаков сладжирования крови. У животных в состоянии острого стресса отмечается значительное уменьшение явлений ишемии многих висцеральных органов (печени, почек, легких), нормализация кровотока в головном мозге (рис. 7), снижение повышенной проницаемости сосудов и ломкости капилляров. Вышеуказанные факты свидетельствуют в пользу значительного влияния электромагнитных волн указанной частоты на сосудистый компонент микроциркуляции, в частности, на тонус сосудов.
Нами обнаружен ряд структурных изменений в тканях у крыс-самцов, находящихся в состоянии острого и длительного иммобилизационного стресса, под влиянием электромагнитного излучения терагер-цового диапазона на частотах молекулярного спектра излучения и поглощения оксида азота 150 + 0,75 ГГц. Следует отметить, что ТГЧ-воздействие не оказывает значительного влияния на грубые структурные нарушения. Так, ТГЧ-волны указанной частоты не оказывают эффективного влияния на дистрофические нарушения в сердце (рис. 8), однако способствуют значительному снижению частоты ишемического повреждения почек и печени у животных, подвергнутых однократной трехчасовой иммобилизации. В условиях длительного иммобилизационного стресса электромагнитное излучение терагерцового диапазона на частотах оксида азота способно препятствовать развитию дистрофических изменений нейронов головного мозга. Отсутствие дистрофических изменений нейронов, характерных для состояния длительного стресса у животных, подвергнутых курсовому ТГЧ-воздействию, свидетельствует о нейропротекторном эффекте волн указанной частоты.
Обсуждение результатов. Повышенное кровенаполнение гипофиза, щитовидной железы и надпочеч-

Рис. 5. Дистрофия миокарда крысы-самца, находящегося в состоянии длительного стресса. Окр. Г-Э. Ув. 400
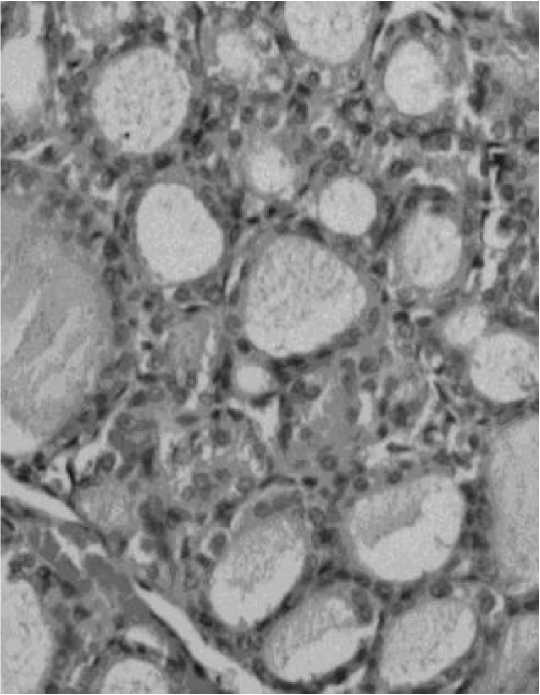
Рис. 6. Разжижение интрафолликулярного коллоида и высокий призматический эпителий фолликулов щитовидной железы крысы-самца, подвергнутого курсовому облучению ТГЧ-волнами на частотах МСИП оксида азота 150+0,75 ГГц на фоне длительного стресса. Окр. Г-Э. Ув. 200
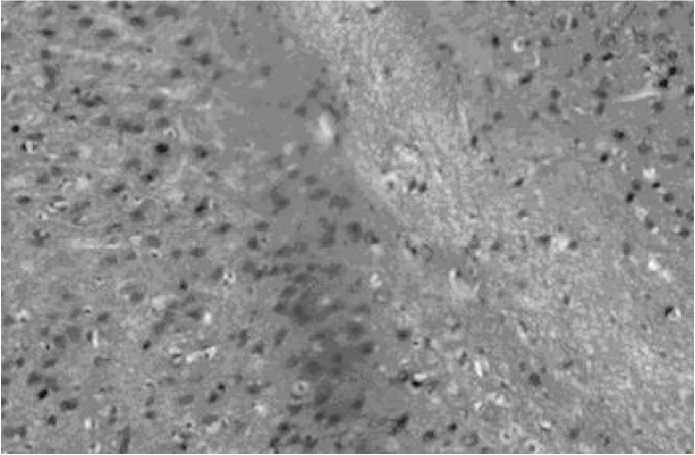
Рис. 7. Головной мозг крысы-самца, подвергнутого курсовому облучению ТГЧ-волнами на частотах МСИП оксида азота 150+0,75 ГГц на фоне длительного стресса. Окр. ГЭ х 200
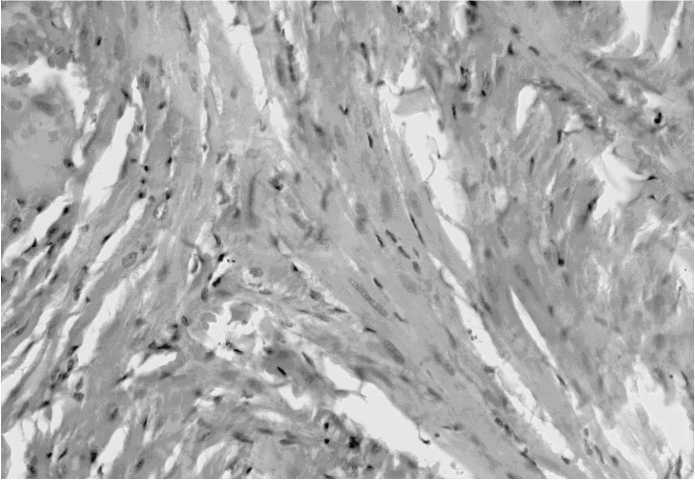
Рис. 8. Дистрофия отдельных волокон миокарда крысы-самца, подвергнутого курсовому облучению ТГЧ-волнами на частотах МСИП оксида азота 150+0,75 ГГц на фоне длительного стресса. Окр. ГЭ х 200
ников у животных в состоянии острого и длительного стресса свидетельствует о повышенной продукции гормонов [4]. Пролиферация клеток эпителия фолликулов, отсутствие коллоида в фолликулах щитовидной железы являются показателем ее гиперфункции [5]. Истощение клеток пучковой зоны коры надпочечников, что выражалось диффузным или очаговым обеднением этих клеток липидами, свидетельствует о значительном выделении глюкокортикоидов [6].
Таким образом, обнаруженные нами изменения эндокринных желез свидетельствуют о значительной активации основных стресс-реализующих систем, в частности гипоталамо-гипофизарно-надпочечниковой, тиреоидной осей стрессорной реакции. Изменения локального кровотока в этих железах можно рассматривать как функциональную гиперемию.
Выявленные в ряде органов нарушения внутрисосудистого компонента микроциркуляции у животных в состоянии острого и длительного стресса, проявляющиеся сепарацией крови на плазму и форменные элементы, характеризуют сладж-феномен, связанный с повышенной адгезией, агрегацией и агглютинацией форменных элементов крови, что обусловливает ее сепарацию на более или менее крупные конгломераты, состоящие из эритроцитов, тромбоцитов, лейкоцитов, и плазму крови [7].
Известно, что ключевое значение в регуляции сосудистого компонента микроциркуляции принадлежит эндотелию сосудов [8]. Повреждение эндотелия сосудов и обнажение субэндотелиальных слоев запускает реакции агрегации тромбоцитов, процесса свертывания крови, препятствующие кровопотере, вызывает спазм сосуда, прекращается образование антиагре-гантов [8]. Выявленные нами изменения сосудистого компонента микроциркуляции у животных в состоянии стресса можно объяснить повреждением эндотелия и развитием эндотелиальной дисфункции.
Обнаруженные изменения в структуре тканей различных органов животных, находящихся в состоянии острого и длительного стресса, объясняются длительным функционированием стресс-реализующих систем и повреждающим действим метаболитов этих систем [2].
Таким образом, у животных в состоянии острого стресса вследствие гиперфункции стресс-реализующих систем и повреждающего действия метаболитов этих систем возникают ярко выраженные нарушения внутрисосудистого, сосудистого и внесосудистого компонента микроциркуляции. Эти нарушения прогрессируют при длительном стрессе и приводят к развитию дистрофических и некротических изменений в тканях. Полученные нами данные согласуются с результатами многочисленных исследований, посвященных изучению морфофункциональных стрессорных изменений [4].
На основании ряда экспериментальных работ эффекты электромагнитного излучения терагерцового диапазона на частотах оксида азота150 + 0,75 ГГц тем или иным образом сопряжены с метаболическим циклом ΝО (преимущественно с ΝО-синтазной компонентой данного цикла).При облучении ТГЧ-волнами как на частотах МСИП ΝО, так и других терагерцовых частотах возможно увеличение реакционной способности и/или концентрации эндогенного оксида азота [9].
Условно можно выделить три уровня реализации эффектов повышения активности ΝО под влиянием ТГЧ-воздействия: непосредственное влияние на клетки – аутокринное действие; влияние на ткань в целом – паракринная регуляция деятельности соседних клеток и центральные эффекты – ΝО-зависимые изменения нервной и гуморальной регуляции [9].
В настоящее время обосновано представление о системе генерации оксида азота как об обособленной стресс-лимитирующей системе. Она активируется при действии на организм различных стресс-факторов и в процессе адаптации к повторным воздействиям факторов среды [10].
Активация ΝО-эргических нейронов в центральной нервной системе предупреждает гиперсекрецию таких гипоталамо-гипофизарных стрессорных гормонов, как кортикотропин, рилизинг-фактор кортикотропина и др. [11]. Этим фактом и объясняется отсутствие морфофункциональных изменений гипофиза у животных, подвергнутых ТГЧ-облучению на указанных частотах. Известно, что кортикотропин регулирует продукцию глюкокортикостероидов корой надпочечников [12]. Экспериментальные исследования показали, что ТГЧ-излучение на частотах МСИП оксида азота 150 + 0,75 ГГц белых крыс самцов способно предотвращать повышение уровня кортикостероидов при облучении до начала действия стрессора, то есть полученные данные указывают на ограничение активности гипоталамо-гипофизарно-надпочечниковой оси стрессорной реакции [9], что морфологически выражается в отсутствии делипи-дизации коры надпочечников у животных, подвергнутых ТГЧ-воздействию на фоне острого и длительного стресса.
Важную роль в регуляции микроциркуляции играет также симпато-адреналовая ось стрессорной реакции. Гиперкатехоламинемия вызывает спазм сосудов и ишемию ряда органов [12], что и было нами обнаружено у животных в состоянии острого и длительного стресса. Проведенные исследования показали, что при облучении животных, находящихся в состоянии острого иммобилизационного стресса, электромагнитными волнами терагерцового диапазона на частотах оксида азота 150 + 0,75 ГГц происходит статистически достоверное уменьшение концентрации катехоламинов в крови. Это свидетельствует об ограничении активности симпатоадреналовой оси стрессорной реакции [9].
Нормализацию внутрисосудистого компонента микроциркуляции у животных в состоянии острого и длительного стресса под влиянием терагерцовых волн указанной частоты можно объяснить аутокринным и паракринным механизмами действия оксида азота в системе форменных элементов крови (в частности тромбоцитов) [2].
Паракринные эффекты оксида азота, продуцируемого эндотелием оксида азота, объясняют нормализацию сосудитого компонента микроциркуляции, в частности тонуса сосудов [9].
Положительное влияние электромагнитного излучения на частотах оксида азота на нарушения внесо-судистого компонента микроциркуляции и структуры тканей реализуется, прежде всего, через изменение процессов липопероксидации. Показано, что при воздействии на животных, находящихся в состоянии острого иммобилизационного стресса, электромагнитными волнами терагерцового диапазона на частотах оксида азота 150,176-150,664 ГГц происходит нормализация процессов липопероксидации и активности антиоксидантов. Это проявляется в снижении концентрации токсических промежуточных продуктов перекисного окисления липидов – малонового диальдегида и гидроперекисей липидов. При воздействии терагерцового излучения на частотах молекулярного спектра излучения и поглощения оксида азота 150+0,75 ГГц в течение 30 минут наблюдается эффективная нормализация активности антиоксидантной системы – её ферментного и неферментного звеньев, что выражается в нормализации активности супероксиддисмутазы и каталазы в эритроцитах и восстановлении количества общих сульфгидрильных групп и витамина Е в сыворотке крови до уровня интактных животных [9].
Таким образом, электромагнитное излучение терагерцового диапазона на частотах молекулярного спектра излучения и поглощения оксида азота 150+0,75 ГГц обладает выраженным гистопротектор-ным действием на ряд органов, предохраняя ткани от повреждающего действия метаболитов стресс-реализующих систем и стимулируя процессы репарации. Вероятно, влияние излучения указанной частоты на тканевой метаболизм опосредуется через систему оксида азота и другие сопряженные с ней периферические стресс-лимитирующие системы.
Список литературы Влияние электромагнитного излучения терагерцового диапазона частотой молекулярного спектра оксида азота 150+0,75 ГГц на морфофункциональные нарушения микроциркуляции у белых крыс в состоянии острого и длительного стресса
- Киричук, В.Ф. КВЧ-терапия./В.Ф. Киричук, Т.В. Голова-чева, А.Г. Чиж. -Саратов: Изд-во СГМУ, 1999. -360 с.
- Электромагнитное излучение терагерцового диапазо-на на частотах оксида азота в коррекции и профилактике нарушений функциональной активности тромбоцитов у белых крыс при длительном стрессе/В.Ф. Киричук, А.Н. Иванов, О.Н. Антипова и др.//Цитология. -2007. -Т. 49. -№6. -С. 484-490.
- Аппарат для лечения электромагнитными волнами крайне высоких частот/О.В. Бецкий, А.П. Креницкий, А.В. Майбородин, В.Д. Тупикин. -Патент «Роспатента» на полезную модель №50835 от 27 января 2006.
- Половые различия адренокортикальной чувствительности и устойчивости к цереброваскулярным повреждениям у крыс при сильном стрессе/Т.Г. Анищенко, Г.Е. Брилль, Т.П. Романова, Н.Б. Игошева//Бюлл. эксперим. биол. мед. -1992. -Т. 114. -№ 10. -С. 353.
- Афанасьев, Ю.И. Гистология, цитология и эмбриология/Ю.И. Афанасьев, С.Л. Кузнецов, Н.А. Юрина. -М.: Медицина, 2004. -765 с.
- Колдышева, Е.В. Ультраструктурная реорганизация коры надпочечников при экстремальных воздействиях (общей гипоксии, гипертермии и генетически детерменирован-ных нарушениях метаболизма)/Автореф. дис. д-ра биол. наук/Е.В. Колдышева; НИИ региональной патологии и пато-морфологии СО РАМН. -Новосибирск, 2009. -48 с.
- Патологическая физиология/Н.Н. Зайко, Ю.В. Быць, А.В. Атаман и др. -Киев: «Логос», 2007. -640 с. 8. Киричук, В.Ф. Дисфункция эндотелия/В.Ф. Киричук, П.В. Глыбочко, А.И. Пономарева. -Саратов: Изд-во СГМУ, 2008. -112 с.
- Механизм действия терагерцовых волн на частотах оксида азота с физиологической точки зрения/В.Ф. Киричук, А.Н. Иванов, А.А. Цымбал, Е.В. Андронов//Миллиметровые волны в биологии и медицине. -2009. -№ 1-2. -С. 47-55.
- Манухина, Е.Б. Стресс-лимитирующая система оксида азота/Е.Б. Манухина, И.Ю. Малышев//Рос. физиол. журнал им. И.М. Сеченова. -2000. -Т. 86. -№. 10. -С. 1283-1292.
- Endotoxin stimulates an endogenous pathway regulating corticotrophin-releasing hormone and vasopressin release involving the generation of nitric oxide and carbon monoxide/I. Kostoglou-Athanassiou, A. Costa, P. Navarra et al.//J. Neuroimmunol. -1998. -V. 86. -P. 104-109.
- Киричук, В.Ф. Регуляция функций организма. Гуморальная регуляция/В.Ф. Киричук, А.Н. Иванов. -Саратов: Изд-во СГМУ, 2008. -99 с.


