Влияние электромагнитного излучения УВЧ-диапазона на структурообразовательные свойства бактериального липополисахарида
Автор: Брилль Г.Е., Егорова А.В., Бугаева И.О., Дубовицкий С.А., Власкин С.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Микробиология
Статья в выпуске: 4 т.9, 2013 года.
Бесплатный доступ
Цель: исследовать влияние низкоинтенсивного электромагнитного излучения на процесс дегидратационной самоорганизации бактериального липополисахарида. Материал и методы. Для изучения процесса структуро-образования бактериального липополисахарида использовался метод клиновидной дегидратации, основанный на исследовании структурного следа (фации), формирующегося при высыхании капли препарата в стандартных условиях. Имидж-анализ фаций включал их качественную характеристику, а также расчет количественных показателей с последующей статистической обработкой. Результаты. Низкоинтенсивное электромагнитное излучение частотой 1 ГГц, плотностью мощности 0,1 мкВт/см2, воздействующее в течение 10 мин, приводит к изменениям в суспензионной системе «ЛПС — физиологический раствор», которые отражаются на кинетике структурообразования. Заключение. Частота 1 ГГц соответствует естественной частоте колебаний водных кластеров, и предположительно влияние УВЧ на структурообразование ЛПС опосредуется через изменение состояния водно-солевого окружения. В этих условиях изменяются гидратационные свойства водных молекул и, возможно, свойства гидрофобных и гидрофильных областей в молекуле ЛПС, что может отразиться на способности молекул токсина образовывать агрегаты. В свою очередь, модификация структуры липополисахарида может повлечь за собой изменение его токсических свойств.
Бактериальный липополисахарид, структурообразование, увч-излучение
Короткий адрес: https://sciup.org/14917811
IDR: 14917811
Текст научной статьи Влияние электромагнитного излучения УВЧ-диапазона на структурообразовательные свойства бактериального липополисахарида
Адрес: 410012, Саратов, ул. Б. Казачья, 112.
Тел.: 89172106980
-
А) фрагменты. Его влияние на макроорганизм проявляется в стимуляции лейкоцитов, тромбоцитов и эндотелиальных клеток, усилении продукции интерлейкинов, фактора некроза опухолей-альфа и ряда других медиаторов, в активации системы комплемента и факторов свертывания крови, что может заканчиваться развитием диссеминированного вну-
- трисосудистого свертывания крови, эндотоксинового шока и острой полиорганной недостаточности [1, 2].
Патогенные свойства ЛПС не только зависят от его химической структуры, но в значительной мере определяются характером пространственной организации надмолекулярных комплексов, образуемых молекулой ЛПС с различными компонентами биожидкостей [3].
Поиск возможностей ослабления патогенных эффектов бактериального ЛПС является актуальной задачей. Обычно для снижения токсичности ЛПС применяются различные химические вещества (катионные амфифильные молекулы, синтетические пептиды, полиамины, нетоксичный полисахарид хитозан), уменьшающие патогенное действие ЛПС в результате образования с ним макромолекулярных комплексов [4, 5, 6]. В настоящее время доказано модифицирующее влияние низкоинтенсивного лазерного излучения красной и фиолетовой областей спектра на процесс структурообразования бактериального ЛПС в водной суспензии и физиологическом растворе натрия хлорида [7]. Однако изменение способности ЛПС к самоорганизации путем образования макромолекулярных комплексов при воздействии электромагнитного излучения ультраволновой части спектра до настоящего времени не изучено.
Цель: изучение модифицирующего влияния низкоинтенсивного электромагнитного излучения с частотой 1 ГГц на структурообразовательные свойства бактериального липополисахарида.
Материал и методы. В работе использовался липополисахарид E.coli 055: В5 (фирма Sigma, США). ЛПС разводили ex tempore в 0,9% растворе натрия хлорида (20 мг/мл). Приготовленную суспензию (2 мл) делили на 2 пробы: одна являлась контролем, а другая в течение 10 мин подвергалась электромагнитному воздействию (частота 1 ГГц, плотность мощности 0,1 мкВт/см2) с помощью аппарата «Акватон-2» (производитель — НПП «Телемак», Саратов, Россия). Раструб излучателя помещался на расстоянии 10 см от облучаемого объекта.
Для изучения процесса спонтанного структуро-образования ЛПС использовался метод клиновидной дегидратации [8], основанный на исследовании структурного следа (фации), формирующегося при высыхании капли препарата в стандартных условиях. 1 мкл исследуемой суспензии (контрольная проба) помещался на сухое, чистое, обезжиренное предметное стекло. Обычно наносились 6–8 капель для сравнительного анализа. Далее предметное стекло с препаратом в строго горизонтальном положении помещали в термостат и высушивали при 37○С в течение 30 мин. Аналогично с контрольными пробами готовились опытные препараты.
После высыхания препараты подвергались микроскопическому исследованию. Применялась световая микроскопия (Zeiss, Germany) с фоторегистрацией структурного следа и сохранением информации в файле компьютера. Имидж-анализ фаций включал их качественную характеристику, а также расчет количественных показателей с последующей статистической обработкой.
При обработке фаций использовалась специальная компьютерная программа, позволяющая рассчитывать следующие параметры: S1 — площадь периферического ободка, нормированная на общую площадь фации; S2— площадь промежуточной зоны, нормированная на общую площадь фации; S3— площадь центральной зоны, нормированная на общую площадь фации; S1/S2 — смещение центра промежуточной зоны относительно центра ободка фации; S2/S3 — смещение центра центральной зоны относительно центра ободка фации. В центральной и промежуточной зонах фации рассчитывались: N — количество гребешков в типичном фрагменте фации; Average size (AS) — средний размер гребешков в типичном фрагменте фации; Entr. — неоднородность поверхности фации в типичном фрагменте; D corr. — корреляционная размерность типичного фрагмента.
Количественные параметры обрабатывались статистически с расчетом средней арифметической (М) и ее ошибки (m) с использованием статистического пакета программ Prizm-4. Достоверность различий средних вычисляли с использованием t -критерия Стьюдента. Различия считались достоверными при р<0,05.
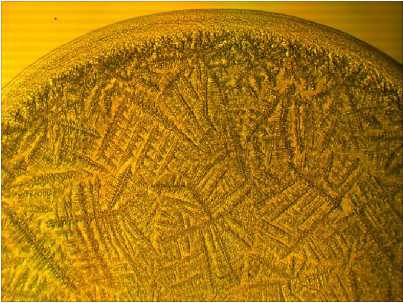
Результаты. Картина фаций, получаемых при дегидратации необлученной суспензии ЛПС в физиологическом растворе, отличалась разнообразием структурных элементов. Здесь четко визуализировались 3 зоны: приподнятый ободок, обрамляющий фацию по периферии (периферическая зона), приободковая (или промежуточная) и центральная зоны (рис. 1).
Ободок отличался малой структурированностью, лишь в отдельных его участках встречались мелкие глыбчатые образования. Приободковая зона занимала небольшую часть площади фации и характеризовалась наличием мелких линейных дендритных и папоротникообразных элементов (рис. 1А). В центральной зоне выявлялись крупные ветвистые образования, содержащие линейную основную ось с отходящими от нее под углом 90○ боковыми ветвями (рис. 1Б).
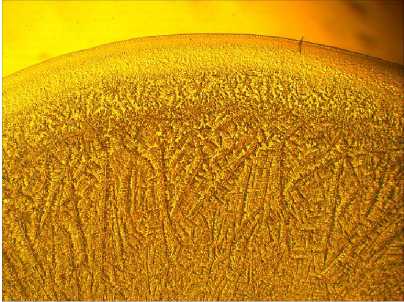
Облучение суспензии ЛПС низкоинтенсивным электромагнитным излучением приводило к заметной модификации процесса структурообразования. При этом отмечались следующие типичные изменения в картине фаций: увеличивалась плотность пространственного распределения элементов в приободковой зоне, утрачивалась их структурная четкость (рис. 1В). Линейные дендритные образования в центральной зоне значительно уменьшались в размерах, так что данная область фации выглядела практически однородной (рис. 1Г). В непосредственной близости от приободковой зоны появлялись радиально ориентированные элементы с волнистой осевой направляющей ветвью и отходящими от нее под разными углами короткими ответвлениями (рис. 1В).
Результаты количественной обработки фаций, получаемых при клиновидной дегидратации суспензии ЛПС в контроле и после УВЧ-облучения, представлены на рис. 2.
Как видно из рисунка, воздействие низкоинтенсивным электромагнитным излучением с частотой 1 ГГц приводило к изменению относительных размеров различных зон фации: уменьшались периферическая и приободковая зоны (p<0,01 и p<0,001 соответственно), в то время как размер центральной зоны увеличивался на 20% (p<0,01). После УВЧ-воздействия примерно в 2 раза возрастало количество гребешковых объектов в центральной и приободковой зонах фации (p<0,05). Однако их средний размер не претерпевал существенных изменений. На этом фоне в 1,2 раза увеличивался показатель Entr, характеризующий структурную неоднородность центральной зоны фации (p<0,05), а также на 32% возрастал показатель Entr приободковой зоны (p<0,02). Достоверно изменялась и структурированность (корреляционная размерность) обеих анализируемых зон (p<0,02).
А
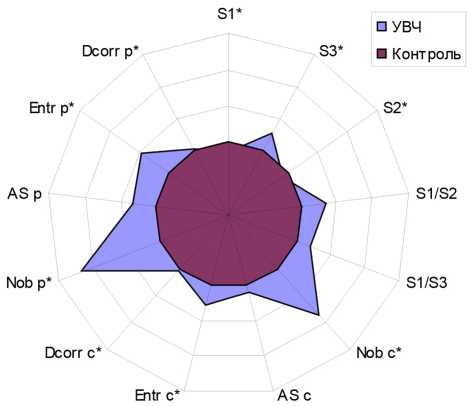
Рис. 2. Изменение количественных параметров фаций бактериального ЛПС после УВЧ-облучения; контроль — 100% (условные обозначения показателей см. в тексте)

Б
В

Г
Рис. 1. Влияние УВЧ-излучения на структурообразование бактериального ЛПС в физиологическом растворе: А — контроль, периферическая и приободковая зоны; Б — контроль, центральная зона; В — УВЧ-излучение, периферическая и приободковая зоны; Г — УВЧ-излучение, центральная зона
Обсуждение. Результаты данных экспериментов свидетельствуют о том, что низкоинтенсивное электромагнитное излучение частотой 1 ГГц, плотностью мощности 0,1 мкВт/см2, воздействующее в течение 10 мин, приводит к изменениям в суспензионной системе «ЛПС — физиологический раствор», которые отражаются на кинетике структурообразования. Частота 1 ГГц соответствует естественной частоте колебаний водных кластеров [9], и предположительно влияние УВЧ на структурообразование ЛПС опосредуется через изменение состояния водно-солевого окружения. В этих условиях изменяются гидратационные свойства водных молекул и, возможно, свойства гидрофобных и гидрофильных областей в молекуле ЛПС, что может отразиться на способности молекул токсина образовывать агрегаты. В свою очередь, модификация структуры липополисахарида может повлечь за собой изменение его токсических свойств. Доказательством подобного предположения является недавнее исследование, в котором облучение бактериального ЛПС светом низкоинтенсивного лазера красной области спектра не только модифицировало процесс спонтанного структурообразо-вания in vitro, но и ослабляло патогенные эффекты ЛПС in vivo, снижая степень активации тромбоцитов, лейкоцитов и эндотелиальных клеток и уменьшая выраженность микроциркуляторных расстройств, развивающихся при попадании эндотоксина в системную циркуляцию [10].
Заключение. Сам факт возможного уменьшения патогенных эффектов бактериального эндотоксина под влиянием физических воздействий, по-видимому, свидетельствует об изменениях архитектоники токсической молекулы, отражающихся на способности ЛПС образовывать надмолекулярные комплексы, определяющие его возможность взаимодействовать с биосубстратом.
Список литературы Влияние электромагнитного излучения УВЧ-диапазона на структурообразовательные свойства бактериального липополисахарида
- Патогенетические механизмы и клинические аспекты действия термостабильного эндотоксина кишечной микрофлоры/Ильина А. Я., Лазарева С. И., Лиходед В. Г. [и др.]//Рус. мед. журн. 2003. Т. 11. С. 126-129
- Dauphinee S. М., Karsan A. Lipopolysaccharide signaling in endothelial cells//Laboratory Invest. 2006. Vol. 86. P. 9-22
- Brandenburg К., Wiese A. Endotoxins: relationships between structure, function, and activity//Curr.Top. Med. Chem. 2004. Vol. 4. P. 1127-1146
- Давыдова B.H., Ермак И.М., Горбач В. И. Взаимодействие бактериальных эндотоксинов с хитозаном: влияние структуры эндотоксина, молекулярной массы хитозана и ионной силы раствора на процесс комплексообразования//Биохимия. 2000. Т. 65. С. 1278-1287
- Ермак И.М., Давыдова В.Н., Горбач В. И. Модификация биологических свойств липополисахарида (ЛПС) при образовании им комплекса с хитозаном//Бюл. эксперим. биол. мед. 2004. Т. 137. С. 430-434
- Ермак И.М., Давыдова В.Н. Взаимодействие бактериальных липополисахаридов с растворимыми белками макроорганизма и поликатионами//Биологические мембраны. 2008. Т. 25. С. 323-342
- Брилль Г. Е., Агаджанова К. В., Правдин А. Б., Пост-нов Д.Э. Влияние лазерного излучения с различным типом поляризации на структурообразовательные свойства бактериального липополисахарида//Фотобиология и фотомедицина. 2011. Т. 8, №2. С. 77-81
- Шабалин В. Н., Шатохина С. Н. Морфология биологических жидкостей человека. М.: Хризостом, 2001. 303 с.
- Sunkari V. G., Aranovitch В., Portwood N., Nikoshkov A. Effect of low-intensity electromagnetic field on fibroblast migration and proliferation//Electromagnetic Biology and Medicine. 2011. Vol. 30, № 2. P. 80-85
- Брилль Г. E., Агаджанова К. В., Гаспарян Л. В., Маке-ла А. М. Лазерное облучение бактериального липополисахарида модифицирует его влияние на микроциркуляцию//Лазерная медицина. 2009. Т. 46, вып. 4. С. 46-49.


