Влияние электростимуляции на морфометрические характеристики реиннервируемой мышцы
Автор: Щудло Н.А., Филимонова Г.Н., Меньщикова И.А., Голобокова И.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2008 года.
Бесплатный доступ
В экспериментальных условиях на 21 взрослой беспородной собаке после перерезки и шва седалищного нерва проводили внутритканевую электростимуляцию сегментов спинного мозга и ствола нерва проксимальнее уровня повреждения. По результатам морфометрии диаметров мышечных волокон и стереологического анализа сделан вывод, что апробированный протокол электростимуляции оказывает отчѐтливое модулирующее действие на тканевую организацию реиннервируемой мышцы, способствуя развитию гипертрофии мышечных волокон; этот эффект сопровождается уменьшением васкуляризации мышцы по сравнению с нестимулированным контролем.
Мышечные волокна, реиннервация, электростимуляция, морфометрия
Короткий адрес: https://sciup.org/142121122
IDR: 142121122
Текст научной статьи Влияние электростимуляции на морфометрические характеристики реиннервируемой мышцы
Влияние электростимуляции на реиннервацию также было предметом исследований. K.C.B.G. Fernandes et al. [9] установили, что при использовании низкочастотной электротерапии для стимуляции регенерации нерва после его передавливания площадь поперечного сечения мышечных волокон реиннервируемых мышц повышалась, а доля соединительной ткани в них снижалась. После перерезки и шва двигательных нервов одни авторы получили данные об улучшении структуры и функции реиннервируемых мышц под воздействием электростимуляции [11], другие сделали вывод о супрессии реиннервации [12].
Цель – выявить эффекты электростимуляции на тканевую организацию и численно-размерный состав волокон реиннервируемой мышцы после перерезки и шва смешанного нерва.
МАТЕРИАЛЫ И МЕТОДЫ
Опыты проведены на 21 взрослой беспородной собаке. У 19 собак под внутривенным барбитуровым наркозом в асептических условиях выполнили полное пересечение и первичный микрохирургический шов седалищного нерва на уровне сред- ней трети бедра. Использовали инструментарий фирмы Aesculap, нить калибра 8/0 на атравматических иглах фирмы Ethicon и 8-кратное увеличение операционного микроскопа фирмы Opton.
В послеоперационном периоде у 4 животных не применяли воздействий на регенераторный процесс (нестимулированный контроль - Control). В опытной группе проводили курсы внутритканевой электростимуляции. Каждая процедура продолжительностью 40 минут состояла из двух частей: первая часть (20 минут) – внутритканевая электростимуляция сегментов спинного мозга, вторая часть (20 минут) – внутритканевая стимуляция ствола нерва проксимальнее уровня повреждения. Соответственно скелетотопии сегментов спинного мозга у собак [1], между остистыми отростками LI-LII, LII-LIII, LIII-LIV позвонков поочередно вводили игольчатый электрод. Его подключали к отрицательному полюсу аппарата, а положительный пластинчатый электрод кольцеобразно накладывали дистальнее уровня повреждения нерва – на область голени. Для внутритканевой электростимуляции [2] седалищного нерва игольчатый электрод отрицательной полярности вводили между большим вертелом бедренной кости и бугром седалищной кости. Положительный пластинчатый электрод также располагали в области голени. Процедуры проводили через день (понедельник, среда, пятница). Режим тока переменный, частота 50 Гц, длительность импульса -0,7 мс, длительность посылки 2 с; соотношение «посылка-пауза» 2:2. Силу тока подбирали индивидуально, до видимого мышечного ответа, в диапазоне от 4 до 20 мА. Для временного торможения двигательной активности собак перед каждым сеансом электростимуляции их вводили в медикаментозный сон с помощью стандартной комбинации минимальных доз препаратов, традиционно используемых в ветеринарии. Для выявления оптимальных режимов внутритканевой электростимуляции животных опытной группы разделили на две подгруппы: в первой через 4 недели после операции проводили курс из 18 сеансов (Stim 1), который заканчивался на сроке 2,5 месяца после операции (n=3); во второй (Stim 2) проводили два курса из 18 сеансов: первый – в те же сроки, что в первой подгруппе, а второй начинали через 6 ме- сяцев после операции и заканчивали в 8,5 месяцев (n=4). Через 12 месяцев после операции животных опытных групп и контрольной выводили из опыта введением летальной дозы барбитуратов.
Поскольку сроки появления первых электрофизиологических признаков реиннервации мышц голени у собак групп 1 и 2 индивидуально варьировали от 3 до 8 недель после операции [4], выполнены дополнительные 3 опыта по модели «предотвращённой регенерации» (Denerv): после резекции 3 см седалищного нерва изолировали его проксимальную и дистальную культи колпачками из биологически инертного материала. Группа Denerv выведена из опыта через 33 дня после операции. Это позволило получить однородные исходные данные по денервированной мышце в срок, непосредственно предшествующий реиннервации и началу сеансов электротерапии.
Содержание, кормление животных, операции и сеансы электростимуляции, а также выведение из опыта осуществляли согласно приказу МЗ СССР № 775 [5].
После эвтаназии для морфологических исследований забирали фрагменты передней большеберцовой мышцы из области брюшка на уроне его верхней, средней и нижней трети, монтировали на промаркированные этикетки площадью поперечного среза и погружали в жидкий азот. Изготавливали поперечные крио-статные срезы, выявляли активность миозиновой АТФ-азы по Padycula, Herman в модификации З. Лойда (3). Препараты оцифровывали на АПК «ДиаМорф» (Россия) и морфометрировали в программе “Medias”. Для двойного контроля использовали данные морфометрии мышц интактных собак (Intact). Статистическую обработку первичных данных осуществляли с использованием программных возможностей MS Excel-2000, вариационные ряды ранжировали с шагом 10,0 мкм и получали гистограммы распределения мышечных волокон по диаметрам.
РЕЗУЛЬТАТЫ
Визуальный анализ препаратов денервированной мышцы свидетельствует о значительной атрофии волокон уже через 1 месяц после резекции седалищного нерва. Кривая распределе- ния по диаметрам волокон по сравнению с интактной значительно смещена влево и вместо плато имеет высокий пик (рис. 1).
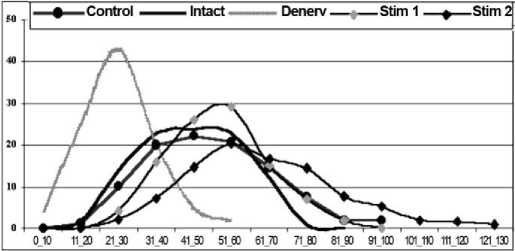
Рис. 1. Кривые распределения волокон передней большеберцовой мышцы собак по диаметрам в интактном состоянии и разных условиях эксперимента. Ось абсцисс – размерный класс волокон (0-10 мкм; 11-20 мкм и т.д.); ось ординат – процентная доля волокон каждого класса
Во всех опытах со швом нерва через год после операции формы и размеры профилей мышечных волокон в криостатных срезах свидетельствуют о компенсации денервационной атрофии, что подтверждают морфометрические данные. В контрольной группе усреднённая кривая распределения мышечных волокон по диаметру практически совпадает с интактной (рис. 1). В подгруппе Stim 1 она смещена вправо и имеет небольшой пик. В подгруппе Stim 2 смещение кривой вправо ещё более выражено, высота её пика снижается, а ширина основания значительно увеличивается. Изучение индивидуальных гистограмм животных этой группы показало, что у одной собаки из трёх распределение мышечных волокон по диаметру бимодально, что, предположительно, можно связать с неодинаковым влиянием электростимуляции на мышечные волокна разных метаболических типов.
По данным стереологического анализа, в контроле по сравнению с интактной мышцей в 1,5 раза уменьшена объёмная плотность микрососудов, в 1,2 уменьшена доля эндомизия и соответственно несколько увеличена объёмная плотность мышечных волокон (рис. 2). В подгруппе Stim 1 объёмная плотность мышечных волокон сопоставима с интактной мышцей, но объёмная плотность микрососудов уменьшена в 2,4 раза, а доля эндо-мизия увеличена в 1,2 раза. В подгруппе Stim 2 объёмная плотность микрососудов меньше, чем в контроле, но больше, чем в подгруппе Stim 1; объёмная доля эндомизия в этой группе наименьшая; даже по сравнению с интактной мышцей она уменьшена в 1,7 раза; объёмная плотность мышечных волокон несколько превышает соответствующий параметр других групп.
В контрольной группе по сравнению с интактной численная плотность мышечных волокон выше на 21 %, но на 38 % меньше численная плотность микрососудов, поэтому индекс васкуляризации снижен в 1,7 раза (рис. 3). В подгруппе Stim 1 численная плотность мышечных волокон прак- тически равна соответствующему параметру интактной мышцы, но численная плотность микрососудов уменьшена в 1,9 раза и в 2 раза уменьшен индекс васкуляризации. В подгруппе Stim 2 численная плотность мышечных волокон меньше, чем в интактной мышце в 1,3 раза, численная плотность микрососудов – в 1,8 раза, индекс васкуляризации уменьшен в 1,4 раза.
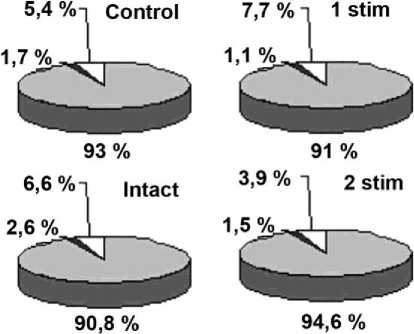
Рис. 2. Объёмные отношения мышечных волокон (серый цвет), эндомизия (белый) и микрососудов (чёрный) в передней большеберцовой мышце оперированных и интактных собак
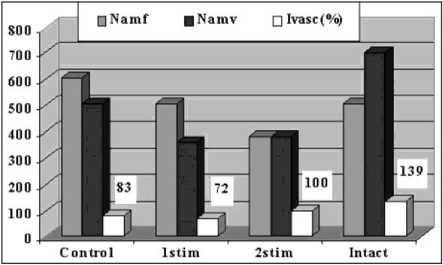
Рис. 3. Численные плотности мышечных волокон (Namf), микрососудов (Namv) и индекс васкуляризации (Ivasc %) в передней большеберцовой мышце оперированных и интактных собак
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты нашего исследования свидетельствуют, что через 1 месяц денервации наступает выраженная атрофия передней большеберцовой мышцы собак. В процессе реиннервации размеры мышечных волокон восстанавливаются даже без применения электростимуляции, но тканевая организация мышцы через год после перерезки и шва нерва не является оптимальной. Во-первых, по сравнению с интактной мышцей объёмная доля микрососудов, их количество в единице площади поперечного сечения мышцы и среднее число, приходящееся на одно мышечное волокно, остаются сниженными. Во-вторых, повышенная объёмная и численная плотности мышечных волокон указывают на увеличение их численности в результате регенерационного миогенеза, который нередко приводит к формированию аномально ветвящихся мышечных волокон или мелких кластеров [6], что не способствует реституции мышцы.
В группе с одним курсом электростимуляции установлено её влияние на толщину мышечных волокон – судя по характеру кривой распределения, в среднем они становятся крупнее, чем в контроле и в интактной мышце. Объёмная и численная плотности мышечных волокон сопоставимы с интактной мышцей, но все параметры васкуляризации снижены не только по сравнению с интактной мышцей, но даже по сравнению с контролем. По-видимому, электро- стимуляция, проводимая в период от 1 до 2,5 месяцев после операции, поддерживает нормои индуцирует гипертрофию переживающих денервацию мышечных волокон, но оказывает тормозящее влияние не только на регенерационный миогенез, но и ангиогенез.
Проведение второго курса электростимуляции в сроки от 6 до 7,5 месяцев после шва нерва усиливает гипертрофию реиннервируемой мышцы. Индекс васкуляризации возрастает за счёт уменьшения численной плотности мышечных волокон, объёмная и численная плотности микрососудов остаются сниженными по сравнению с контролем и особенно интактной мышцей.
ВЫВОДЫ
Апробированный в наших экспериментах протокол электростимуляции оказывает отчётливое модулирующее действие на тканевую организацию реиннервируемой мышцы, способ- ствуя развитию гипертрофии мышечных волокон; этот эффект сопровождается уменьшением васкуляризации мышцы по сравнению с нести-мулированным контролем.


