Влияние кислотно-основных свойств поверхности оксида алюминия на реакционную способность с эпоксидными соединениями
Автор: Ситников П.А., Рябков Ю.И., Рязанов М.А., Белых А.Г., Васенева И.Н., Федосеев М.С., Терешатов В.В.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 3 (15), 2013 года.
Бесплатный доступ
Методом рК-спектроскопии проведено исследование кислотно-основных свойств поверхности полиморфных модификаций оксида алюминия (гиббсит, бемит, γ- Al2O3, корунд). На основании 4рК-модели показано, что только для γ- Al2O3 и γ-AlO(OH) имеются кислотно-основные центры, описываемые2уравнением: –Al–OH + –Al–OH + H+с рК1 ≈ 4. Методами ИК-Фурье-спектроскопии, ДСК, химического анализа проведено исследование физико-химических процессов, протекающих при введении в эпоксиполимерную матрицу полиморфных модификаций оксида алюминия. Показано, что γ – Al2O3 и γ – AlO(OH) за счет наличия более активных поверхностных групп с, являются наиболее реакционно-способными модифицирующими наполнителями эпоксидных олигомеров, вступая с ними в химические реакции.
Адсорбция, кислотно-основные свойства, оксид алюминия, эпоксидные полимеры
Короткий адрес: https://sciup.org/14992618
IDR: 14992618 | УДК: 544.722.1
Текст научной статьи Влияние кислотно-основных свойств поверхности оксида алюминия на реакционную способность с эпоксидными соединениями
Эпоксидные полимеры входят в число наиболее перспективных материалов как в России, так и за рубежом. Это обусловлено низкой стоимостью, широкой вариативностью технологических параметров, малой усадкой, высокой адгезионной способностью, высокими механическими свойствами и др. [1, 2]. При этом свойства эпоксидных полимеров можно легко регулировать как путем подбора состава системы эпоксидный олигомер - отвердитель, так и введением активных (модифицирующих) наполнителей. Активные наполнители способны существенно изменять эксплуатационные характеристики материалов – механическую прочность, теп- ло- и термостойкость, электропроводность за счет образования на границе раздела олигомер – твердая поверхность межфазного адсорбционного слоя [3]. Единого подхода, который позволял бы проводить оценку взаимодействия на межфазной границе, прогнозировать и регулировать такие взаимодействия, до сих пор не существует. На практике вопросы управления адгезионной способностью рассматриваются чаще всего путем эмпирической оптимизации рецептурно-технологических факторов, что не решает проблему в целом на научном уровне. В последнее время все большее внимание уделяется кислотно-основной природе взаимодействия между полимером и наполнителем [4, 5].
Наполнителями для полимерных матриц могут служить практически все существующие в природе и созданные человеком материалы, в том числе сами полимеры, после придания определенных свойств их поверхности. При выборе оптимального сочетания полимера и наполнителя учитываются не только природа частиц, форма, размер и характер их распределения в матрице, но и взаимодействия на границе раздела. Особое значение имеет реакционная способность наполнителей, являющаяся свойством их поверхности, непосредственно связанным с их функциональным химическим составом [6].
Оксиды металлов нашли широкое применение в качестве наполнителей термо- и реактопластов. В представленной работе в качестве модифицирующего наполнителя выбраны различные полиморфные модификации оксида алюминия, химия поверхности которых широко и всесторонне изучена [7–11].
Известно, что алюмокислородные связи подвержены гидролизу:
–Al+ + H 2 O↔–Al–OH + H+.
В результате дальнейшего гидролиза в средах, близких к нейтральной, поверхность Al 2 O 3 может приобретать либо слабый избыточный положительный заряд:
–Al–OH + H 2 O↔ –Al–(OH 2 ) + OH-, либо слабый избыточный отрицательный заряд:
–Al–OH + H 2 O↔ –Al–O- + H 3 O+, где – Al – атом алюминия, который находится на поверхности.
Таким образом, на поверхности имеется набор кислотных и основных центров, причем каждый центр способен присоединять или отщеплять только один ион водорода, гидроксида или другой однозарядный ион.
Кислотно-основные свойства изучаемого материала удобно охарактеризовать с помощью метода рК-спектроскопии, описанном в работе [5]. рК-спектр представляет собой гистограмму, площадь отдельных полос которой равна вероятности того, что характеризующая данный кислотно-основной центр величина рKi лежит в интервале между pKi и pKi + ApK. Расчет рК-спектров проводится на основании экспериментальной кривой титрования, выражающей зависимость Гиббсовой адсорбции ионов водорода на изучаемой поверхности от рН раствора (в расчете на 1 г изучаемого образца): ГрН) = Пь(рН) + nH = cHAVO — cBOH V— " (V0 + V) 0 ,
=+ П н , ммоль/г .
m
Здесь nH0 – количество ионов водорода (ммоль/г), которое адсорбировано на частицах твердой фазы суспензии в точке pH0, отвечающей равенству nb(pH0)=0. Величина nb(pH) рассчитывается из кривой потенциометрического титрования исследуемой суспензии, V0 – объем суспензии, взятой для титрования, концентрация одноосновной сильной кислоты в которой равна CHA, V – объем добавленной щелочи с концентрацией CBOH, m – масса твердой фазы суспензии (г) во взятом образце. Концентрация ионов водорода в уравнении (1) рассчитывается из рН раствора по уравнению [H+]=10-pH.
Интерпретация кислотно-основных свойств оксидных материалов проводится в рамках концепции Дэвиса – Джеймса – Лекки на основе так называемых 2рК и 4рК- моделей.
В 2рК-модели предполагается, что заряд поверхности появляется в результате ионизации поверхностных амфотерных групп –S–OH по следующим реакциям и описывается соответствующими им уравнениями закона действующих масс :
K = [-SOH] ■ [H+]
-
- S-OH 2+ о -SOH + H + (К 1 ), [-SOH + ] , (2)
K = [-SO-] ■ [H+ ]
-
- S-OH о -SO- + H + (К 2 ). [-SOH] . (3)
В тех случаях, когда константы K 1 и K 2 оказываются зависящими от концентрации фонового электролита, вместо модели 2рК используется модель 4рК. 2рК -модель – частный случай 4рК- моде-ли, которая допускает возможность частичной нейтрализации поверхностного заряда ионами индифферентного электролита (например, NaCl ), т.е. образования на поверхности ионных пар:
-
- S-OH 2+ Cl- о -S-OH+H + + Cl- (K 3 ),
K = [SOH] ■ [H + ] ■ [Cl - ]
3 [SOH+Cl-] ,
-
- S-OH + Na+ ^ -S-O-Na++ H + (K 4 ),
_ [SO - Na + ] ■ [H + ]
-
K4 =,
[SOH] ■ [Na+ ] .
Очевидно, большие значения констант K 3 и K 4 соответствуют специфической адсорбции катионов, а малые значения – специфической адсорбции анионов [5].
Цель работы – исследование влияния кислотно-основных свойств поверхности полиморфных модификаций оксида алюминия на химические процессы, протекающие при их введении в эпоксидные соединения.
Объекты и методы исследования
В работе использовался оксид алюминия, полученный методом осаждения из раствора соли и плазмохимическим способом. В качестве исходного соединения для синтеза оксида алюминия использовали гидроксид алюминия, осажденный из концентрированного раствора нитрата алюминия гидроксидом аммония. С целью формирования различных полиморфных модификаций оксида алюминия его гидроксид прокаливался при температурах 300, 650, 1200 °C в течение 1 час., скорость подъема температуры 60 °С/час. По данным электронной микроскопии (рис.1 а), размер зерен оксида алюминия, полученного при изотермической выдержке 650 °С в течение 1 час., варьируется от 20 мкм до 100 нм. Оксид алюминия, полученный плазмохимическим методом [12], прокаливался при температуре 1200 °С в течение 1 час., скорость подъема температуры 60 °С/ час. Для этого образца размер частиц оксида алюминия варьируется от 100 до 10 нм (рис. 1 б).

а)
По данным рентгенофазового анализа (рентгеновский дифрактометр Shimadzu XRD -6000) после обжига при 1200° формируется фаза корунда (α-Al 2 O 3 ). Порошки оксида алюминия, прокаленные при 300, 650°С, и образец плазмохимического оксида алюминия являются рентгеноаморфными. По данным ИК-Фурье спектроскопии (ИК-Фурье спектрометр IR-Prestige-21), в этих образцах идентифицированы полосы поглощения, соответствующие фазам γ-AlO(OH) (300 °С) и γ-Al 2 O 3 (650 °С), плазмохимического оксида алюминия.
Наиболее распространенным методом изучения кислотно-основных свойств (в рамках концепции Бренстеда) оксидных материалов является потенциометрическое титрование их суспензий в водной среде. Использование неводных растворителей перспективно при изучении кислотно-основных свойств в рамках концепции Льюиса. Обычно титрование проводится из кислой области в щелочную (и наоборот) добавлением к суспензии, содержащей известную концентрацию свободной сильной кислоты C HA , заданных аликвот щелочи с концентрацией C BOH и измерением при этом рН дисперсионной среды.
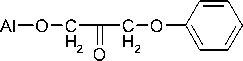
Потенциометрическое титрование осуществлялось в полипропиленовых стаканах. Для предотвращения влияния растворенного углекислого газа титрование проводилось в среде аргона. В качестве модельного соединения для изучения процессов, протекающих при раскрытии эпоксидного цикла, выбран фенилглицидиловый эфир (ФГЭ):

б)
Рис.1. Микрофотографии порошка оксида алюминия, полученного различными способами: а) методом осаждения из раствора соли; б) плазмохимическим методом.
H
O C C CH
H 2
\ / O
который имеет только один вид функциональных групп – эпоксидные, что упрощает исследование взаимодействия функциональных групп на поверхности наполнителя с эпоксидным олигомером.
Результаты и обсуждение
Типичные зависимости n b (pH) , рассчитанные из кривых прямого и обратного потенциометрического титрования суспензии, показаны на примере оксида алюминия, полученного плазмохимическим методом (см. рис. 2). Из него видно, что титрование обратимо, следовательно, образцы в процессе титрования щелочью практически не изменяются. Обратимость титрования означает, что при титровании щелочного раствора кислотой и кислого раствора щелочью получают одинаковые значения рН , в результате чего кривые прямого и обратного титрования совпадают. Из этого следует, что титрование не вызывает необратимых изменений образца.
На рисунках 3–7 представлены рК-спектры полиморфных модификаций оксида алюминия, полученных различными методами.
nb
1,5
Прямое титрование-1
Прямое титрование-2
д Обратное титрование-1
< Обратное титрование-2
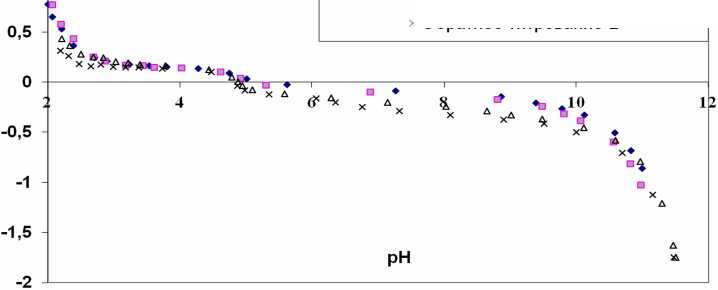
Рис.2. Зависимость относительной адсорбции ионов водорода на поверхности Al2O3, полученного плазмохимическим методом, от рН.
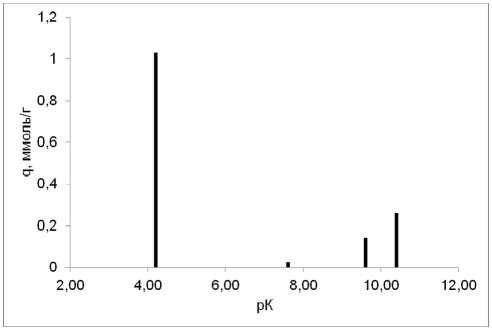
Рис. 3. рК-спектр γ -AlO(ОН), полученного при прокаливании гидроксида алюминия (изотермическая выдержка 300 °С).
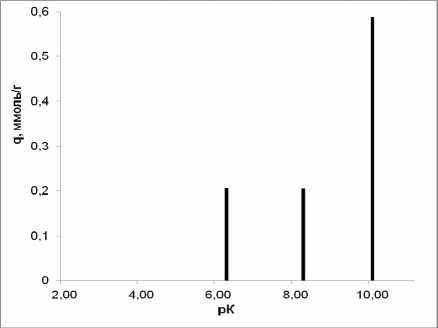
Рис. 5. рК-спектр α -Al 2 O 3 , полученного при прокаливании гидроксида алюминия (изотермическая выдержка 1200 °С).
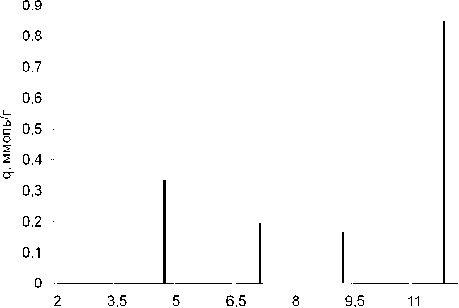
Рис. 4. рК-спектр γ -Al 2 O 3 , полученного при прокаливании гидроксида алюминия (изотермическая выдержка 650 °С).
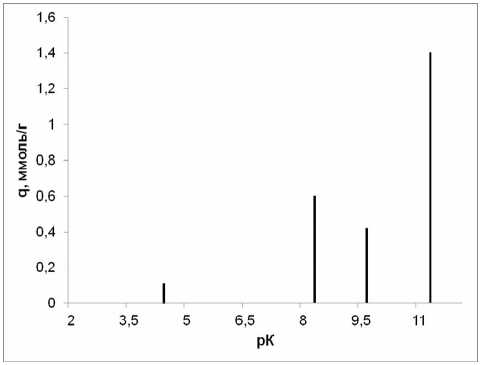
Рис. 6. рК-спектр γ -Al 2 O 3 , полученного плазмохимическим методом.
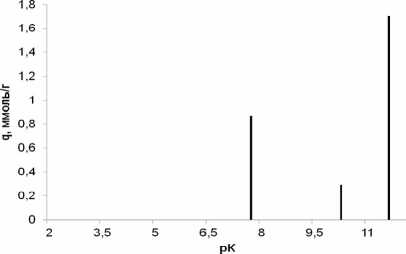
Рис. 7. рК-спектр α -Al2O3, полученного плазмохимическим методом.
Появление пика в области 1650–1600 см-1, отвечающего валентному колебанию связи С=О, позволяет предположить, что раскрытие эпоксидного цикла идет по следующей схеме:
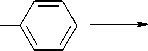
H
Al OH + H2C-CCO
O H2
+
+
2 H+
Полученные нами рК-спектры соответствуют представлениям, сформулированным в работе [11]. В соответствии с описанной выше 4рК- моделью пики всех спектров (рис. 3–7) можно отнести к следующим равновесиям:
–Al–OH 2 + ↔ –Al–OH + H+ (рК 1 ≈ 4)
–Al–OH ↔ –Al–O- + H+ (рК 2 ≈ 10-12)
–Al–OH+ 2 Cl- ↔ –Al–OH+H++ Сl- (рК 3 ≈ 7-8) –Al–OH + Na+ ↔ –Al–O-Na++ H+ (рК 4 ≈ 8-10) .
Величина рК 1 в ряду γ-AlO(ОН)→γ-Al 2 O 3 →α-Al 2 O 3 заметно уменьшается до полного исчезновения у корунда, в то же время соответствующее рК 2 равновесие практически не зависит от предыстории оксида алюминия.
где Al – атом алюминия, который находится на поверхности.
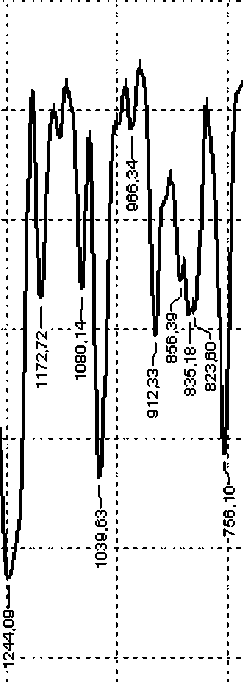
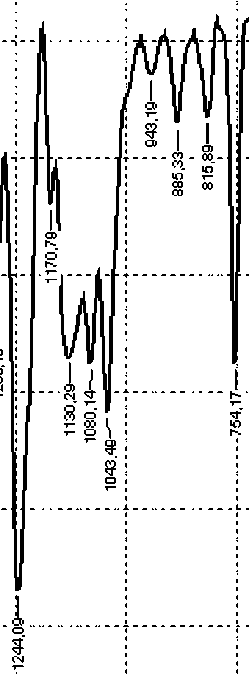
При нагревании системы ФГЭ - γ – Al 2 O 3 (оксид алюминия получен при термическом разложении гидроксида алюминия) (рис. 9 (а-б)) заметно уменьшается интенсивность полос ИК-поглощения эпоксидных групп. В интервале 1150–1060 см-1 также появляются пики, отвечающие алифатическим простым эфирным связям (–С–О–С–). Это говорит о том, что при нагревании системы происходит гомополимеризация фенилглицидилового эфира [13] с образованием простого полиэфира, а активные центры на поверхности оксида алюминия выступают как инициаторы полимеризации:
э
OO
O Al O3 + H 2 C CH R H 2 C CH R
Методом ИК-Фурье-спектроскопии проведено изучение взаимодействия активных центров на поверхности наполнителей с эпоксидными группами на модельных системах:
-
1) ФГЭ – γ-AlO(OH)
-
2) ФГЭ – γ-Al 2 O 3
-
3) ФГЭ – α-Al 2 O 3 .
В системе ФГЭ– γ-AlO(OH) (рис. 8) при нагревании пики, соответствующие колебаниям эпоксидных групп (750–950 см-1), заметно размываются и их интенсивность резко уменьшается, что говорит об исчезновении эпоксидных циклов и полимеризации фенилглицидилового эфира на поверхности оксида алюминия.
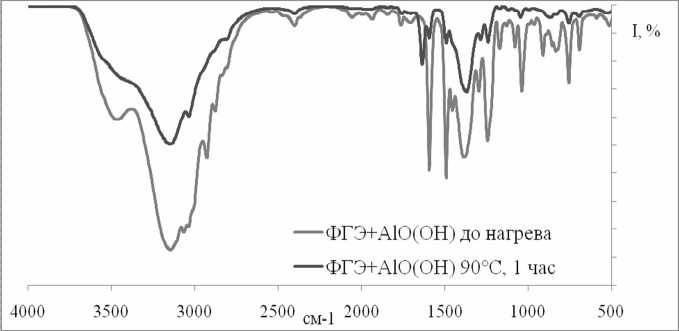
Рис. 8. ИК–Фурье спектр системы ФГЭ - γ – AlO(OH): до нагрева и после нагрева до 120оС и выдержки 60 мин.
O Al O
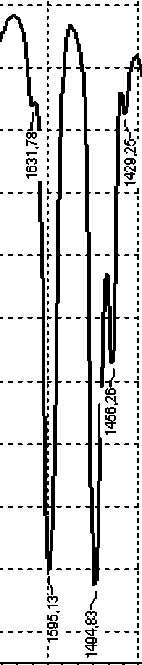
Для системы ФГЭ - γ – Al 2 O 3 (оксид алюминия получен плазмохимическим методом), кроме указанных взаимодействий, проявляется взаимодействие поверхностных гидроксильных групп по типу γ – AlO(OH): появляется пик в области 1640– 1630 см-1) (рис. 9 (в).
Принимая во внимание примерно одинаковое количество поверхностно-активных центров с рК 1 у γ – Al 2 O 3 различного происхождения, можно предположить, что данный эффект связан с меньшим размером частиц оксида алюминия, полученного плазмохимическим методом.
При нагревании системы ФГЭ - α – Al 2 O 3 заметных изменений в спектрах не наблюдается, и интенсивности пиков спектра относительно друг друга остаются без изменений. Это говорит о том, что в присутствии корунда химические процессы не происходят. Поэтому в зависимости от типа оксида алюминия взаимодействие между эпоксисоединением и наполнителем может протекать по различным механизмам:
а) в случае γ – AlO(OH) наблюдается интенсивное химическое взаимодействие эпоксидных групп с поверхностны-
ми гидроксильными группами;
a)
б)
в)
Рис.9. Фрагменты ИК-спектров системы ФГЭ - γ – Al2O3: а) до нагрева; б) после нагрева до 120оС/60 мин; в) фрагмент ИК-спектра системы ФГЭ - γ – Al2O3 (плазмохимический метод).
-
б) в случае γ - Al 2 O 3 – протекает преимущественно гомополимеризация фенилглицидилового эфира.
В результате структурных изменений при переходе из γ-Al 2 O 3 в α-Al 2 O 3 активность поверхности понижается, поэтому при нагревании системы ФГЭ -α – Al 2 O 3 заметных изменений в спектрах не наблюдается, и интенсивности пиков спектра относительно друг друга остаются без изменений.
Методом дифференциальной сканирующей калориметрии изучены тепловые эффекты процесса поликонденсации эпоксидианового олигомера ЭД-20 с изо-метилтетрагидрофталевым ангидридом в присутствии активных добавок – оксидов алюминия различных полиморфных модификаций.
Тепловые эффекты, наблюдаемые при поликонденсации эпоксидного олигомера с изо-МТГФА в присутствии модификаторов
|
Модификатор |
Т начала , С |
Т мах , оС |
Т конечная , о С |
Q, Дж/г |
|
- |
95 |
140 |
165 |
247 |
|
γ – AlO(OH) |
85 |
120 |
160 |
257 |
|
γ – Al 2 O 3 (метод осаждения) |
55 |
105 |
125 |
316 |
|
γ – Al 2 O 3 (плазмохим. метод) |
50 |
105 |
125 |
325 |
|
α – Al 2 O 3 |
90 |
130 |
160 |
253 |
Введение в исходную олигомерную композицию оксидов, у которых относительно более активная поверхность, приводит к увеличению экзотермического пика отверждения эпоксидного олигомера. Из данных таблицы видно, что γ – AlO(OH) и α – Al 2 O 3 изменяют температуру начала реакции поликонденсации незначительно, а γ–Al 2 O 3 понижает температуру начала реакции на 40оС, также повышается величина экзотермического эффекта отверждения.
На рис. 10 представлены результаты хим-анализа определения количества эпоксидных групп в зависимости от температуры и времени выдержки для модельной системы фенилглицидиловый эфир (ФГЭ) - γ – Al 2 O 3 (50:50). Из рисунка видно, что химическое взаимодействие между гидроксильными и эпоксидными группами с раскрытием эпоксидного кольца значительно ускоряется при повышенных температурах; при выдержке в течение 2 час при температуре 160оС эпоксидные группы в системе исчезают практически полностью.
Графическим методом определено, что реакция взаимодействия активных центров на поверхности оксида алюминия с эпоксидными группами имеет второй порядок (рис.11). Для реакций второго порядка характерна линейная зависимость обратной концентрации от времени и константа скорости равна тангенсу угла наклона прямой к оси
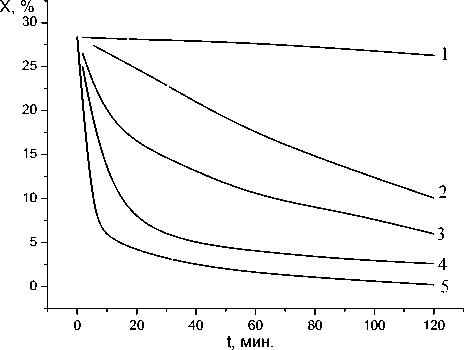
Рис.10. Изменение количества эпоксидных групп в системе ФГЭ - γ – Al2O3 от температуры и времени реакции ( 1 – при 20оС, 2 – при 80оС, 3 – при 100оС, 4 – при 120оС, 5 – при 160оС).
а)
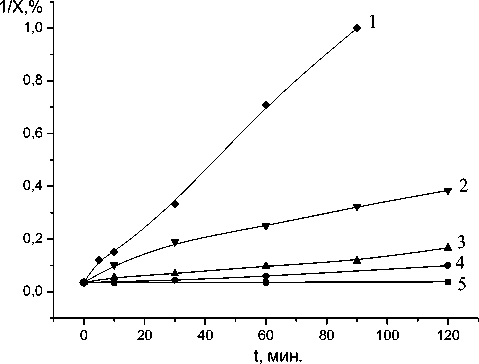
Рис. 11. Зависимость обратной концентрации эпоксидных групп в системе ФГЭ - γ – Al2O3 от времени ( 1 – при 160оС, 2 – при 120оС, 3 – при 100оС, 4 – при 80оС, 5 – при 20оС).
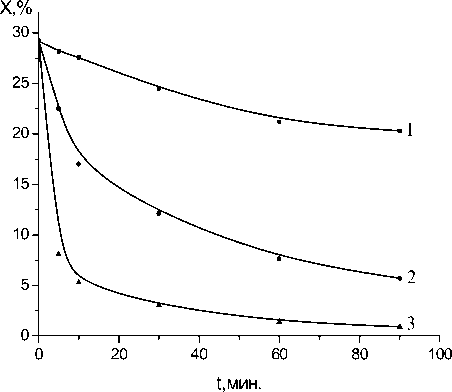
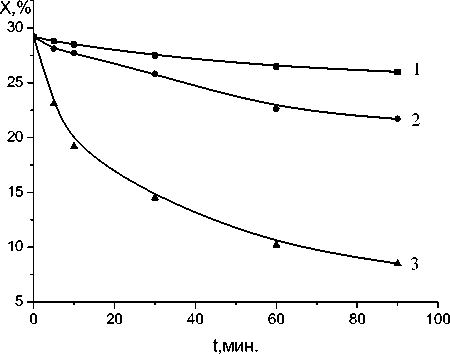
б)
Рис. 12. Зависимость концентрации эпоксидных групп от времени реакции и содержания оксида алюминия в системе ФГЭ - γ – Al2O3 при 100оС (а) и при 160оС (б). ( 1 – 5 масс.%, 2 – 25 масс.%, 3 – 50 масс.%).
времени. Кинетическое уравнение реакции второго порядка:
k t = 1/t * (C o - C)/C o C.
Константы скорости реакции при разных температурах равны:
k 20 = 2 * 10-5 (C-1)
k 80 = 4 * 10-4 (C-1)
k 100 = 1 * 10-3 (C-1)
k 120 = 4 * 10-3 (C-1)
k 160 = 1,2 * 10-2 (C-1).
На рис. 12 представлены зависимости изменения эпоксидных групп в системе ФГЭ - γ – Al2O3 при 100 и при 160оС от содержания оксида алюминия. Наблюдается значительное повышение скорос- ти реакции поликонденсации при увеличении количества оксида алюминия, т.е. при увеличении площади граничного слоя.
Энергия активации процесса взаимодействия ФГЭ с γ – Al 2 O 3 была определена по двум температурам на кинетической кривой по следующему уравнению:
-
- Е а /R=(lnН 1 - lnН 2 )/(1/Т 1 - 1/Т 2 )
-
- Е а /R= =(ln54,5 - ln8,3)/(1/(113+273,2) - 1/(93+273,2)=
-13307,84
Е а = 110,63 кДж/моль.
Заключение
Проведено исследование химического взаимодействия между фенилглицидиловым эфиром
(ФГЭ) в зависимости от кислотно-основных свойств полиморфных модификаций и предыстории оксида алюминия. γ – Al 2 O 3 и γ – AlO(OH) за счет наличия более активных поверхностных групп с рК 1 ≈4, по сравнению с α-Al 2 O 3 , являются более реакционноспособными модифицирующими наполнителями эпоксидных олигомеров, вступая с ними в химические реакции. Выявлена двустадийность процесса – непосредственно химическое взаимодействие ФГЭ с гидроксильными группами, находящимися на поверхности оксида алюминия и гомополимеризация фенилглицидилового эфира, инициированная поверхностно-активными центрами оксида алюминия. Графическим методом определена энергия активации процесса взаимодействия ФГЭ с γ – Al 2 O 3 , которая составила 110,63 кДж/моль. Установлено, что γ – Al 2 O 3 понижает температуру начала реакции поликонденсации эпоксидиановых олигомеров с изо-метилтетрагидрофталевым ангидридом на 30 – 40 °С.
Работа выполнена при поддержке программ фундаментальных исследований УрО РАН, проекты № 12-33-004-АРКТИКА, 12-У-3-1017 и 12-И-3-2005.
Список литературы Влияние кислотно-основных свойств поверхности оксида алюминия на реакционную способность с эпоксидными соединениями
- Михайлин Ю.А. Специальные полимерные композиционные материалы. СПб: Научные основы и технологии, 2008. 660 с.
- Пакен А.М. Эпоксидные соединения и эпоксидные смолы. Л., 1962. 963 с.
- Крыжановский В.К., Бурлов В.В., Паниматченко А.Д., Крыжановская Ю.В. Технические свойства полимерных материалов: Уч.-справоч. Пособие. СПб: Изд-во «Профессия», 2003. 240 с.
- Starostina I.A., Stoyanov O.V., Makhrova N.V., and Deberdeev R.Ya. A New Approach to Determination of the Acid and Base Parameters of the Surface Free Energy of Polymers//Dokl. Phys. Chem. 2011. Vol.436. Part 1. Р. 8-9.
- Рязанов М.А. Кислотно-основные свойства поверхности оксидных материалов//Известия Коми научного центра УрО РАН. 2011. Вып. 2(6). С. 25-29.
- Baldan A. Review of аdhesively-bonded joints and repairs in metallic alloys, polymers and composite materials: Adhesives, adhesion theories and surface pretreatment//J. оf Mater. Sс., 2004. 39. Р. 1-49.
- Morterra C., Magnacca G. Structural, morphological and surface chemical features of Al2O3 catalyst supports stabilized with CeO2//J. Chem. Soc., Faraday Trans., 1996. Vol. 92. P. 5111.
- Голикова Е.В., Иогансон О.М., Федорова Т.Г., Чернобережский Ю.М. Электроповерхностные свойства и агрегативная устойчивость водных дисперсий γ-Al2O3, α -Al2O3 и γ -AlO(OH)//Поверхность. Физика, химия, механика. 1995. № 9. С. 78-89.
- Химия привитых поверхностных соединений/Под ред. Г.В. Лисичкина. М.: Физматлит, 2003. 592 с.
- Рязанов М.А., Дудкин Б.Н. Использование рК-спектроскопии для изучения кислотно-основных свойств золей гидратированного оксида алюминия//Коллоидный журнал. 2004. Т. 66. № 6. С. 807-810.
- James R.O., Parks G.A. Characterization of aqueous colloids by their electrical double-layer and intrinsic surface chemical properties//Surface and Colloid Science, 1982. Vol. 12. P. 116-216.
- Сафронов А.П., Калинина Е.Г., Смирнова Т.А. и др. Самостабилизация водных суспензий наночастиц оксида алюминия, полученных электровзрывным методом//Журнал физической химии. 2010. Т. 8. № 12. С. 1-6.
- Михайлин Ю.А. Конструкционные полимерные композиционные материалы. СПб: Научные основы и технологии, 2008. 822 с.


