Влияние кислоты феруловой на динамику изменения лейкоцитарной формулы при введении циклофосфамида
Автор: Назарова Л.Е., Оганова М.А.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Коррекция экологического неблагополучия. Продукты питания
Статья в выпуске: 1-8 т.12, 2010 года.
Бесплатный доступ
Проведено изучение влияния кислоты феруловой на динамику изменения лейкоцитарной формулы при введении высоких доз циклофосфамида. Установлено, что изучаемое соединение ускоряет регенерацию клеток костного мозга, стимулирует гранулоцитарный и моноцитарный ростки лейкопоэза.
Циклофосфамид, кислота феруловая, лейкоцитарная формула
Короткий адрес: https://sciup.org/148199227
IDR: 148199227 | УДК: 615.31:547.587.52].015.25:615.273.3
Текст научной статьи Влияние кислоты феруловой на динамику изменения лейкоцитарной формулы при введении циклофосфамида
мексидол вводили профилактически за 30 мин до введения циклофосфамида, а деринат через 24 часа. Все вещества вводили однократно внутрибрюшинно.
Изучение мазков крови вели на 5-й, 7-й, 10-й и 14-й дни эксперимента. В мазках крови определяли количество сегментоядерных (СЯ) и палочкоядерных (ПЯ) нейтрофилов, лимфоцитов и моноцитов. Данные представлены в процентах от исходных значений. Статистическую обработку данных вели с использованием t-критерия Стьюдента.
Под влиянием циклофосфамида в контрольной, опытных и группах сравнения на 5-й и 7-й дни эксперимента наблюдалась максимальная депрессия СЯ и ПЯ нейтрофилов и моноцитов. В приготовленных мазках данные виды лейкоцитов не обнаруживались (рис. 1, 2).
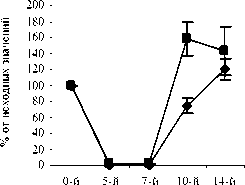
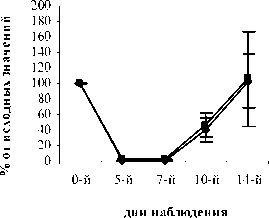
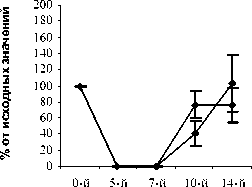
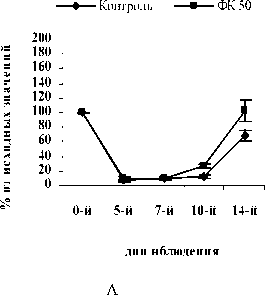
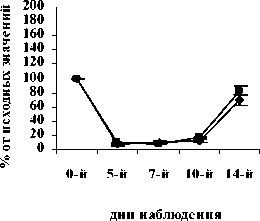
На 10-й день эксперимента в контрольной, опытных и группах сравнения количество СЯ и ПЯ нейтрофилов начало возрастать. В группе контроля количество СЯ и ПЯ достигло значений 75,0±9,46% и 40,2±15,07% от исхода, соответственно. В опытных группах ФК 50 и ФК 100 количество СЯ нейтрофилов достоверно превышало контрольные значения и составило 157,9±20,99% (Р<0,02) и 120,9±13,29% (Р<0,05) от исхода, соответственно (рисунок 1 А,Б). Содержание ПЯ форм составило в группе ФК 50 – 120,3±23,4% (Р<0,05), а в группе ФК 100 – 115,4±10,60% (Р<0,05) от исхода, что достоверно превышает контрольные значения (рис. 2 А, Б). Количество СЯ нейтрофилов в группе ФК 200 достигло 98,5±14,4%, а ПЯ форм 46,9±15,95% от исхода, что не имеет достоверных отличий от контроля (рис. 1 В, рис. 2 В). В группе сравнения, получавшей мексидол, содержание СЯ нейтрофилов на 10-й день эксперимента составило 108,3±5,84%, что не имеет достоверных отличий от исхода и достоверно превышает контроль (Р<0,05) (рис. 1 Г).
Контроль ФК 50
дни наблюдения
Контроль 200 180 160 140 120 100
ФК 100
14-й
0-й 5-й 7-й 10-й дни наблюдения
Контроль ФК 200
дни наблюдения
А
В
200 180 160 140 120 100
20 0
Конт роль

0-й 5-й
Деринат
7-й 10-й 14-й
дни наблюдения
Г Д
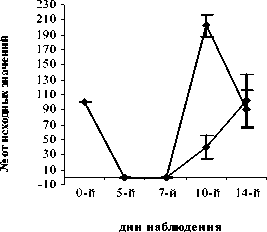
Рис. 1. Влияние кислоты феруловой на динамику изменения содержания сегментоядерных нейтрофилов периферической крови при введении циклофосфамида в сравнении с мексидолом и деринатом: А – кислота феруловая (50 мг/кг); Б – кислота феруловая (100 мг/кг), В – кислота феруловая (200 мг/кг), Г – мексидол (50 мг/кг); Д – деринат (5 мг/кг) (n=6)
Контроль ФК 50
0-й 5-й
7-й 10-й 14-й
Контроль ФК 100
дни наблюдения
дни наблюдения
Конт роль ФК 200
А Б В
Конт роль
Мексидол
дни наблюдения
Контроль
Деринат
Г Д
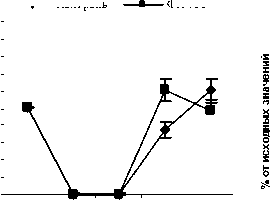
Рис. 2. Влияние кислоты феруловой на динамику изменения содержания палочкоядерных нейтрофилов периферической крови при введении циклофосфамида в сравнении с мексидолом и деринатом: А – кислота феруловая (50 мг/кг); Б – кислота феруловая (100 мг/кг); В – кислота феруловая (200 мг/кг); Г – мексидол (50 мг/кг); Д – деринат (5 мг/кг) (n=6)
Относительно групп опыта ФК 100 и ФК 200 в группе сравнения, получавшей мексидол, содержание СЯ нейтрофилов на 10-й день достоверно не отличалось, а относительно группы опыта ФК 50 полученные результаты были достоверно сниженными (Р<0,05). Содержание ПЯ нейтрофилов в группе сравнения, получавшей мексидол, на 10-й день эксперимента достоверно от контроля и опытных групп не отличалось и составило 76,2±16,69% (рис. 2 Г).
В группе сравнения, получавшей деринат, содержание СЯ нейтрофилов на 10-й день эксперимента составило 197,3±14,0%, что значительно превышало значения, наблюдаемые в контроле (Р<0,001) и группах опыта ФК 100 (Р<0,01) и ФК 200 (Р<0,01) (рис. 1Д). Достоверных отличий содержания СЯ нейтрофилов от группы опыта ФК 50 на 10-й день эксперимента не наблюдалось (Р>0,05). Содержание ПЯ нейтрофилов в группе, получавшей деринат, на 10-й день наблюдения составило 202,5±14,9% от исходных значений, что достоверно выше контроля (Р<0,001) и значений, полученных в группах ФК 100 и ФК 200 (Р<0,01), достоверных различий с группой ФК 50 не зафиксировано (рис. 2 Д).
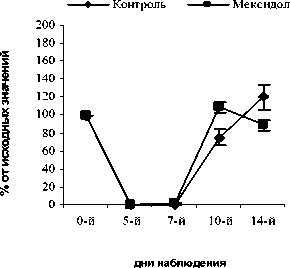
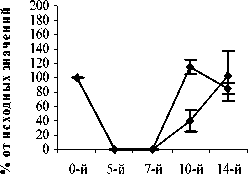
На 14-й день содержание СЯ и ПЯ нейтрофилов в опытных, контрольной и группах сравнения достоверно от исходных значений не отличалось. Динамика изменений общего количества лимфоцитов в исследуемых группах опыта и контроля в целом имела одинаковую тенденцию. Так, в группе контроля количество лимфоцитов на 5-й, 7-й, 10-й дни было достоверно снижено относительно исходных значений (Р<0,001). На 14-й день абсолютное число лимфоцитов повысилось до 68,7±7,38%, но все еще оставалось достоверно сниженным относительно исхода (P<0,01) (рис. 3).
Конт роль
♦ Контроль —■— ФК 100
Конт роль
--■--ФК 200
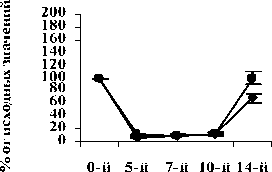
дни наблюедения
В
Контроль
Деринат
Ме кс идол
дни наблюдения
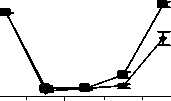
0-й 5-й 7-й 10-й 14-й дни наблюдения
Г Д
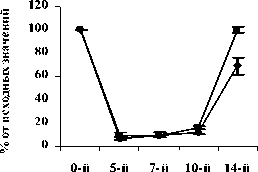
Рис. 3. Влияние кислоты феруловой на динамику изменения содержания лимфоцитов периферической крови при введении циклофосфамида в сравнении с мексидолом и деринатом: А - кислота феруловая (50 мг/кг), Б - кислота феруловая (100 мг/кг), В - кислота феруловая (200 мг/кг);
Г - мексидол (50 мг/кг); Д - деринат (5 мг/кг) (n=6)
Достоверное повышение содержания лимфоцитов в группе ФК 50 было зафиксировано на 10-й день опыта и составило 26,3±3,00% относительно исхода (Р<0,02). В опытной группе ФК 100 достоверных отличий по содержанию лимфоцитов не наблюдалось на всем протяжении эксперимента. В группе ФК 200 содержание лимфоцитов достигло 99,6±9,7% от исхода на 14-й день, что достоверно выше значений контроля (Р<0,05), а от исходных значений достоверно не отличалось (рис. 3 А, Б, В). В группе сравнения, получавшей мексидол, на 5-й, 7-й и 10-й дни содержание лимфоцитов не имело достоверных отличий от контрольных значений. На 14-й день наблюдения содержание лимфоцитов периферической крови восстановилось до исходных значений и составило 100,0±3,30% от исхода, что достоверно превышало контроль (Р<0,01). Достоверных отличий от групп опыта на 14-й день не наблюдалось (рис. 3 Г). В группе сравнения, получавшей деринат, содержание лимфоцитов на 10-й и 14-й дни было достоверно выше контрольных значений и составило 26,2±3,40%
(Р<0,02) и 108,8±10,20% (Р<0,01), соответственно. Относительно групп опыта ФК 100 и ФК 200 полученные результаты на 10-й день наблюдения были достоверно выше (Р<0,05), а от группы ФК 50 достоверных отличий не наблюдалось (рис. 3 Д).
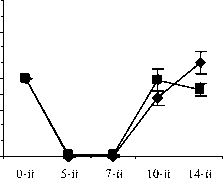
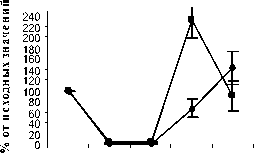
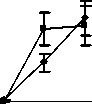
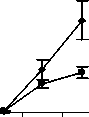
Восстановление содержания моноцитов в контрольной группе наблюдалось на 10-й день и составило 66,3±15,56% от исхода. К 14-му дню содержание моноцитов в контрольной группе полностью восстановилось и достигло 142,3±30,45% от исхода (рис. 4).
♦ Контроль —■—ФК 50
♦ Контроль —■—ФК 200
20 0

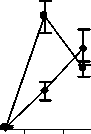
♦ Контроль —■—ФК 100
0-й 5-й 7-й 10-й 14-й дни наблюдения
20 0
0-й 5-й 7-й 10-й 14-й
7-й 10-й 14-й
дни наблюдения
дни наблюдения
А
Контроль
Мексидол
Контроль
Деринат
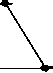
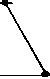
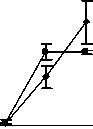
0-й 5-й 7-й 10-й 14-й
0-й 5-й 7-й 10-й 14-й дни наблюдения дни наблюдения
Г Д
Рис. 4. Влияние кислоты феруловой на динамику изменения содержания моноцитов периферической крови при введении циклофосфамида в сравнении с мексидолом и деринатом: А – кислота феруловая (50 мг/кг); Б – кислота феруловая (100 мг/кг), В – кислота феруловая (200 мг/кг); Г – мексидол (50 мг/кг); Д – деринат (5 мг/кг) (n=6)
Различия по сравнению с контролем достигли максимальной величины в группах ФК 50 и ФК 100 на 10-й день опыта, когда содержание моноцитов при этом составило 195,9±28,46% и 231,0±34,20% от исхода, соответственно, что достоверно относительно значений, наблюдаемых в этот период в контрольной группе (Р<0,01). В группе ФК 200 на 10-й день достоверных различий от контроля не зафиксировано. Во всех опытных группах на 14-й день количество моноцитов возвращалось к исходным значениям (рисунок 4 А, Б, В). В группе сравнения, получавшей мексидол, содержание моноцитов на 10-й день было достоверно ниже наблюдаемого в группах ФК 50
(P<0,001), ФК 100 (P<0,001) и ФК 200 (P<0,05) и составило 44,4±6,98% от исхода. На 14-й день эксперимента достоверных отличий от значений, полученных в контрольной и опытных группах, не наблюдалось (рис. 4 Г). В группе сравнения, получавшей деринат, количество моноцитов достоверно от контроля не отличалось на протяжении всего периода наблюдения (рис. 4 Д).
Выводы: профилактическое введение кислоты феруловой в целом не противоречит закономерностям восстановления лейкоцитарной формулы, наблюдаемым после воздействия циклофосфамида. Следует однако отметить, что кислота феруловая в дозах 50 и 100
мг/кг вызывает выраженную стимуляцию гранулоцитарного и моноцитарного звеньев лей-копоэза, о чем свидетельствует увеличение абсолютного числа нейтрофилов и моноцитов. Согласно данным литературы, это может быть связано с цитопротекторной активностью в отношении стволовых клеток костного мозга и увеличением выработки соответствующих колониестимулирующих факторов клетками микроокружения [4]. Мексидол в данном режиме применения демонстрировал схожую как качественно, так и количественно динамику восстановления лейкоцитарной формулы при введении циклофосфамида. Деринат способствовал регенерации гранулоцитов периферической крови, что соответствует литературным данным о механизме гемостимулирующего действия данного препарата. Необходимо отметить, что результаты, полученные при профилактическом применении кислоты феруловой в дозе 50 мг/кг, достоверно не отличаются от таковых в группе, получавшей деринат, по критерию воздействия на гранулоцитарное и лимфоцитарное звенья лейкопоэза. Восстановление моноцитарного звена на фоне действия кислоты феруловой стимулируется достоверно более выраженно.
Список литературы Влияние кислоты феруловой на динамику изменения лейкоцитарной формулы при введении циклофосфамида
- Дыгай, А.М. Гемостимулирующие свойства пантогематогена в условиях миелосупрессии, вызванной цитостатиками/А.М. Дыгай и др.//Эксперим. и клинич. фармакология. 2000. Т.63, №6. С. 34-36.
- Гершанович, М.П. Осложнения химио-и гормонотерапии злокачественных опухолей/М.П. Гершанович. -М.: Медицина, 1982. 224 с.
- Гольдберг, Д.И. Гематология животных/Д.И. Гольдберг, Е.Д. Гольдберг Томск, 1973. 213 с.
- Пат. 4687761 США, МКИ Ф 61 К 31/705. Pharma-ceutical cjmposition for immunity and decreasing side effects of acticancer chemoterapy//Liu J. (США). -№ 468776: заявл. 09.05.85; опубл. 18.08.87. -10 с.


