Влияние комбинации дистанционого гама-облучения и антиоксидантного препарата на показатели эндогеной интоксикации в условиях экспериментального опухолевого роста
Автор: Зорькина А.В., Скопин П.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (33), 2009 года.
Бесплатный доступ
Изучена возможность коррекции эндотоксикоза на модели перевиваемого холангиоцеллюлярного рака у крыс на фоне дистанционного гамма-облучения с помощью различных режимов введения производного оксиникотиновой кислоты ЛБК-149, обладающего антиоксидантным действием. Наибольшая терапевтическая эффективность отмечена при комбинации дистанционного гамма-облучения с последующим курсовым в/м введением соединения ЛБК-149, по сравнению с облучением без фармакологической коррекции или предварительным введением препарата. Применение ЛБК-149 (100 мг/кг) через 10 сут после облучения позволило увеличить дозу общего лучевого воздействия до 5 Гр без нарастания признаков эндотоксикоза в организме опухоленосителя.
Перекисное окисление липидов, антиоксиданты, перевиваемый холангиоцеллюлярный рак рс-1, лучевая терапия
Короткий адрес: https://sciup.org/14055154
IDR: 14055154 | УДК: 615.27:
Текст научной статьи Влияние комбинации дистанционого гама-облучения и антиоксидантного препарата на показатели эндогеной интоксикации в условиях экспериментального опухолевого роста
Полностью решить проблему девитализации опухоли без столь мощного фактора, как лучевая терапия, на современном этапе развития онкологии не представляется возможным. При этом основной задачей повышения эффективности воздействия является достижение излечения при минимальном риске развития лучевых реакций и осложнений [1].
В многочисленных исследованиях было показано, что ионизирующая радиация способствует образованию свободных радикалов и приводит к инициации цепной реакции окисления в присутствии кислорода. Образующиеся в мембране клеток пероксиды тормозят инициацию синтеза ДНК и приводят к потере пролиферации [5, 6]. Кроме того, необходимо иметь в виду, что лучевая терапия в онкологии проводится у больных СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2009. №3 (33)
на фоне уже стимулированного злокачественной опухолью процесса перекисного окисления липидов (ПОЛ) [2, 7].
Естественно предположить, что применение препаратов с антиоксидантным действием будет способствовать «гашению» инициированных лучевым воздействием свободных радикалов и уменьшать интенсивность ПОЛ в здоровых тканях, то есть будет препятствовать развитию лучевых осложнений [3, 4]. Однако при этом появляется вероятность снижения эффективности противоопухолевой лучевой терапии за счет антиоксидантных эффектов в опухолевых клетках.
Целью работы явилось исследование влияния производного оксиникотиновой кислоты с лабораторным шифром ЛБК-149, синтезирован- ного в ВНЦ БАВ, обладающего антиоксидантным действием, в сочетании с дистанционным γ-облучением, на некоторые показатели эндогенной интоксикации, свободнорадикальных процессов и весовые показатели опухоли в условиях экспериментального злокачественного роста.
Материал и методы
Эксперименты проведены на 83 белых нелинейных крысах-самцах, в возрасте 2,5 мес, средней массой 150–160 г, содержащихся в стандартных условиях, в виварии ГОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва». В качестве модели злокачественной опухоли использован штамм холангиоцеллюлярного рака крыс РС-1 (получен из опухолевого банка НИИ ЭДиТО РОНЦ им. Н.Н. Блохина РАМН).
В исследование включено 7 групп животных: 1-я (n=12) – здоровые животные, 2-я (n=11) – крысы с перевитой опухолью без воздействий, 3-я (n=11) – крысы с опухолью, получавшие дистанционное γ-облучение на установке АГАТ–Р1 (60Со) в дозе 3 Гр, однократно на 20-е сут роста опухоли, 4-я (n=10) – крысы с опухолью, которым вводился ЛБК-149 в дозе 100 мг/кг однократно внутрибрюшинно за 2 ч до дистанционного γ-облучения в дозе 3 Гр («профилактический режим»), 5-я (n=12) – крысы, получавшие ЛБК-149 в дозе 100 мг/кг внутримышечно (1 раз в день) с 20-х по 37-е сут роста опухоли после однократного γ-облучения в дозе 3 Гр («лечебный режим»), 6-я (n=11) – крысы, получавшие γ-облучение в дозе 3 Гр на 20-е сут роста опухоли с последующим введением ЛБК-149 в дозе 100 мг/кг с 31-х по 37-е сут внутримышечно 1 раз в день, 7-я (n=16) – крысы, получавшие ЛБК-149 (100 мг/кг) с 31-х по 37-е сут роста опухоли после облучения в дозе 5 Гр на 20-е сут.
Животных забивали путем декапитации после внутрибрюшного введения раствора тиопентала натрия в дозе 50 мг/кг на 38-е сут после перевивки опухоли. В плазме, эритроцитах, гомогенатах печени, почек, ткани сердца, а также ткани опухоли определяли содержание промежуточного продукта перекисного окисления липидов – малонового диальдегида (МДА)
и железом индуцированного МДА (Fe-МДА), отражающего резерв ПОЛ, по реакции с тио-барбитуровой кислотой (ТБК) (Конюхова С.Г., 1989), рассчитывали антиокислительную активность (АОА) (Клебанов Г.И., 1999), резерв липидов для перекисного окисления (РЛПО), определяли активность ферментов антиокис-лительной защиты – каталазы (Королюк М.А., 1988) и супероксиддисмутазы (СОД) (Чевари С., 1990). Содержание глюкозы определяли глюко-оксидазным методом (Меньшиков В.В., 1987). Для оценки степени эндогенной интоксикации определяли индекс лейкоцитарной интоксикации (ИЛИ), общую (ОКА) и эффективную (ЭКА) концентрации альбумина, резерв связанного альбумина (РСА), индекс токсичности (ИТ), проницаемость мембран эритроцитов (Розенко Л.Я., Сидоренко Ю.С., 1999). Оценивали массу опухоли и индекс массы опухоли (ИМО), рассчитанный как отношение массы опухоли к массе животного-опухоленосителя и выраженный в процентах, а также индекс торможения роста опухоли, рассчитанный по формуле ИТРО = (mоп контр. - mоп опыт )/ mоп контр × 100 %, где m – масса опухоли.
Статистическая обработка результатов исследований проведена с помощью t-критерия Стьюдента с использованием программ «Microsoft Office Excel», «Primer of Biostatistics for Windows» version 4.03 (1998). Различия между группами считали значимыми при р<0,05.
Результаты и обсуждение
Установлено, что рост холангиоцеллюляр-ного рака РС-1 приводил к развитию синдрома эндогенной интоксикации, о чем свидетельствовали показатели лейкоцитарной интоксикации, индекс токсичности плазмы, эффективной и общей концентрации альбумина и РСА, а также уровня сахара в крови. У крыс с опухолью наблюдалась активация процессов ПОЛ по сравнению с интактными животными, о чем судили по возрастанию содержания МДА в плазме крови, ткани печени, почек и миокарда и снижению активности каталазы. В ткани опухоли выявлена низкая активность процессов липопероксидации.
Дистанционное гамма-облучение в дозе 3 Гр на 20-е сутки роста РС-1 способствовало сниже-
А.В. ЗОРЬКИНА, П.И. СКОПИН
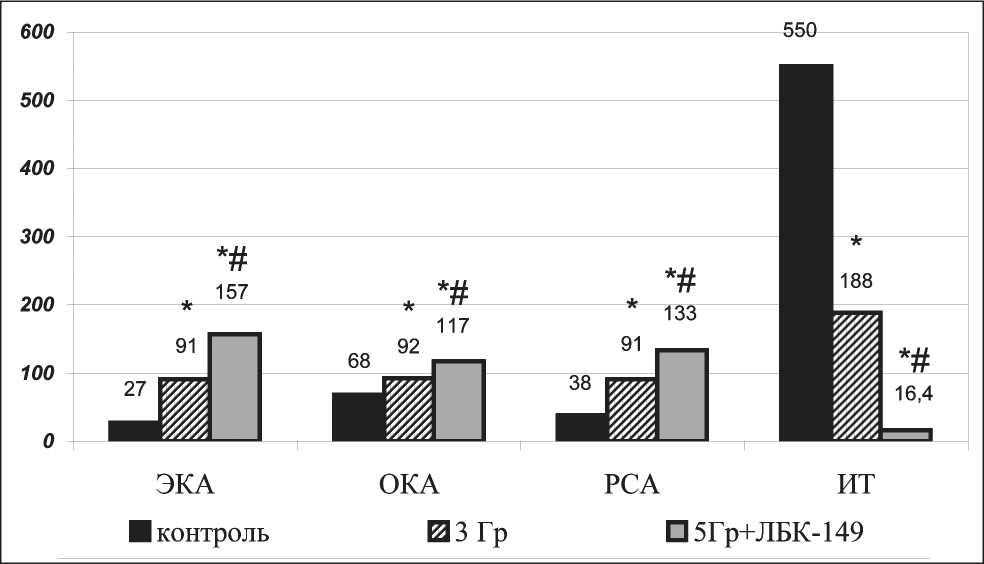
Рис. 1. Некоторые показатели эндогенной интоксикации у подопытных животных на фоне роста холангиоцеллюлярного рака РС-1 в % к интактной группе животных (* – р<0,05 по отношению к контролю, # – р<0,05 по отношению к группе, получавшей монооблучение 3 Гр)
нию массы опухоли более чем в 2 раза, ИТРО составил 54,28 ± 0,74 % (таблица). Отмечена нормализация ЭКА и ОКА, резерва связанного альбумина при снижении индекса токсичности (рис. 1). Однако в крови наблюдалось развитие нормохромной анемии, выраженной абсолютной лейкопении и повышение уровня гемолиза. В тканях печени, почек и сердца активация процессов ПОЛ носила более выраженный характер, чем у животных контрольной группы, уровень МДА повышался соответственно на 216, 147 и 23 % (р<0,001), при снижении активности каталазы. На этом фоне в ткани опухоли резко активировались реакции свободно-радикального окисления – в 3,2 раза возрастало содержание МДА, в 2,5 раза упала активность СОД.
Включение в схему лечения соединения ЛБК-149 в дозе 100 мг/кг за 2 ч до облучения («профилактический режим») оптимизировало соотношение изученных показателей липопе-роксидации и антиоксидантной системы, но практически полностью нивелировало противоопухолевый эффект монооблучения (таблица).
Курсовое введение ЛБК-149 в дозе 100 мг/кг с 20-х по 37-е сут роста опухоли после однократного γ-облучения позволило оптимально восстановить равновесие процессов ПОЛ во внутренних органах: снизилось содержание ТБК-активных продуктов, увеличилась активность каталазы по сравнению с монооблучением. Однако применение соединения ЛБК-149
(100 мг/кг) в таком режиме ограничивало анти-бластомный эффект однократного дистанционного γ-облучения (таблица).
Введение ЛБК-149 в дозе 100 мг/кг, в более поздние сроки после облучения (3 Гр) – с 31-х по 37-е сут роста опухоли, позволило достоверно снизить массу опухоли по сравнению с контролем, индекс торможения роста опухоли составил 42 %. При этом выявлено увеличение эффективной концентрации альбумина и снижение индекса токсичности плазмы по сравнению с контролем. Данная схема терапии привела к ограничению уровня МДА в тканях внутренних органов с одновременным повышением активности каталазы по сравнению с монооблучением.
Для повышения противоопухолевой эффективности облучения мы сочли целесообразным увеличить дозу облучения до 5 Гр при сохранении режима введения ЛБК-149 (100 мг/кг) с 31-х по 37-е сутки роста опухоли. Индекс торможения опухоли составил 65 %, при этом отмечено уменьшение эндогенной интоксикации, о чем свидетельствуют существенное повышение ЭКА, РСА, снижение индекса токсичности, увеличение содержания глюкозы в крови по сравнению с группой животных, получавших только облучение в дозе 3 Гр (рис. 1). Одновременно возрастала активность каталазы в ткани печени и почек на 210 % (р<0,001) и 258 % (р<0,001) соответственно, резерв липидов
Таблица
Показатели массы опухоли и ИМО в условиях роста холангиоцеллюлярного рака РС-1 (М±m)
|
Группы животных |
Масса животного, г |
Масса опухоли, г |
ИМО, % |
ИТРО, % |
|
Контроль |
189,8 ± 18,0 |
59,1 ± 5,7 |
31,3 ± 1,6 |
– |
|
3 Гр на 20 сут |
178,8 ± 9,7 |
27,8 ± 7,9* |
13,3 ± 4,4* |
54,3 ± 0,7 |
|
ЛБК-149 (100 мг/кг) + через 2 ч 3 Гр |
181,7 ± 33,0 |
60,0 ± 16,1 |
31,9 ± 3,7 |
– |
|
3 Гр + ЛБК-149 (100 мг/кг) с 20 по 37 сут |
178,3 ± 21,1 |
42,3 ± 4,5* |
25,4 ± 0,5* |
28,1 ± 1,0 |
|
3 Гр + ЛБК-149 (100 мг/кг) с 31 по 37 сут |
212,0 ± 12,4 |
35,2 ± 5,4* |
15,1 ± 2,5* |
41,6 ± 1,7 |
|
5 Гр + ЛБК-149 (100 мг/кг) с 31 по 37 сут |
173,7 ± 24,1 |
21,0 ± 1,5* |
12,8 ± 2,0* |
64,9 ± 0,2 |
Примечание: * – различия статистически значимы по сравнению с контрольной группой (р<0,05).
для перекисного окисления на 43 % (р<0,05), снижался уровень МДА – на 40 % (р<0,001).
Заключение
Рост холангиоцеллюлярного рака РС-1 сопровождался признаками развития синдрома эндогенной интоксикации и активацией свободнорадикальных процессов в крови и тканях экспериментальных животных. Дистанционное γ-облучение приводило к торможению роста опухоли, но при этом отмечалось существенное усиление процессов ПОЛ. Однократное применение соединения ЛБК-149 до сеанса облучения препятствовало противоопухолевой эффективности лучевой терапии. Курсовое введение ЛБК-149 после облучения, хотя и ограничивало активацию процессов липопероксидации в крови и гомогенатах тканей организма, но снижало противоопухолевую эффективность лучевой терапии. Курсовое недельное введение ЛБК-149, через 10 сут после облучения, позволило увеличить дозу общего лучевого воздействия до 5 Гр при снижении эндотоксикоза в организме опухоленосителя по сравнении с группой животных, получавших монооблучение 3 Гр, и без уменьшения противоопухолевой эффективно- сти дистанционного γ-облучения. Полученные результаты указывают на важность соблюдения этапности при использовании антиоксидантов в условиях лучевой терапии злокачественных опухолей для исключения возможности снижения противоопухолевого эффекта.


