Влияние комбинированной химиотерапии у женщин больных раком молочной железы на жесткость общей сонной артерии и показатели пульсовой волны по данным эхо-трекинга
Автор: Заирова Алсу Рафхатовна, Рогоза Анатолий Николаевич, Авалян Ани Ашотовна, Ощепкова Елена Владимировна
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Целью исследования явилось изучение влияния комбинированной химиотерапии у женщин больных раком молочной железы (РМЖ) на показатели артериальной жесткости и пульсовой волны на основе анализа данных ультразвукового исследования общей сонной артерии (ОСА) с применением технологии эхо-трекинг. Материалы и методы. Обследовано 40 женщин больных тройным негативным РМЖ в возрасте от 27 до 75 лет (47,5±12,0 лет) исходно и после проведенной химиотерапии с включением антрациклинов (доксорубицин), таксанов (паклитаксел) и производных платины (цисплатин). Показатели артериальной жесткости (b-индекс жёсткости, Ep-модуль упругости, PWV-скорость пульсовой волны, AC-растяжимость) и пульсовой волны (AI - индекс аугментации) изучены в дистальном отделе ОСА на расстоянии 2 см. от бифуркации на ультразвуковом аппарате Aloka ProSound α7 с применением технологии эхо-трекинг. Результаты. После проведения комбинированной химиотерапии показатели b, Ep и PWV значимо не изменились (9,3±4,3 против 8,9±4,5,р=0,63; 128,73±65,9 против 119,0±69,5 кПа, р=0,29; 6,7±1,5 против 6,3±1,5 м/с, р=0,24 соответсвенно)...
Артериальная жесткость, пульсовая волна, эхотрекинг, химиотерапия, рак молочной железы
Короткий адрес: https://sciup.org/143170048
IDR: 143170048
Текст научной статьи Влияние комбинированной химиотерапии у женщин больных раком молочной железы на жесткость общей сонной артерии и показатели пульсовой волны по данным эхо-трекинга
Сердечно-сосудистые осложнения лекарственной и лучевой терапии, проводимой онкологическим больным, привели к формированию междисциплинарного подхода и созданию нового направления в медицине- кардиоонкологии [1]. В настоящее время систематизированы и проанализированы многочисленные аспекты данной проблемы, выработаны соответствующие рекомендации [1-3]. Тем не менее остаются еще многие нерешенные вопросы на пути оптимизации эффективности и безопасности лечения онкологических больных [4-6].
Большое число исследовательских работ посвящено вопросам кардиотоксичности используемых лекарственных препаратов, поискам и нахождению ранних маркеров поражения сердца с развитием сердечной недостаточности [7-9]. Отсутствие в настоящее время каких-либо общепринятых аналогичных маркеров вазотоксичности, выявляемых инструментальными методами, делает необходимым их поиск [10-13].
Патофизиологическими основами таких осложнений лекарственной терапии онкологических заболеваний как ИБС, связанные с ишемией миокарда нарушения ритма сердца, инсульт и поражения периферических артерий признаются такие механизмы вазотоксичности как повреждение эндотелия, вазоспазм, протромбогенный статус и артериальный тромбоз, ускоренное развитие как атеросклероза, так и артериосклероза [1-5,10-13].
Инструментальное изучение ремоделирования сосудов предполагает необходимость оценки показателей артериальной жесткости и пульсовой волны [14]. В настоящее время в некоторых работах показано повышение жесткости аорты и магистральных артерий, а также показателей отраженной волны в результате проводимой химиотерапии [12,15-19]. Локальная жесткость ОСА рассматривается некоторыми авторами как биомаркер сосудистого повреждения при лучевой терапии [20]. Однако, работы по оценке локальной жесткости ОСА на фоне химиотерапии единичны [21].
Целью явилось изучение влияния комбинированной химиотерапии у женщин больных раком молочной железы (РМЖ) на показатели локальной артериальной жесткости и пульсовой волны на основе анализа данных ультразвукового исследования общей сонной артерии (ОСА) с применением технологии эхо-трекинг.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 40 женщин в возрасте от 27 до 75 лет (47,5±12,0 лет) с гистологически подтвержденным тройным негативным фенотипом РМЖ (отрицательные рецепторы эстрогенов, прогестерона, HER2), которым была проведена комбинированная химиотерапия с включением ан-трациклинов (доксорубицин), таксанов (паклитаксел) и производных платины (цисплатин). Длительность химиотерапии (всего 8 курсов) в зависимости от стадии заболевания (первично операбельный (T1-3N0-1M0) – 22 жен. – 1-я подгруппа) и первично неоперабельный РМЖ (T4NлюбоеM0 и T3N2-3M0) – 18 жен. – 2-я подгруппа) составила 8 (курсы химиотерапии 1 раз в неделю) или 16 (курсы химиотерапии 1 раз в 2 недели) недель, соответственно [22]. Таким образом, кумулятивная доза доксорубицина, паклитаксела и цисплатина за весь период лечения составила 200, 800 и 240 мг/м2 в 1-й подгруппе больных и 320, 1200 и 400 мг/м2 во 2-й подгруппе.
Показатели артериальной жесткости и пульсовой волны изучались на ультразвуковом аппарате Aloka ProSound α 7 с применением технологии эхо-трекинг исходно и сразу же после проведенной химиотерапии, то есть через 2-4 месяца. Оценивались и анализировались следующие параметры:
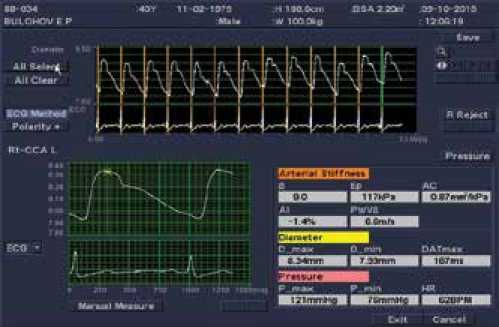
b – индекс жёсткости: b =ln (Ps / Pd) / [(Ds – Dd) / Dd]; Ep – модуль упругости Петерсона: Ep=(Ps – Pd) / [(Ds – Dd) / Dd ] (кПа), AC – растяжимость (податливость): AC=(Ds – Dd) / [4 (Ps – Pd)] (мм2/кПа), PWV β = скорость пульсовой волны (локальная) (м/с), AI - индекс аугментации: AI=DP / PP (%), где Ps – уровень САД, Pd – уровень ДАД, Ds – диаметр артерии в систолу, Dd – диаметр артерии в диастолу, DP – прирост давления вследствие отраженной волны, PP – пульсовое давление.
По протоколу исследования после регистрации уровня АД проводились последовательно по 3 измерения в дистальном отделе правой и левой ОСА на расстоянии 1,5-2 см. от бифуркации при синхронизации с ЭКГ. Ворота отслеживания движения стенок устанавливали на границе между интима-медией и адевентицией передней и задней стенок. Рассчитывались средние показатели 10-12 кардиоциклов в каждом измерении. В дальнейшем были рассчитаны средние значения всех изучаемых показателей для обеих ОСА (рис. 1).
|
Таблица 1. Клинико-лабораторная ха |
актеристика женщин больных РМЖ (исходно, до лечения) |
|||
|
Параметры |
Общая группа n= 40 |
1-ая подгруппа n= 22 |
2-ая подгруппа n= 18 |
Р (1-2 подгруппы) |
|
Возраст лет |
47,5±12,0 |
46,6±11,1 |
48.6±13,6 |
нд |
|
ИМТ кг/м2 |
26,2±5,2 |
26,0±5,7 |
26,6±4,7 |
нд |
|
САД мм рт.ст. |
129,5±14,0 |
126,0±12,8 |
134,0±15,3 |
нд |
|
ДАД мм рт.ст. |
79,6±7,2 |
78,2±5,8 |
81,3±8,4 |
нд |
|
ЧСС уд/мин. |
68,0±10,7 |
65,4±7,8 |
70,1±13,0 |
нд |
|
ОХС ммоль/л |
5,5±1,1 |
5,6±1,0 |
5,4±1,2 |
нд |
|
ТГ ммоль/л |
1,2±0,6 |
1,1±0,6 |
1,3±0,7 |
нд |
|
ЛПВП ммоль/л |
1,5±0,4 |
1,6±0,3 |
1,5±0,4 |
нд |
|
ЛПНП ммоль/л |
3,4±1,0 |
3,5±1,0 |
3,3±0,9 |
нд |
|
Глюкоза ммоль/л |
5,4±0,5 |
5,4±0,4 |
5,3±0,6 |
нд |
|
Креатинин ммоль/л |
73,2±10,5 |
71,3±11,2 |
75,7±9,3 |
нд |
|
Гемоглобин г/л |
129,6±20,4 |
126,3±23,6 |
133,0±15,6 |
нд |
|
Эритроциты 1012 /л |
4,7±0,4 |
4,7±0,3 |
4,7±0,4 |
нд |
Рисунок 1. Изображение движения стенки ОСА и рассчитанные параметры локальной артериальной жесткости и пульсовой волны на экране в режиме эхо-трекинг ультразвукового аппарата Aloka ProSound α 7
Статистический анализ проведен с использованием программы Statistica, версия 10.0. Данные для отдельных групп представлены в виде M±STD (таблицы) и M±SE (графики). Анализ динамических изменений и межгрупповых отличий осуществляли при помощи непараметрических критериев Уилкоксона и Манна-Уитни. Статистически значимыми считались различия при p<0,05. Корреляционный анализ проведен с применением коэффициента Спирмена.
РЕЗУЛЬТАТЫ
Клинико-лабораторная характеристика обследованных женщин, больных РМЖ, представлена в Таблице 1.
Женщины в изучаемых подгруппах не отличались по перечисленным параметрам. При анализе имеющихся основных факторов риска ССЗ в целом по общей группе обследованных отмечалось повышение ОХС и ХС- ЛПНП у 23 женщин (58%), избыточный вес у 11 (28%) и ожирение у 7 (18%), гипергликемия у 2 (5%)
Повышение уровня АД выявлено у 12 (30%) человек. При этом у больных с АГ до начала химиотерапии была скорректирована (10 жен.) или впервые назначена (2 жен.) антигипертензивная терапия.
Изученные показатели артериальной жесткости ОСА и пульсовой волны представлены в таблице 2.
При анализе полученных данных выявлено повышение возрастных норм изучаемых показателей b и Ep всего у 14 больных (35%), из них у 9 (23%) наблюдалось повышение независимого от уровня АД индекса жесткости b [23]. Изученные показатели статистически значимо не различались в подгруппах.
Подтверждены общеизвестные взаимосвязи изученных показателей с другими клинико-лабораторными данными [14,24] (табл. 3).
Наиболее тесные взаимосвязи показателей локальной жесткости выявлены с возрастом, уровнем САД и ХС-ЛПНП.
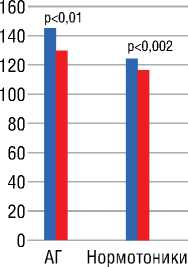
После проведенных курсов химиотерапии во время повторного обследования женщин больных РМЖ обращало на себя внимание в первую очередь снижение уровня САД, которое наблюдалось как у женщин с исходной АГ, принимавших антигипертензивную терапию с 146,5±9,9 до 130,0±14, 6 мм рт.ст. (p<0,01), так и у нормотоников без антигипертензивного лечения c 122,2±7,6 до 115,4±8,3 мм рт.ст. (р=0,002) (рис. 2).
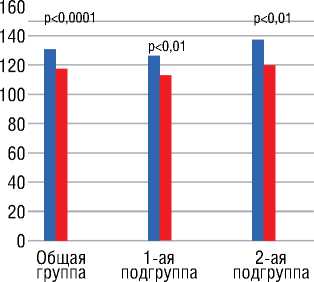
При этом статистически значимое снижение САД наблюдалось как в общей группе, так и в обеих изучаемых подгруппах с разным режимом химиотерапии (рис. 3). Уровень ДАД на фоне химиотерапии не менялся.
Таблица 2. Показатели артериальной жесткости ОСА и пульсовой волны у женщин больных РМЖ (исходно, до лечения)
|
Параметры |
Общая группа n= 40 |
1-ая подгруппа n= 22 |
2-ая подгруппа n= 18 |
Р (1-2 подгруппы) |
|
b |
9,3±4,3 |
9,3±4,5 |
9,2±4,1 |
нд |
|
Ep кПа |
128,73±65,9 |
127,3±68,9 |
130,5±64,1 |
нд |
|
AC мм2 /кПа |
0,72±0,25 |
0,75±0,27 |
0,70±0,20 |
нд |
|
PWV м/с |
6,7±1,5 |
6,6±1,6 |
6,8±1,4 |
нд |
|
AI % |
14,5±11,3 |
13,6±10,3 |
16,1±12,6 |
нд |
Таблица 3. Взаимосвязи показателей локальной жесткости ОСА и пульсовой волны с клиниколабораторными данными у женщин больных РМЖ (исходно, до лечения)
|
Параметры |
b |
Ep кПа |
AC мм2/кПа |
PWV м/с |
AI% |
|
Возраст |
r=0,8 p<0001 |
r=0,8 p<0001 |
r=-0,67p<0001 |
r=0,8p<0001 |
r=0,45 p=003 |
|
ИМТ |
r=0,55 p=0003 |
r=0,56 p=0002 |
r=-0,37 p=02 |
r=0,59p=0001 |
r=0,4 p=01 |
|
САД |
r=0,63 p<0001 |
r=0,73 p<0001 |
r=-0,8 p<0001 |
r=0,7 p<0001 |
r=0,46 p=002 |
|
ОХС |
r=0,46 p=004 |
r=0,50 p=002 |
r=-0,53p=0006 |
r=0,56p=0002 |
r=0,58p=0001 |
|
ХС-ЛПНП |
r=0,57 p=0003 |
r=0,60 p=0001 |
r=-0,61p=0001 |
r=0,65p<0001 |
r=0,62p=0001 |
|
ТГ |
r=0,54 p=0005 |
r=0,56 p=0004 |
r=-0,55p=0004 |
r=0,57p=0002 |
нд |
|
ХС-ЛПВП |
r=-0,3 p=06 |
r=-0,3 p=07 |
r=0,4 p=0,02 |
r=-0,3 p=05 |
нд |
■ Исходно
■ После химиотерапии
■ Исходно
■ После химиотерапии
Рисунок 3. Динамика уровня САД мм рт.ст. у женщин больных РМЖ на фоне химиотерапии (АД клиническое, измеренное во время проведения исследования параметров локальной артериальной жесткости ОСА) (M±SE)
Рисунок 2. Уровень САД мм рт.ст. исходно и после проведенной химиотерапии у женщин с РМЖ с АГ (n=12) и с нормотензией (n=28). (АД клиническое, измеренное во время проведения исследования параметров локальной артериальной жесткости ОСА) (M±SE).
p<0,0004 p<0,01 p<0,05
0 Общая 1-ая 2-ая группа подгруппа подгруппа
■ Исходно
■ После химиотерапии
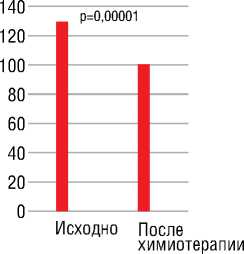
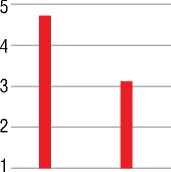
Рисунок 5. Уровень гемоглобина (г/л) (А) и эритроцитов (1012/л) (Б) в крови у женщин больных РМЖ исходно и после химиотерапии (в общей группе). (M±SE)
6 p=0,00001
Исходно После химиотерапии
Рисунок 4. Динамика ЧСС уд/мин. у женщин больных РМЖ на фоне химиотерапии (ЧСС, регистрируемое
во время проведения исследования параметров локальной артериальной жесткости ОСА) (M±SE)
■ Исходно
■ После химиотерапии
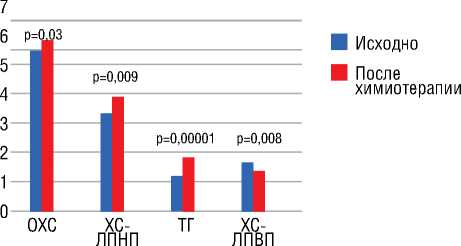
Рисунок 6. Показатели липидного обмена в крови (ммоль/л) у женщин больных РМЖ исходно и после химиотерапии (в общей группе). (M±SE)
Рисунок 6. Показатели липидного обмена в крови (ммоль/л) у женщин больных РМЖ исходно и после химиотерапии (в общей группе). (M±SE)
Также в целом как в общей группе, так и в обеих изучаемых подгруппах с разным режимом химиотерапии во время обследования регистрировалось увеличение ЧСС в сравнении с исходными значениями (рис. 4).
Также значимые изменения после проведенной химиотерапии наблюдались и в лабораторных показателях. Так, значительно снизился уровень гемоглобина и эритроцитов (рис. 5).
А в показателях липидного обмена, наоборот, значимо повысился как ОХС, так и ХС-ЛПНП с ТГ (рис. 6).
Каких-либо значимых отличий в динамике лабораторных показателей в изучаемых двух подгруппах с разным режимом химиотерапии не наблюдалось.
Изучаемые показатели локальной артериальной жесткости ОСА и пульсовой волны после проведенной химиотерапии представлены в таблице 4.
Таблица 4. Показатели артериальной жесткости ОСА и пульсовой волны у женщин больных РМЖ (после химиотерапии) (М±STD)
|
Параметры |
Общая группа n= 40 |
1-ая подгруппа n= 22 |
2-ая подгруппа n= 18 |
Р (1-2 подгруппы) |
|
b |
8,9±4,5 |
9,5±5,0 |
8,2±3,7 |
нд |
|
Ep кПа |
119,0±69,5 |
125,5±76,7 |
111,0±60,9 |
нд |
|
AC мм2 / кПа |
0,87±0,3 |
0,86±0,4 |
0,89±0,4 |
нд |
|
PWV м/с |
6,3±1,5 |
6,3±1,5 |
6,3±1,5 |
нд |
|
AI% |
11,1±10 |
9,8±9,2 |
12,4±11,0 |
нд |
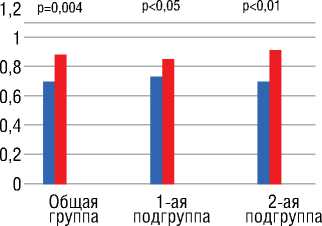
После проведенной химиотерапии наблюдалась тенденция к снижению показателей локальной жесткости ( b , Ep и PWV) (9,3±4,3 против 8,9±4,5, р=0,63;128,73±65,9 против 119,0±69,5 кПа, р=0,29; 6,7±1,5 против 6,3±1,5 м/с р=0,24, соответственно), однако статистически значимую динамику продемонстрировали только AC (растяжимость) (рис. 7) и AI (индекс аугментации).
На примере общей группы значимое повышение растяжимости ОСА с 0,72±0,25 до 0,87±0,3 мм2/кПа (р=0,004) можно расценить как псевдопозитивное, исходя из указанной выше формулы расчета показателя АС, так как оно происходит на фоне снижения уровня САД с 129,5±14,0 до 118,5±14,5 мм рт. ст. (р=0,0001).
Индекс аугментации (AI) у женщин больных РМЖ после проведенной химиотерапии значимо снизился как в общей группе (с 14,5±11,3 до 11,1±10,6%, р=0,009), так и в обеих подгруппах (в 1-ой с 13,6±10,3 до 9,8±9,2%, p<0,05) и (во 2-ой с16,1±12,6 до12,4±11,0%, p<0,01). Учитывая тот факт, что известна обратная зависимость между показателями ЧСС и AI [25], и наличие значимого увеличения ЧСС у женщин больных РМЖ на фоне химиотерапии, был проведен дополнительный анализ – расчет AI 75 (AI, нормированный на ЧСС=75). Данный анализ не выявил значимых изменений AI 75 как в общей группе, так и в обеих подгруппах, хотя и прослеживалась тенденция к снижению этого показателя (у 60% больных показатель AI 75 после химиотерапии был ниже исходного).
Другие изучаемые в рамках данной работы показатели (ИМТ, уровень глюкозы, креатинин) после проведенной химиотерапии не продемонстрировали значимых изменений в сравнении с исходными данными. Отдельно была проанализирована динамика изучаемых показателей локальной жесткости и пульсовой волны в подгруппах больных с АГ и нормотоников. При этом каких-либо значимых различий в анализируемых подгруппах не выявлено.
ОБСУЖДЕНИЕ
Известны механизмы токсического действия препаратов, использованных для лечения женщин больных РМЖ, включенных в наше исследование. Так, в механизме повреждающего действия антрациклинов (доксорубицин) доказаны кроме прямой и опосредованной кардиотоксичности также и прямое повреждающее воздействие на сосудистый эндотелий, что в комплексе приводит к развитию кардиомиопатии и сердечной недостаточности, а также к ремоделированию сосудов [1-4]. В основе токсичности производных платины (цисплатин), применение которых ассоциировано с вероятностью артериального и венозного тромбоза, также лежит повреждение эндотелия, снижение биодоступности NO, повышение агрегации тромбоцитов [1-5,10,11]. У таксанов (паклитаксел), в качестве ключевого механизма клинического проявления ишемии миокарда рассматривается спазм коронарных артерий, в основе которого лежит повреждение эндотелия и гладких мышц, что дополнительно проявляется и в виде сосудисто- опосредованных периферических нейропатий и повышения сосудистой проницаемости [1-5,10,11]. По продолжительности воздействия выделяют два типа сосудистой токсичности – долгосрочное (цисплатин, доксорубицин) и преходящее (таксаны) повышение риска сосудистых осложнений [5,10].
Также известно, что при комбинации химиотерапевтических препаратов токсические осложнения значительно возрастают. Так, например, доказано, что таксаны уменьшают выведение доксорубицина, что приводит к повышению его концентрации в плазме и распаду в миокарде на более токсичные метаболи- ты [26]. Паклитаксел в комбинации с антрациклинами также повышает их кардиотоксичность [27] и т.д.
Таким образом, группа обследованных нами женщин больных РМЖ, имела высокую вероятность манифестации как кардио так и вазотоксичности. Проявления у них кардиотоксичности и ее маркеры описаны и проанализированы в предыдущих работах [9,22]. В нашем исследовании целью явилось изучение изменений показателей артериальной жесткости и пульсовой волны в раннем периоде после проведенной химиотерапии. Предполагалась возможность выявления признаков повышения артериальной жесткости на примере стенки ОСА (артерии мышечно-эластического типа), так как некоторыми авторами описаны подобные изменения [21].
Однако, в результате проведенного исследования и анализа полученных данных нами констатировано отсутствие признаков повышения артериальной жесткости ОСА после проведенной комбинированной химиотерапии. Более того, продемонстрированы псевдопозитивные изменения в виде повышения растяжимости стенки ОСА и снижения индекса аугментации. Не выявлено различий в динамике изучаемых показателей в подгруппах с разным режимом химиотерапии и с разным уровнем АД. Полученные результаты можно объяснить общими гемодинамическими изменениями в виде снижения уровня САД, увеличения ЧСС, а также развитием анемии на фоне проводимого лечения [25,28,29]. Аналогичные изменения в виде снижения уровня САД и таких показателей артериальной жесткости как скорость пульсовой волны плече-лодыжечная и каротиднофеморальная (СПВ пл и СПВ кф) у женщин больных РМЖ на фоне комбинированного лечения антрациклинами, таксанами и трастузумабом выявлены ранее другими авторами [30]. Вероятно, в раннем периоде после указанных видов комбинированной химиотерапии на первый план выходят гемодинамические проявления вазотоксичности в виде снижения сосудистого тонуса, а признаки ремоделирования артерий, приводящей к повышению артериальной жесткости, могут быть диагностированы в более отдаленные сроки после лечения.
ЗАКЛЮЧЕНИЕ
У женщин больных раком молочной железы в раннем периоде после проведенной комбинированной химиотерапии с включением антрациклинов (доксорубицин), таксанов (паклитаксел) и производных платины (цисплатин) не выявлено признаков повышения артериальной жесткости общей сонной артерии. Псевдопозитивные изменения в виде повышения растяжимости стенки артерии и снижения индекса аугментации объяснимы общими гемодинамическими изменениями в виде снижения уровня САД, увеличения ЧСС, а также анемией на фоне химиотерапии. Целесообразно для оценки вазотоксичности проводимой противоопухолевой терапии проведение комплексной инструментальной оценки структурно-функционального состояния артерий на различных уровнях сосудистого русла как в ранние, так и в отдаленные сроки после лечения.
Список литературы Влияние комбинированной химиотерапии у женщин больных раком молочной железы на жесткость общей сонной артерии и показатели пульсовой волны по данным эхо-трекинга
- Zamorano J.L., Lancellotti P., Munoz D. R. et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). European Heart Journal. 2016 Sep 21;37(36):2768-280. DOI: 10.1093/eurheartj/ehw211
- Чазова И.Е, Тюляндин С.А, Виценя М.В. и др. Руководство по диагностике, профилактике и лечению сердечно-сосудистых осложнений противоопухолевой терапии. Часть I. Системные Гипертензии. 2017; № 3: 6-20. DOI: 10.26442/2075-082X_14.3.6-20
- Чазова И.Е, Тюляндин С.А, Виценя М.В. и др. Руководство по диагностике, профилактике и лечению сердечно-сосудистых осложнений противоопухолевой терапии. Часть II-V. Системные Гипертензии. 2017; № 4: 6-19. DOI: 10.26442/2075-082X_15.1.6-20
- Campia U., Moslehi J., Amiri-Kordestani L. et al. Cardio-Oncology: Vascular and Metabolic Perspectives. A Scientific Statement From the American Heart Association.Circulation. 2019 Mar 26; 139(13): e579-e602. DOI: 10.1161/CIR.0000000000000641
- Herrmann J, Yang E.H., Iliescu C.A. Vascular toxicities of cancer therapies: the old and the new-an evolving avenue.Circulation 2016;133(13):1272-1289. 10.1161/Circulation AHA.115.018347. DOI: 10.1161/CIRCULATIONAHA.115.018347
- Чазова И.Е., Ощепкова Е.В., Кириллова М.Ю., и др. Сердечно-сосудистые и онкологические заболевания: поиск решений новых проблем. Системные гипертензии. 2015; Т. 12. № 2: 6-7.
- DOI: 10.26442/2075-082X_12.2.6-7
- Cardinale D, Colombo A, Bacchiani G et al. Early detection of anthracycline cardiotoxicity and improvement with heart failure therapy. Circulation 2015; 131 (22): 1981-88.
- DOI: 10.1161/CIRCULATIONAHA.114.013777
- Armenian SH, Lacchetti C, Barac A et al. Prevention and Monitoring of Cardiac Dysfunction in Survivors of Adult Cancers: American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol 2017; 35 (8): 893-911
- DOI: 10.1200/JCO.2016.70.5400
- Авалян А.А., Кириллова М.Ю., Шитов В.Н. и др. Поиск ранних маркеров кардиотоксичности противоопухолевого лечения у больных раком молочной железы в зависимости от уровня артериального давления. Системные гипертензии. 2017; 14 (3): 21-27.
- DOI: 10.26442/2075-082X_14.3.21-2710
- Herrmann J, Lerman A. Vascular toxicities of cancer therapies. In: Clinical Cardio-oncology. Elsevier 2016; p. 163-84.
- DOI: 10.1016/B978-0-323-44227-5.00009-011
- Soultati A, Mountzios G, Avgerinou C et al.Endothelial vascular toxicity from chemotherapeutic agents: preclinical evidence and clinical implications. Cancer Treat Rev 2012;38:473-48. doi: 10.1016.ctrv.2011.09.00212.
- Res E., Kyvelou S.M., Vlachopoulos Ch. et al. Metastatic malignancies and the effect on arterial stiffness and blood pressure levels: the possible role of chemotherapy Onco Targets Ther. 2018; 11: 6785-6793.
- DOI: 10.2147/OTT.S156318
- Gilbert S.E., Tew G.A., Bourke L et al. Assessment of endothelial dysfunction by flow-mediated dilatation in men on long-term androgen deprivation therapy for prostate cancer. Exp Physiol. 2013;98:1401-14103.
- DOI: 10.1113/expphysiol.2013.073353
- Laurent S.1, Cockcroft J., Bortel L.V. et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. European Heart Journal 2006; 27:2588-2605.
- DOI: 10.1093/eurheartj/ehl25415
- Mozos I., Borzak G., Caraba A., Mihaescu R. Arterial stiffness in hematologic malignancies. OncoTargets and Therapy. 2017;10: 1381-1388
- DOI: 10.2147/ott.s126852
- Chaosuwannakit N, Hamilton C.A., Kimberly S., Lane K.S. et al. Aortic Stiffness Increases Upon Receipt of Anthracycline Chemotherapy J Clin Oncol. 2010 Jan 1; 28(1): 166-172.
- DOI: 10.1200/JCO.2009.23.8527
- Jenei Z., Bárdi E., Magyar M.T., Horváth A. et al. Anthracycline causes impaired vascular endothelial function and aortic stiffness in long term survivors of childhood cancer. Pathol Oncol Res. 2013;19(3):375-383.
- DOI: 10.1007/s12253-012-9589-6
- Taniguchi T., Nakamura T., Sawada T. Arterial stiffness, endothelial dysfunction and recurrent angina post-chemotherapy. Q J Med. 2015;108(8):653-655.
- DOI: 10.1093/qjmed/hcu184
- Herceg-Cavrak V, Ahel V, Batinica M, Matec L, Kardos D. Increased arterial stiffness in children treated with anthracyclines for malignant disease. Coll. Antropol. 2011;35(2):389-395.
- Gujral D.M., Shah B.N., Chahal N.S., et al. Arterial stiffness as a biomarker of radiation-induced carotid atherosclerosis. Angiology. 2016;67(3):266-271.
- DOI: 10.1177/0003319715589520
- Manganaro R., Cusma Piccione M., Longobardo L. et al. One-year follow up assessment of chemotherapy-related vascular toxicity: an arterial stiffness study. European Heart Journal Supplements (2017) 18 (Supplement 3), iii400.
- Авалян А.А., Ощепкова Е.В., Саидова М.А.и др. Оценка субклинической кардиотоксичности антрациклинсодержащей химиотерапии рака молочной железы в зависимости от кумулятивной дозы доксорубицина и исходного уровня артериального давления. Системные гипертензии. 2018; 15 (4): 59-64.
- DOI: 10.26442/2075082X.2018.4.000021
- Arterial elasticity in healthy Chinese. Chinese Journal of Ultrasonography 2008; 17(7): 571-575.
- Заирова А.Р., Рогоза А.Н., Добровольский А.Б. и др. Артериальная жесткость и "сосудистое старение" во взаимосвязи с коагулогическими факторами риска развития сердечно-сосудистых заболеваний, показателями липидного и углеводного обмена в популяции взрослого населения Томска по данным исследования ЭССЕ-РФ. Кардиологический вестник. 2018; №1: 5-15.
- DOI: 10.17116/Cardiobulletin20181315-15
- Wilkinson I. B., MacCallum H., Flint L. et al. The influence of heart rate on augmentation index and central arterial pressure in humans Journal of Physiology 2000; 525.1: 263-270.
- DOI: 10.1111/j.1469-7793.2000.t01-1-00263.x
- Salvatorelli E., Menna P., Cascegna S.et al. Paclitaxel and docetaxel stimulationof doxorubicinol formation in the human heart: implications for cardiotoxicityof doxorubicin-taxane chemotherapies. J Pharmacol Exp Ther 2006;318(1):424-33
- DOI: 10.1124/jpet.106.103846
- Floyd J. D., Nguyen D. T., Lobins R. L.et al. Cardiotoxicity of cancer therapy. J Clin Oncol 2005;23:7685-96.
- DOI: 10.1200/JCO.2005.08.78928
- Strazhesko I., A. Staroverova A., E. Borisov E., Orlova Y. Red blood cells count and hemoglobin level are associated with arterial stiffness in healthy subjects. Journal of Hypertension. 2018; Vol. 36, e-Supplement 1: e 250-51.
- Филатова А.Ю., Виценя М.В., Потехина А.В. и др. Атеросклероз брахиоцефальных артерий и артериальная жесткость у больных раком молочной железы. Кардиология. 2019;59(1S):43-52..
- DOI: 10.18087/cardio.2585
- Huimin Chen, Qi Hua, Haixia Hou Association of Hemoglobin with Ambulatory Arterial Stiffness Index in Untreated Essential Hypertensive Patients Without Anemia Internal Medicine.2011; Vol. 50 Issue 22: 2759-2765
- DOI: 10.1136/heartjnl-2011-300867.593


