Влияние концентрации хрома, температуры и давления СО 2 на коррозионную стойкость насосно-компрессорных труб
Автор: Костицына Ирина Валерьевна, Тюрин Александр Георгиевич, Паршуков Владимир Павлович, Бирюков Александр Игоревич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 13 (272), 2012 года.
Бесплатный доступ
Проведены исследования коррозионной стойкости хромистых сталей (26ХМФА; 15Х5М; 20Х13) в условиях движущейся среды при повышенной температуре и давлении углекислого газа. Установлено, что с увеличением температуры скорость локальной коррозии исследуемых материалов уменьшается.
Углекислотная коррозия, сталь, насосно-компрессорные трубы
Короткий адрес: https://sciup.org/147160222
IDR: 147160222 | УДК: 544.653.2
Текст научной статьи Влияние концентрации хрома, температуры и давления СО 2 на коррозионную стойкость насосно-компрессорных труб
Проблема углекислотной коррозии стала приобретать все большее значение в связи с началом разработки глубокозалегающих газоконденсатных месторождений с высокими пластовыми температурами, давлениями и содержанием CO 2 до 5 % [1]. Способность работать в условиях агрессивных сред при повышенных температурах и давлении имеют трубы из нержавеющих сталей со специальными свойствами, легированные хромом, никелем и молибденом.
Использование же обычных углеродистых сталей в качестве материала насоснокомпрессорных труб (НКТ) ограничено высокой коррозионной активностью добываемой жидкости. Ряд производителей трубной продукции, в частности Tenaris Group и Sumitomo [2, 3], для сред с высоким содержанием углекислого газа и низким содержанием сероводорода рекомендуют применять трубы из сталей типа 3Cr с содержанием хрома около 3 %. По данным российских исследователей сталь 15Х5М с содержанием хрома 5 % характеризуется высокой стойкостью к углекислотной коррозии [4, 5].
Цель настоящего исследования – изучение коррозионного поведения сталей с различным содержанием хрома, применяющихся для изготовления НКТ, в условиях повышенной температуры и давления углекислого газа.
Экспериментальная часть
Объектом исследования выступали образцы от насосно-компрессорных труб, изготовленных из сталей 26ХМФА, 15Х5М и 20Х13. Химический состав исследуемых сталей представлен в табл. 1.
Таблица 1
Химический состав исследуемых сталей
|
Марка стали |
Содержание элементов, мас. % |
||||||||||
|
С |
Мn |
Si |
S |
Р |
Сr |
Мо |
Ni |
Сu |
Ti |
V |
|
|
26ХМФА |
0,25 |
0,56 |
0,25 |
0,004 |
0,009 |
0,87 |
0,16 |
0,1 |
0,16 |
0,007 |
0,04 |
|
15Х5М |
0,12 |
0,36 |
0,28 |
0,006 |
0,011 |
4,70 |
0,47 |
0,15 |
0,20 |
– |
0,01 |
|
20Х13 |
0,21 |
0,63 |
0,55 |
0,007 |
0,020 |
12,54 |
– |
0,13 |
0,04 |
<0,005 |
– |
Испытания проводили с помощью испытательного стенда Cortest. Он представляет собой замкнутый контур, снабженный насосом, двумя нагревательными емкостями, герметичной емкостью для закачки раствора, газовой разводкой, а также датчиками скорости, давления и температуры.
Перед испытаниями измеряли при помощи микрометра геометрические параметры образцов с точностью до 0,01 мм, обезжиривали образцы ацетоном и взвешивали на аналитических весах с точностью до 0,00005 г.
Испытательная среда представляла собой 5 % раствор NaCl в дистиллированной воде, насыщенный углекислым газом до необходимого давления. Раствор готовили в емкости, предварительно деаэрированной азотом. В испытательный стенд помещали исследуемые образцы, контур продували азотом, герметизировали и заполняли испытательной средой. pH испытательной среды составлял 6. Устанавливали необходимую температуру и давление углекислого газа. Испытания проводили при скорости движения среды 0,1 м/c. Экспозиция образцов составила 240 часов.
Испытания проводили при температурах 100, 150, 200 °С и давлении P(CO 2 )=3 МПа.
По окончании заданного времени испытания сбрасывали давление, образцы извлекали, фотографировали, очищали от продуктов коррозии, сушили и взвешивали на аналитических весах с той же точностью. Также проводили определение глубины коррозионных поражений методом двойного фокусирования при помощи микроскопа.
От каждой марки стали отбирали образец для исследования продуктов коррозии на электронном сканирующем микроскопе JSM 6490 с энергодисперсионной приставкой. Анализ химического состава продуктов коррозии проводился с точностью до 0,01 %. Также проводился рентгенофазовый анализ на дифрактометре Shimadzu XRD-7000 в монохроматизированном ^ „ -излучении хромового анода. Длина волны составляла 2,29092 А. Исследования проводили в интервале двойных углов дифракции 30–100 град (диапазон межплоскостных расстояний – 4,42– 1,50 Å). Рентгенофазовый анализ проводился в лаборатории технической диагностики ИМАШ УрО РАН с точностью до 5 %.
Результаты и обсуждение
Результаты определения скоростей равномерной и локальной коррозии представлены в табл. 2 и на рис. 1 и 2.
Таблица 2
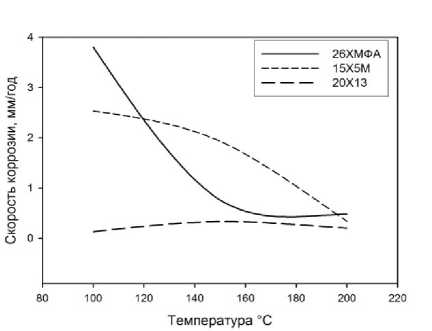
Рис. 1. Влияние температуры на скорость равномерной коррозии исследуемых сталей при P (CO 2 )=3 МПа
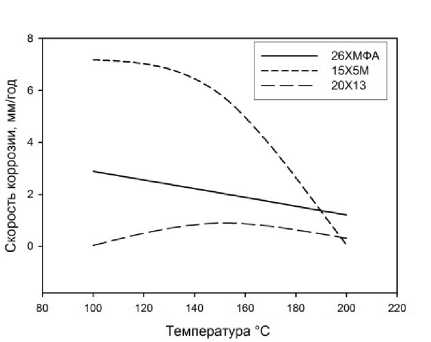
Рис. 2. Влияние температуры на скорость локальной коррозии исследуемых сталей при P (CO 2 )=3 МПа
Скорость коррозии исследуемых сталей при температурах 100, 150, 200 °С и P(СО 2 )=3 МП а
|
Марка стали |
26ХМФА |
15Х5М |
20Х13 |
||||||
|
Температура, °С |
100°С |
150°С |
200°С |
100°С |
150°С |
200°С |
100°С |
150°С |
200°С |
|
Скорость равномерной коррозии, мм/год |
2,88 |
2,05 |
1,20 |
7,17 |
5,86 |
0,05 |
0,03 |
0,89 |
0,31 |
|
Скорость локальной коррозии, мм/год |
3,80 |
0,76 |
0,48 |
2,53 |
1,93 |
0,34 |
0,13 |
0,33 |
0,20 |
Из анализа рис. 1 и 2 видно, что изменение скорости как равномерной, так и локальной коррозии от температуры носит одинаковый характер, но между показателями скоростей равномерной и локальной коррозии для отдельно взятого материала закономерностей нет. В дальнейшем, в качестве показателя коррозии рассматривали скорость локальной коррозии как наиболее практически значимую.
Скорость коррозии стали 26ХМФА уменьшается с увеличением температуры. Наиболее высокая скорость коррозии для данной стали наблюдается при температуре испытаний 100 °С (3,8 мм/год). Для стали 15Х5М характерно уменьшение скорости коррозии с увеличением температуры. При 150 °С скорость коррозии для стали 15Х5М больше скорости коррозии стали 26ХМФА на единицу. Скорость коррозии для стали 20Х13 практически не зависит от изменения температуры испытаний.
Согласно литературным данным [6, 7], при различных температурах на поверхности углеродистых сталей, к которым относится сталь 26ХМФА, образуются различные пленки продуктов коррозии. При этом наблюдается усиление их защитных свойств с ростом температуры. При температуре 100 °С на поверхности стали образуется преимущественно рыхлая пленка карбоната железа FeCO 3 , не обладающая защитными свойствами. А при более высоких температурах образуются фазы Fe 3 O 4 и/или Fe 2 O 3 . Магнетит с его кубической решеткой шпинельного типа, благодаря хорошему размерно-структурному соответствию, образует на поверхности железа и стали покрытие с высокой адгезией, покрытое тонкой пленкой Fe2O3. Данное покрытие обладает малой проницаемостью и, следовательно, проявляет защитные свойства.
Данный факт подтверждается построенными диаграммами состояния Fe – CO 2 – H 2 O при 100, 150, 200 °С, P(CO 2 )=3 МПа и активностях ионов железа в растворе а i =10 –6 – 1 моль/л (рис. 3–5). Замечено, что область образования FeCO3 уменьшается с увеличением температуры, и, очевидно, при температурах выше 100 °С в данных условиях на поверхности образуется преимущественно плотная оксидная пленка, состоящая из оксидов железа, которая предотвращает дальнейшее растворение металла. Термодинамические выводы согласуются с полученными результатами по скорости коррозии для стали 26ХМФА.
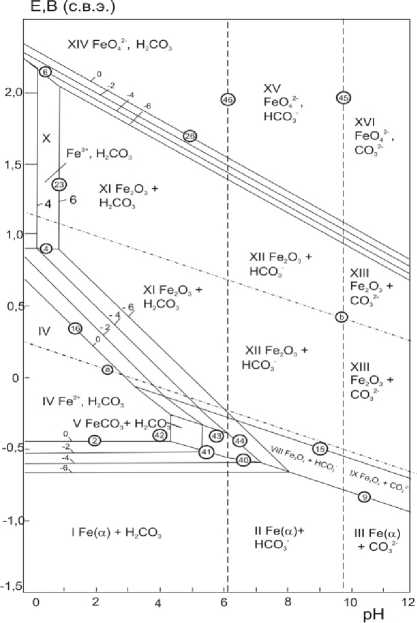
Рис. 3. Диаграмма состояния Fe – CO 2 – H 2 O при t =100°С, P (CO 2 )=3 МПа и активностях ионов железа в растворе а i = 10–6 – 1 моль/л
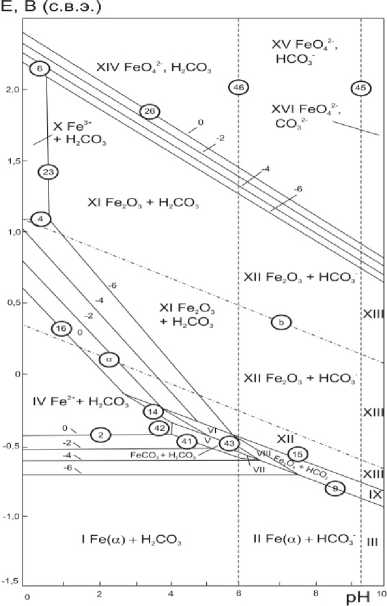
Рис. 4. Диаграмма состояния Fe – CO 2 – H 2 O при t =150 °С, P (CO 2 )=3 МПа и активностях ионов железа в растворе а i =10–6 – 1 моль/л
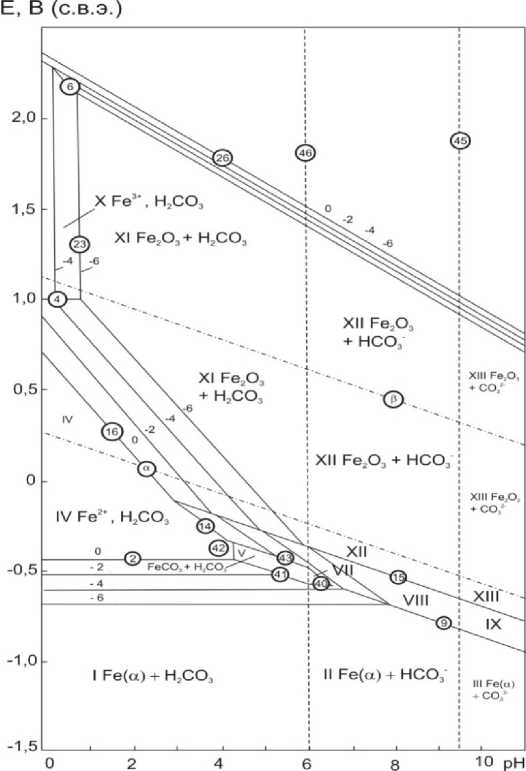
Рис. 5. Диаграмма состояния Fe – CO 2 – H 2 O при t =200 °С, P (CO 2 )=3 МПа и активностях ионов железа в растворе а i = 10–6 – 1 моль
По данным, полученным с помощью электронного сканирующего микроскопа (рис. 6), с ростом температуры на образцах из стали 26ХМФА, наблюдается уплотнение слоя продуктов коррозии, содержание железа и кислорода в продуктах коррозии значительно и возрастает с ростом температуры на фоне достаточно небольшого содержания хрома, особенно при температуре 200 °С. Это также свидетельствует, видимо, об образовании достаточно плотной пассивационной пленки, состоящей из оксидов железа.

а) б) в)
Рис. 6. Состав продуктов коррозии на образце стали 26ХМФА: а – при t =100 °С и P (СО 2 )=3 МПа О – 22,05 %; Cr – 13,38 %; Fe – 43,58 %; б – при t =150 °С и P (СО 2 )=3 МПа О – 21,59 %; Cr – 10,07 %; Fe – 62,04 %; в – при t =200 °С и P (СО 2 )=3 МПа О – 27,89 %; Cr – 1,06 %; Fe – 69,90 %
Для проведения рентгенофазового анализа, исходя из марочного состава сталей и состава среды, в которой находились образцы, по каталогу Американского общества испытания материалов (ASTM) и литературным источникам [8] был составлен перечень фаз, которые могут содержаться в предоставленных продуктах коррозии. В табл. 3 приведены те фазы, дифракционные максимумы от которых соответствуют рефлексам, наблюдаемым на рентгенограммах. В числителе указано количество рентгеновских рефлексов той или иной фазы, зафиксированных на ди-фрактограмме, в знаменателе – число рефлексов от этой фазы, которые должны наблюдаться в исследованном интервале углов согласно справочным данным. Предполагалось, что чем ближе к единице это отношение, тем больше вероятность нахождения данной фазы в пробе.
Таблица 3
Данные рентгенофазового анализа
|
Фаза Образец |
FeO |
Fe 2 O 3 |
Fe 3 O 4 |
Fe 2 (OH) 2 CO 3 |
Fe(HCO 3 ) 2 |
FeCO 3 |
Cr 7 C 3 |
|
20Х13, 100 ° С |
0/3 |
0/11 |
0/8 |
0/53 |
0/12 |
1/8 |
0/9 |
|
20Х13, 150 ° С |
2/3 |
0/11 |
2/8 |
5/53 |
2/12 |
7/8 |
5/9 |
|
20Х13, 200 ° С |
2/3 |
0/11 |
3/8 |
7/53 |
2/12 |
8/8 |
6/9 |
|
26ХМФА, 100 ° С |
1/3 |
3/11 |
1/8 |
5/53 |
2/12 |
8/8 |
5/9 |
|
26ХМФА, 150 ° С |
1/3 |
3/11 |
1/8 |
9/53 |
3/12 |
8/8 |
5/9 |
|
26ХМФА, 200 ° С |
1/3 |
2/11 |
4/8 |
7/53 |
5/12 |
8/8 |
5/9 |
|
15Х5М, 100 ° С |
2/3 |
0/11 |
2/8 |
6/53 |
0/12 |
8/8 |
3/9 |
|
15Х5М, 150 ° С |
2/3 |
0/11 |
0/8 |
6/53 |
0/12 |
8/8 |
2/9 |
|
15Х5М, 200 ° С |
2/3 |
0/11 |
4/8 |
5/53 |
2/12 |
8/8 |
3/9 |
По результатам рентгенофазового анализа содержание оксидов железа FeO, Fe 2 O 3 и Fe 3 O 4 в продуктах коррозии стали 26ХМФА маловероятно. Исключение составляет образец стали 26ХМФА, выдержанный в испытательной среде при 200 ° С: на соответствующей дифрактограм-ме имеются 4 из 8 линий от оксида Fe 3 O 4 .
Также маловероятно нахождение в продуктах коррозии стали 26ХМФА карбонатов Fe 2 (OH) 2 CO 3 и Fe(HCO 3 ) 2 . В то же время на дифрактограммах образцов этой стали имеются все 8 линий, соответствующих FeCO 3 , т. е. наибольшей вероятностью обнаружения на поверхности продуктов коррозии данной стали во всем диапазоне исследованных температур обладает карбонат железа FeCO 3 (табл. 3).
Объясняется это, видимо, особенностями растворимости карбоната железа в различных условиях. Растворимость FeCO 3 растет с повышением давления CO 2 и падает с повышением температуры, поэтому повышение температуры и pH среды благоприятствуют защитным свойствам его пленок, улучшая их адгезию и уменьшая проницаемость. Связано это, очевидно, с тем, что при возрастании pH уменьшается концентрация ионов водорода H+ , способных сместить равновесие реакции
FeCO3 ↔ Fe2++ CO32– вследствие связывания ионами водорода карбонат-ионов.
Таким образом, с повышением температуры испытаний до 200 °С, при постоянном давлении CO2 и постоянном pH равном 6, на поверхности стали 26ХМФА образуется двухслойная пленка продуктов коррозии: оксидная пленка, состоящая из оксидов железа Fe 3 O 4 и Fe 2 O 3 , и слой FeCO 3 , отличающийся при повышенных температурах малой проницаемостью и большими защитными свойствами.
При приготовлении порошковых проб для рентгенофазового анализа основную массу пробы составил карбонат железа FeCO3, образующийся поверх пассивационной пленки, что и дало та- кие большие вероятности его нахождения. Следует отметить, что вероятность нахождения Fe3O4 на стали 26ХМФА наибольшая при 200 °С.
При пассивации железохромистых сплавов с содержанием хрома от 3 % по мере снижения содержания хрома в поверхностном слое возможны следующие стадии процесса [7]:
-
I. α-фаза (сплав) + Cr 2 O 3(к) ;
-
II. α -фаза (сплав) + FeCr 2 O 4(ш) ;
-
III. α-фаза (сплав) + [Fe(Cr 2– x Fe x )O 4 ] ш.р .
Для железохромистых сталей при концентрациях хрома в сплавах ниже первой пороговой концентрации (порядка 12 мас. %) первая и вторая стадии процесса пассивации являются неустойчивыми: хрома в поверхностном слое недостаточно, чтобы образовать сплошной пассивирующий слой Cr 2 O 3 (I стадия) или чистого хромита железа FeCr 2 O 4 (II стадия) и процесс завершается образованием на поверхности сплава смешанной шпинели Fe(Fe x Cr 2- x )O 4 (III стадия). Поскольку магнетит Fe 3 O 4 и хромит железа FeCr 2 O 4 неограниченно смешиваются друг с другом, коррозионная стойкость железохромистых сплавов плавно возрастает при увеличении содержания хрома, т.е. при увеличении доли FeCr 2 O 4 в Fe 3 O 4 . При концентрации хрома в железе порядка 12 мас. % и выше обеспечиваются условия для создания на сплаве стабильной пассивирующей пленки чистого хромита железа FeCr 2 O 4 , дающего наилучший пассивирующий эффект среди всех шпинелей системы железо – хром [7].
Таким образом, на поверхности стали 15Х5М с содержанием хрома 5 % образовывалась смешанная шпинель Fe(Fe x Cr 2– x )O 4 , обладающая меньшими защитными свойствами, что объясняет высокую скорость коррозии стали 15Х5М при 150 °С. Низкая скорость коррозии данной стали при температуре 200 °С объясняется образованием двухслойной пленки продуктов коррозии: смешанной шпинели Fe(Fe x Cr 2– x )O 4 и карбоната железа FeCO 3 .
По данным, полученным с помощью электронного сканирующего микроскопа (рис. 7), слой продуктов коррозии на поверхности стали 15Х5М при всех исследованных температурах рыхлый, по мере возрастания температуры испытаний возрастает содержание железа в продуктах реакции и уменьшается содержание хрома. Увеличение содержания железа свидетельствует, видимо, об образовании слоя карбоната железа поверх хромсодержащей шпинели Fe(Fe x Cr 2– x )O 4 . Это подтверждается и результатами рентгеноструктурного анализа (табл. 3).

а) б) в)
Рис. 7. Состав продуктов коррозии на образце стали 15Х5М:
а – при t =100 °С и P (СО 2 )=3 МПа О – 25,84 %; Cr – 42,29 %; Fe – 4,75 %; б – при t =150 °С и P (СО 2 )=3 МПа О – 23,69 %; Cr – 9,98 %; Fe – 63,58 %;
в – при t =200 °С и P (СО 2 )=3 МПа О – 21,84 %; Cr – 4,12 %; Fe – 69,83 %
На дифрактограммах продуктов коррозии стали 15Х5М cодержание чистых оксидов железа маловероятно, за исключением магнетита Fe 3 O 4 , число рефлексов которого в образце стали 15Х5М, подвергнутого коррозионному испытанию при температуре 200 ° С, достигает 4 из 8 возможных. Маловероятно нахождение в продуктах коррозии стали 15Х5М карбонатов Fe2(OH)2CO3 и Fe(HCO 3 ) 2 . В то же время на дифрактограммах образцов этой стали имеются все 8 линий, соответствующих соединению FeCO 3 . Наибольшими значениями вероятности нахождения обладают магнетит Fe3O4, входящий в состав железохромистой шпинели Fe(Fe x Cr2- x )O4, и карбонат железа FeCO 3 , образующийся поверх пленки шпинели и обладающий увеличивающимися защитными свойствами при повышении температуры (табл. 3).
Скорость коррозии стали 20Х13 во всем диапазоне исследованных температур отличается низкими значениями (менее 0,5 мм/год) и фактически не зависит от температуры. Объясняется это, видимо, образованием плотной пассивирующей пленки чистого хромита железа FeCr2O4, дающего наилучший пассивирующий эффект среди всех шпинелей системы железо – хром.
Из фотографий, полученных с помощью электронного микроскопа (рис. 8) видно, что поверхность стали 20Х13 отличается одинаково плотной текстурой осадка во всем диапазоне температур. На поверхности продуктов коррозии образцов стали 20Х13 наибольшее содержание хрома наблюдается после испытаний при температуре 150 °С, при 200 °С хрома в продуктах коррозии также фактически не обнаружено, но присутствует значительное содержание железа.

а)
б)
в)
Рис. 8. Состав продуктов коррозии на образце стали 20Х13:
а – при t =100 °С и P (СО 2 )=3 МПа О – 24,21 %; Cr – 18,73 %; Fe – 35,39 %;
б – при t =150 °С и P (СО 2 )=3 МПа О – 36,53 %; Cr – 56,71 %; Fe – 12,98 %;
в – при t =200 °С и P (СО 2 )=3 МПа О – 46,22 %; Cr–1,24%; Fe – 39,51 %
Согласно результатам рентгеноструктурного анализа (табл. 3) при увеличении температуры до 150 ° С и 200 ° С дифрактограммы продуктов коррозии стали 20X13 содержат 2 (из 3) рефлекса, которые могут соответствовать оксиду FeO. Рефлексы от оксида Fe3O4 в количестве 2 и 3 (из 8) содержатся на рентгенограммах образцов стали 20Х13, подвергнутых коррозии при температурах 150 ° С и 200 ° С соответственно. Оксид Fe2O3 в этих образцах не обнаружен.
Вероятность нахождения в образцах стали 20Х13, подвергнутых коррозии при температурах 150 ° С и 200 ° С, карбонатов Fe(HCO3)2 и Fe2(OH)2CO3 невелика.
На дифрактограммах образцов стали 20Х13, подвергнутых коррозии при температурах 150 ° С и 200 ° С, обнаружено соответственно 7 и 8 (из 8 возможных) рефлексов, которые можно идентифицировать как дифракционные максимумы от соединения FeCO 3 .
Таким образом, вероятность обнаружения Fe3O4 увеличивается с повышением температуры испытаний, а вероятность обнаружения FeCO3 велика при температурах 150 ° С и 200 ° С, что, как и для рассмотренных ранее сталей 26ХМФА и 15Х5М, свидетельствует об образовании двухслойной пленки продуктов коррозии хромит железа – карбонат железа.
Заключение
Проведены исследования материалов с различным содержанием хрома при температурах 100; 150; 200 °С и давлении углекислого газа 3 МПа. Установлено, что с увеличением температуры скорость локальной коррозии исследуемых материалов уменьшается. Полученные данные можно разместить в характерные ряды в порядке уменьшения скорости коррозии:
При температуре 100 °С: 26ХМФА > 15Х5М > 20Х13.
При температуре 150 °С: 15Х5М > 26ХМФА > 20Х13.
При температуре 200 °С: 15Х5М ≈ 26ХМФА ≈ 20Х13 ≈ 0,5 мм/год.
Уменьшение скорости локальной коррозии углеродистых сталей с увеличением температуры объясняется увеличением защитных свойств пленки продуктов коррозии состава: (Fe 3 O 4 ; Fe 2 O 3 ) – FeСO 3 .
На поверхности материалов с содержанием хрома 5 % при увеличении температуры до 150 °С образуется смешанная шпинель Fe(Fe x Cr 2– x )O 4 , обладающая сравнительно низкими защитными свойствами. Снижение скорости локальной коррозии при дальнейшем увеличении температуры до 200 °С объясняется увеличением защитных свойств слоя FeСO 3 при данной температуре.
Для материалов с содержанием хрома 13 % низкая скорость коррозии в исследуемом диапазоне давлений CO2 и температур объясняется образованием плотных пленок чистого хромита железа FeCr 2 O 4 .
Список литературы Влияние концентрации хрома, температуры и давления СО 2 на коррозионную стойкость насосно-компрессорных труб
- Маркин, А.Н. CO2-коppозия нефтепромыслового оборудования/А.Н. Маркин. -М.: ОАО «ВНИИОЭНГ», 2003. -187 с.
- Sumitomo Metal Industries Ltd, www.sumitomometals.co.jp/e/business/sm-series.pdf>
- JFE Steel Corporation -Pipes and Tubes -OCTG, www.jfe-steel.co.jp/en/products/pipes/octg/pro_and_serv/grade/wet.html>
- Иоффе, А.В. Влияние химического состава и структуры на стойкость нефтепроводных труб к углекислой коррозии/А.В. Иоффе, М.А. Выбойщик, Е.А. Трифонова, П.В. Суворов//Металловедение и термическая обработка металлов. -2010. -№ 2. -С. 9-14.
- Насосно-компрессорные трубы высокой коррозионной стойкости/А.В. Иоффе, М.А. Выбойщик, Е.А. Трифонова и др.//Металловедение и термическая обработка металлов. -2010. -№ 1. -С. 24-31.
- Влияние строения и свойств оксидных пленок на поверхности железа и его сплавов на протекание коррозии материала/В.И. Колесников, М.В. Бойко, С.Б. Булгаревич, Е.Е. Акимова//Вестник Южного научного центра РАН. -2007. -Т. 3. -№ 1. -С. 10-15.
- Тюрин, А.Г. Термодинамика химической и электрохимической устойчивости твердых сплавов железа, хрома и никеля/А.Г. Тюрин. -Челябинск: Изд-во ЧелГУ. -2011. -241 с.
- Нарита, К. Кристаллическая структура неметаллических включений в стали/К. Нарита. -М.: Металлургия, 1969. -192 с.