Влияние кортизола в комплексе с липопротеинами очень низкой плотности на развитие гепатомы НА-1 и карциномы Эрлиха
Автор: Панин Л.Е., Белоногова Ж.И., Князев Р.А., Чешенко И.О.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (57), 2013 года.
Бесплатный доступ
Исследования проводились на клетках асцитной НА-1 гепатомы и асцитной карциномы Эрлиха. После пассажа клеток на мышах выделяли смешанную культуру клеток, содержащую опухоль-ассоциированные макрофаги. Показано, что в сокультуре комплекс ЛПОНП–кортизол значительно подавлял пролиферативную активность опухолевых клеток. Полученная константа связывания кортизола с ЛПОНП указывает на то, что в комплексообразовании принимает участие белковый компонент липопротеинов. Предполагается, что в образовании такого комплекса важную роль играют опухоль-ассоциированные макрофаги. Обнаружено, что механизм подавления роста опухолевых клеток связан с апоптозом.
Опухолевые клетки, липопротеины, кортизол, опухоль-ассоциированные макрофаги, биосинтез нуклеиновых кислот
Короткий адрес: https://sciup.org/14056331
IDR: 14056331 | УДК: 616.36-006.6:577.11]-092.9
Текст научной статьи Влияние кортизола в комплексе с липопротеинами очень низкой плотности на развитие гепатомы НА-1 и карциномы Эрлиха
Применять липопротеины крови для лечения опухолевых заболеваний предложено давно [6, 12]. Обычно их используют как транспортную форму различных цитостатиков: рубомицина, актиномицина Д, циклофосфана и других препаратов. Чаще всего для этого берут липопротеины низкой плотности (ЛПНП). Они обладают достаточно высоким аффинитетом по отношению к цитостатикам. Так, константа диссоциации (Kд) для тамоксифена составляет 2,3×10-8 М [14]. Используется также способ ковалентной пришивки препарата к белковому компоненту ЛПНП [10]. Липопротеины высокой плотности (ЛПВП) для доставки в опухолевые клетки цитостатиков применяются редко. Существуют единичные работы по их доставке в клетки карциномы [5] и гепатомы [7]. Наблюдается разная степень связывания цитостатиков с липопротеинами крови. Так, циклоспорин G в плазме крови преимущественно связывается с ЛПВП (50–60 %) и в меньшей степени с ЛПНП (20–30 %) и ЛПОНП (10 %) [13].
Нам не встречались работы, в которых липопротеины плазмы крови использовались с целью запуска апоптоза опухолевых клеток. В этом отношении интерес представляет работа, в которой применялись липосомы, содержащие сфингомиелин и церамид, для стимуляции апоптоза в клетках гепатоцеллюлярной гепатомы крыс [1]. Показано, что оба соединения подавляют пролиферацию и усиливают апоптоз раковых клеток. Индукторами апоптоза являются не только сфингомиелин, фос-фатидилсерин, церамид, но и стероидные гормоны (глюкокортикоиды) [4].
В данном исследовании мы для стимуляции апоптоза опухолевых клеток использовали липопротеины очень низкой плотности (ЛПОНП)
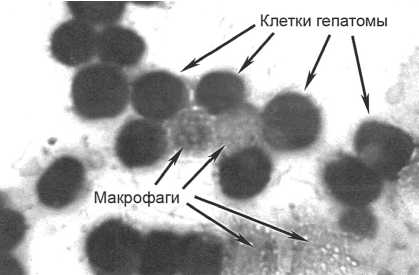
Рис. 1. Микрофото. Клетки асцитной НА-1 гепатомы с опухоль-ассоциированными макрофагами.
Окраска по Романовскому-Гимза, ×400
в комплексе с кортизолом. Это было обусловлено тем, что, во-первых, ЛПОНП достаточно богаты сфингомиелином [2] и, во-вторых, они активно связывают кортизол и кортикостерон. Константы связывания равны (5 ± 0,1) × 106М-1 и (8 ± 0,1) × 106М-1 соответственно [11].
Цель исследования – оценить кооперативный характер действия кортизола и липопротеинов очень низкой плотности в механизме запуска апоптоза опухолевых клеток.
Материал и методы
Исследования проводились на культурах клеток асцитной гепатомы НА-1, полученной в результате индукции мышей самцов линии A/Sn о-аминоазотолуолом (Институт цитологии и генетики СО РАН, г. Новосибирск). В экспериментах использовали клетки, выделенные на 10-е сут после перевивания их в брюшную полость мышей той же линии из расчёта 1 млн клеток на особь. Также в работе использовали мышей линии ICR с асцитной карциномой Эрлиха (Институт цитологии и генетики СО РАН). Клетки перитонеального экссудата получали на 10-е сут после пассажа опухоли для последующего культивирования. Свежевыделенные клетки ресу-спендировали в среде RPMI-1640 с L-глутамином, содержащую 20 мМ HEPES/NaOH (pH 7,4), 2 мM L-глутатиона, 100 ед/мл пенициллина, 50 мкг/мл гентамицина, 5,6 mM глюкозы, 10 нМ инсулина. Клетки наносили на 6-луночные планшеты («Orange Scientific», Бельгия), покрытые коллагеном первого типа. Инкубацию проводили при 37°С в атмосфере 5 % СО2 и 95 % воздуха при влажности 85 %. Конечная плотность клеток 5×106 на мм2. Продолжительность инкубации
Рис. 2. Электрофорез ДНК в агарозном геле.
Примечание: 1 – контроль; 2 –ЛПОНП; 3 – ЛПОНП–кортизол
24 ч. Пролиферативную активность клеток оценивали по скорости включения 3Н-тимидина в ДНК. Последний добавляли в среду инкубации в дозе 2 мкКи/мл за 2 ч до окончания эксперимента. Радиоактивность измеряли на сцинтилляционном счётчике «Mark-III»(США) и выражали в имп/ мин на 1 мг белка. Содержание белка в образцах определяли по Лоури [8]. Кортизол добавляли в среду инкубации в конечной концентрации 10–6 М, ЛПОНП – 200 мкг/мл. Содержание ДНК в образцах определяли полуколичественно с помощью электрофореза в агарозном геле. Апоптоз опухолевых клеток оценивали с помощью электронной микроскопии. Для этого образцы фиксировали в 2,5 % растворе глутарового альдегида в течение 1 ч, затем – в 0,1М ФСБ, содержащем 1 % OsO4. Образцы обезвоживали в спиртовых растворах с повышающейся концентрацией и заливали в аралдит. Срезы просматривали в электронном микроскопе YEM 100B (Япония).
Статистический анализ проводили с использованием программы Statistica 6.0 (StatSoft, USA, , достоверность значений определяли по t-критерию Стьюдента.
Результаты и обсуждение
Клетки асцитной гепатомы с опухоль-ассоциированными макрофагами (рис. 1) в организме мышей активно делятся, так что продолжительность жизни животных не превышает 2–3 нед. Ранее нами было показано, что пролиферативная активность клеток НА-1 гепатомы зависит от макрофагов. При стимуляции последних комплексом ЛПВП-кортизол отмечалось резкое усиление в сокультуре биосинтеза как ДНК, так и белка [3].
ВЛИЯНИЕ КОРТИЗОЛА В КОМПЛЕКСЕ С ЛИПОПРОТЕИНАМИ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ ...
В данном исследовании мы оценивали влияние комплекса ЛПОНП-кортизол на скорость биосинтеза ДНК в сокультуре. Оказалось, что кортизол и ЛПОНП независимо друг от друга несколько тормозили скорость биосинтеза ДНК (разница с контролем недостоверна). Добавление к сокуль-туре комплекса ЛПОНП-кортизол вдвое снижало скорость биосинтеза ДНК (табл. 1). Принимая во внимание, что обмен липопротеинов связан в первую очередь с макрофагами, следует допустить, что именно последние запускают механизм подавления опухолевого роста.
Дальнейшие исследования мы проводили на культуре клеток асцитной карциномы Эрлиха в присутствии опухоль-ассоциированных макрофагов. Пролиферативную активность клеток также оценивали по скорости включения 3Н-тимидина в ДНК. Показано, что кортизол и ЛПОНП независимо друг от друга несколько снижали скорость биосинтеза ДНК (разница с контролем недостоверна). Комплекс ЛПОНП–кортизол снижал скорость биосинтеза в 1,7 раза (табл. 2). Полученные результаты аналогичны вышеуказанным. Эти результаты подтверждены данными электрофоретического анализа ДНК в образцах клеток асцитной карциномы Эрлиха (рис. 2). Значительное снижение содержания ДНК в образцах указывает на гибель клеток асцитной карциномы.
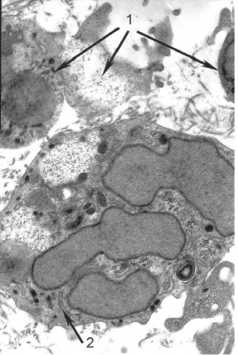
Рис. 3. Электронная микроскопия клеток асцитной карциномы Эрлиха. Действие комплекса ЛПОНП–кортизол.
Примечание: 1 – погибшая клетка;
2 – клетка в состоянии апоптоза, × 8000
Электронно-микроскопический анализ изменения структуры клеток выявил потерю микроворсин, секвестрацию цитоплазмы в среду инкубации и фрагментацию ядер (рис. 3). Обнаруженные признаки позволяют отнести механизм гибели опухолевых клеток под влиянием комплекса ЛПОНП–кортизол к апоптозу. Отсутствие выраженного эффекта подавления пролиферативной активности опухолевых клеток под влиянием
Таблица 1
Изменение скорости биосинтеза ДнК в сокультуре клеток на-1 гепатомы под влиянием комплекса ЛПонП-кортизол
|
Условия инкубации |
Имп/мин/мг белка M ± m, n=6 |
|
Контроль |
14233 ± 1802 |
|
ЛПОНП |
9647 ± 1613 |
|
Кортизол |
9903 ± 2644 |
|
ЛПОНП-кортизол |
6909 ± 565* |
Примечание: * – различия статистически значимы по сравнению с контролем (р<0,01).
Таблица 2
Изменение скорости биосинтеза ДнК в сокультуре клеток асцитной карциномы Эрлиха под влиянием комплекса ЛПонП-кортизол
|
Условия инкубации |
Имп/мин/мг белка M ± m, n=6 |
|
Контроль |
7805 ± 447 |
|
ЛПОНП |
5002 ± 298 |
|
Кортизол |
5939 ± 236 |
|
ЛПОНП-кортизол |
4176±376 * |
Примечание: * – различия статистически значимы по сравнению с контролем (р<0,05).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 3 (57)
ЛПОНП или кортизола говорит о том, что мы имеем дело с кооперативным механизмом действия обоих компонентов комплекса. Полученная величина константы связывания гормона с ЛПОНП указывает на то, что в комплексообразовании принимает участие белковый компонент последних. Однако какой белок ЛПОНП принимает в этом участие – пока нами не установлено.
Заключение
Описан новый механизм подавления роста опухолевых клеток НА-1 гепатомы и карциномы Эрлиха, обусловленный кооперативным эффектом действия кортизола и ЛПОНП. Результаты электронной микроскопии позволяют утверждать, что данный механизм связан с апоптозом клеток.


