Влияние кратковременных и продолжительных колебаний факторов среды на состав липидов P lantago media L. В условиях Южного Тимана
Автор: Розенцвет Ольга Анатольевна, Нестеров Виктор Николаевич, Богданова Елена Сергеевна, Гребенкина Татьяна Михайловна, Головко Тамара Константиновна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Экология
Статья в выпуске: 1-3 т.14, 2012 года.
Бесплатный доступ
Изучали влияние кратковременных (в течение суток) и продолжительных (погодные условия года) колебаний факторов среды (температурного и светового режимов, обеспеченности влагой) на состав фосфолипидов и жирных кислот растений P lantago media L. (подорожника среднего), произрастающих в условиях Южного Тимана. Исследовались растения двух экотипов: с открытого хорошо освещенного участка – С-растения и растения из густого травостоя – Т-растения. Показана стабильность качественного состава липидов и жирных кислот в листьях растений. Вместе с тем, выявлены изменения в содержании и соотношении отдельных липидов под влиянием внешних условий. Условия среды оказывали более выраженное влияние на липиды листьев световых растений, чем теневых. Полученные результаты свидетельствуют о динамичности состава мембранных липидов в зависимости от времени суток, погодных условий и типа местообитания.
Фосфолипиды, жирные кислоты, факторы среды
Короткий адрес: https://sciup.org/148200696
IDR: 148200696 | УДК: 581.1
Текст научной статьи Влияние кратковременных и продолжительных колебаний факторов среды на состав липидов P lantago media L. В условиях Южного Тимана
растение. По типу приспособления организмов и выживанию P. media характеризуется высоким индексом толерантности и относится к группе гемиэврибионтов [10].
В настоящее время принято считать, что экологическая пластичность растений, во многом зависит от способности клеточных мембран поддерживать адаптационную взаимосвязь клетки и внешней среды [14, 15]. Липидам и жирным кислотам (ЖК) отводится ведущая роль в регулировании текучести мембран – одного из главных условий обеспечения многих жизненно важных функций [21].
В естественных условиях, растения подвергаются перекрывающемуся действию экологических факторов, которые могут инициировать скоординированные экофизиологические реакции, что приводит к различным функциональным стратегиям [24]. Особый интерес представляют эврибионтные растения, с высокой степенью лабильности, обитающие в областях, прилегающих к границам ареала. Кроме того, необходимо учитывать, что в естественных условиях произрастания растений постоянно меняются уровень освещенности, температура, концентрация СО2 и другие факторы. Приспособление растений при этом происходит в динамическом режиме, задаваемом периодом изменений [7]. Однако работ, посвященных изучению вариабельности физиологических и биохимических свойств растений в нетипичных экологических условиях с широким диапазоном изменения экологических факторов недостаточно.
Ранее нами были получены данные, свиде- тельствующие о морфофизиологической пластичности P. media по отношению к освещенности, а также показана роль циклических липидов - каротиноидов в защите фотосинтетического аппарата растений в условиях светового стресса [3]. Кроме того, выявлены качественные и количественные изменения липидов в растениях P. media под влиянием внешних условий [4, 5].
Цель настоящей работы заключалась в изучении временной суточной и межгодовой и фенологической изменчивости состава фосфолипидов и жирных кислот растений P. media, адаптированных к условиям обитания на Южном Тимане.
МАТЕРИАЛЫ И МЕТОДЫ
Район исследования. Южным Тиманом принято называть южную часть Тиманского кряжа, являющегося важной орографической структурой Северо-Востока европейской части России [2]. Среднегодовая температура воздуха в районе исследований составляет -1,5 оС, средняя температура самого теплого месяца - июля равняется +15 оС. Безморозный период длится в среднем 76 дней. Продолжительность фотопериода в конце июня - начале июля достигает 19 ч.
Растительный материал. Растения P. media произрастали на слабо заросшем склоне юго-восточной экспозиции (С-растения) и на террасе у подошвы склона в густом травостое (Т-расте-ния) на левом берегу реки Сойва вблизи п. Нижняя Омра (62o45/ с.ш., 55o 49/ в.д.). Площадь, занимаемая ценопопуляцией составляла около 700 м2. Измерения микроклиматических показателей в местообитаниях растений проводили с помощью портативной метеостации (Data Logger LI-1400, США). Характеристика погодных условий в период проведения исследований приведена по данным гидрометеоцентра Республики Коми (табл. 1). Метеорологическая станция располагалась на расстоянии примерно 20 км от исследуемых участков. Эксперименты проводили в первой половине июля в 2007, 2009 и 2010 гг. в фазу цветения растений.
Выделение и анализ липидов . Для анализа липидов листья отбирали по одному со средней части розетки 12–15 типичных растений 3-4 раза в сутки. Среднюю часть листьев измельчали и отбирали из них навески 1-2 г для выделения липидов. Деферментированные в кипящем изопропаноле растения в плотно закупоренных флаконах перевозили к месту проведения анализов. Липиды трижды экстрагировали смесью хлороформа и метанола (1 : 2, по объему) с одновременным механическим разрушением тканей со стеклянными бусами [6]. Объединенные экстракты отмывали от нелипидных примесей, растворитель отгоняли на роторно-вакуумном испарителе.
Разделение фосфолипидов (ФЛ) проводили методом двумерной ТСХ на стеклянных пластинках 6 х 6 (см) с закрепленным слоем силикагеля. Использовали систему растворителей для первого направления – хлороформ: метанол: бензол: аммиак (130 : 60 : 20 : 12), для второго – хлороформ: метанол: бензол: ацетон: уксусная кислота (140 : 60 : 20 : 10 : 8). Пластинки опрыскивали 10%-ной H2SO4 в метаноле с последующим их нагреванием при 180оС в течение 15 мин. Количественное содержание определяли по содержанию неорганического фосфора [22].
Количество глико- (ГЛ) и нейтральных липидов (НЛ) анализировали на денситометре «ДенСкан-04» (Россия).
Жирные кислоты (ЖК) анализировали в виде их метиловых эфиров, получаемых кипячением в 5%-ом растворе HCl в метаноле в течение 1 ч. Полученные эфиры очищали препаративной ТСХ и анализировали на газо-жидкостном хроматографе «Хроматэк. Кристалл 5000.1» (Россия) с использованием капиллярной колонки длиной 105 м и диаметром 0.25 мм
Таблица 1. Метеорологические показатели в период наблюдений
|
Показатели |
2007 г. |
2009 г. |
2010 г. |
||||||
|
Июнь |
Июль |
Июнь |
Июль |
Июнь |
Июль |
||||
|
III |
I |
II |
III |
I |
II |
III |
I |
II |
|
|
Средняя температура воздуха, оС |
18 |
25 |
21 |
11 |
11 |
17 |
16 |
16 |
16 |
|
Отклонение от нормы |
2 |
9 |
4 |
-4 |
-5 |
0 |
2 |
1 |
0 |
|
Сумма осадков, мм |
84 |
1 |
18 |
18 |
50 |
17 |
4 |
7 |
2 |
|
Осадки в % к норме |
443 |
5 |
78 |
82 |
217 |
74 |
18 |
30 |
9 |
|
Число часов солнечного сияния |
90 |
141 |
97 |
100 |
42 |
110 |
105 |
102 |
115 |
Если в тексте средняя Т= +15, то отклонение соответственно не может быть -5 Нужно проверить отклонения от нормы
«RESTEK» (США) в изотермическом режиме. Температура колонки – 180 оС, испарителя и детектора – 260 оС. Скорость тока газа-носителя (гелий) – 2 мл/мин.
Для оценки ненасыщенности ЖК использовали индекс ненасыщенности (ИН).
ИН = ∑ Pjn/100, где Pj – содержание ЖК (% от суммы) и n – количество двойных связей в каждой кислоте [18].
Активность ацил-липидных д ' 9, й 6 и д ' 3 десатураз, как стеароил- (SDR), олеил- (ODR) и линолеил- (LDR) десатуразные отношения, рассчитывали по формулам:
SDR = (С18:1)/(С18:0+ С18:1),
ODR = (С 18:2 + С 18:3 )/( С 18:1 + С 18:2 + С 18:3 ),
LDR = (С18:3)/( С18:2+ С18:3), где С18:0, С18:1, С18:2 и С18:3– процентное содержание (от суммы ЖК) стеариновой, олеиновой, линолевой и линоленовой кислот соответственно [1].
Cтатистическую обработку результатов проводили с помощью программ Statistica 6.0 for Windows и Microsoft Excel 2007. Исследуемые параметры представлены как средние арифметические значения со стандартной ошибкой. Достоверность различий оценивали на основании t-критерия Стьюдента при доверительном интервале P0.05 [8].
РЕЗУЛЬТАТЫ
Изменение метеорологических и микроклиматических показателей
В таблице 1 приведены данные по метеорологическим условиям в предшествующую проведениям наблюдений декаду (III декада июня), собственно в период наблюдения (I декада июля) и последующую декаду (табл. 1). Так, в 2007 г. среднесуточные температуры изменялись в диапазоне 18-25 0С. Максимальная температура приходилась на первую декаду июля. Количество осадков в период с III декады июня по II декаду июля изменялось в щироких пределах и составило 443% и 5% от нормы соответственно. Число часов солнечного сияния было наибольшим в первую декаду июля. Температурный режим 2009 г. был более стабильным и холодным по сравнению с 2007 г. Максимальное количество осадков в этот год приходилось на I декаду июля, то есть на период проведения исследований. Этот же период 2009 г. отличался низким числом часов солнечного сияния. Метеоусловия 2010 г. характеризовались стабильными средними температурами, а также высоким числом часов солнечного сияния. В целом, метеоусловия за три года исследований существенно различа- лись, как в период наблюдений (I декада июля), так и в предшествующую и последующую декады (табл. 1).
Суточную динамику микроклиматических условий измеряли на открытом склоне и в густом травостое – характерных местообитаниях С-растений и Т-растений соответственно (табл. 2). Максимальная температура воздуха за все 3 года исследований наблюдалась в середине дня (1214 ч). В наиболее прохладный 2009 год диапазон изменений температуры в светлое время суток был меньше, чем в 2007 и 2010 гг. и составлял л 13-19 0С. В самом засушливом 2010 г. диапазон температуры варьировали от 16 до 33 0С, и в этом же году отмечены наибольшие температурные различия в местообитаниях. Максимальный уровень фотосинтетически активной радиации (ФАР), как и температуры был зарегистрирован в полуденное время (12-14 ч). Растения в густом травостое получали в 2-4 раза меньше солнечного света, чем растения, на открытом склоне. Относительная влажность воздуха в полуденные часы была в 1.5 – 2 раза ниже, чем в утреннее и вечернее время. Таким образом, С- и Т - растения испытывали кратковременные и продолжительные изменения условий обитания, связанные с изменениями температурного и светового и водного режима.
Изменение содержания суммарных липидов и отдельных липидных фракций
Количество общих липидов в листьях С-рас-тений составляло 36-81 мг, а Т-растений – 37-67 мг/ г сухой массы (табл. 3). Данный показатель менялся в зависимости от времени суток и погодных условий года. Большее количество общих липидов отмечено в листьях С-растений в дневное время 2007 г., то есть в условиях близких к норме. В наиболее дождливый год с минимальным количеством часов солнечного сияния (2009 г.) у С-растений наблюдали изменение общих липидов от 38 мг/г утром до 45 мг/г в вечернее время. У Т-растений суточная динамика общих липидов в 2009 и 2007 г.г. была аналогичной. В более засушливый 2010 г. количество липидов у С-расте-ний практически не менялось в течение дня, а у Т-растений снижалось к полуночи.
Основную часть общих липидов (более 75%) составили полярные ФЛ и гликолипиды (ГЛ), отвечающие за структуру мембран, остальную часть – нейтральные липиды (НЛ). Количество ГЛ у затененных растений, выросших в густом травостое, практически во всех случаях превышает их содержание в листьях растений, произрастающих на склоне. Динамика изменения количества ГЛ также зависела от времени суток и
Таблица 2. Микроклиматические условия в период наблюдения
|
Год и время суток (ч) |
T, oC |
ФАР, мкМ/м2с |
Отн. влажность воздуха, % |
|||
|
С-растения |
Т-растения |
С-растения |
Т-растения |
С-растения |
Т-растения |
|
|
2007 |
||||||
|
4:00 |
23 |
20 |
250 |
60 |
73 |
92 |
|
14:00 |
35 |
34 |
1070 |
480 |
36 |
42 |
|
21:00 |
25 |
25 |
40 |
40 |
85 |
79 |
|
2009 |
||||||
|
6:00 |
14 |
14 |
150 |
40 |
79 |
80 |
|
12:00 |
18 |
19 |
300 |
105 |
60 |
67 |
|
18:00 |
18 |
18 |
60 |
40 |
65 |
74 |
|
24:00 |
13 |
14 |
38 |
25 |
94 |
90 |
|
2010 |
||||||
|
6:00 |
16 |
17 |
543 |
63 |
66 |
85 |
|
14:00 |
33 |
25 |
1361 |
321 |
32 |
63 |
|
18:00 |
23 |
17 |
112 |
48 |
46 |
67 |
|
23:00 |
16 |
16 |
35 |
35 |
67 |
67 |
Таблица 3. Изменение количества общих липидов (ОЛ), глико- (ГЛ), фосфо- (ФЛ) и нейтральных липидов (НЛ) в листьях P. media в течение суток по данным 2007, 2009 и 2010 г.г.
Количество ФЛ у С-растений, как правило, ниже, чем у Т-растений (табл. 2). Максимальное содержание ФЛ наблюдалось во второй половине дня. Наибольшее количество ФЛ было отмечено в более засушливом 2010 г., причем у Т-рас-тений их было вдвое выше, чем у С-растений.
Фракционный состав ФЛ был более стабильным, чем ГЛ. Содержание НЛ в большей степени зависело от погодных условий, чем от времени суток (табл. 2). Так, в условиях наиболее близких к среднемноголетним (2007 г.) количество НЛ у С-, и у Т-растений было выше, чем в дождливый (2009) и аномально засушливый (2010) годы в 1,6-2,9 и 1,5-1,9 раз соответственно. Содержания НЛ у обоих фенотипов растений в 2009 г. и у Т-растений в 2007 г. мало изменялись в течение дня. В то же время, в листьях растений, обитающих на открытом участке и получающих больше света, содержание НЛ в 2007 г. снижалось, а в 2010 г – возрастало в послеполуденные часы.
Изменение содержания индивидуальных классов фосфолипидов
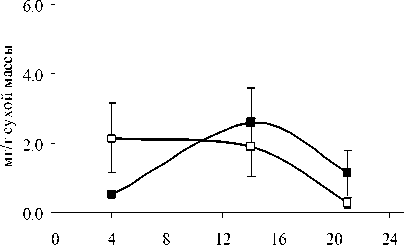
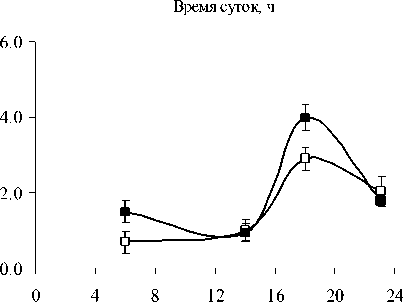
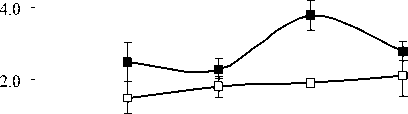
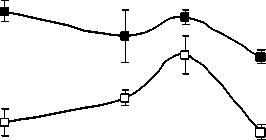
Структурно-функциональные свойства липидов и их локализация внутри клетки различаются. ГЛ локализованы в хлоропластах, а большая часть ФЛ является компонентами мембран наружной плазмалеммы и эндомембран. Качественный состав ФЛ у растений P. media, произрастающих в условиях Южного Тимана, не имел принципиальных отличий от состава ФЛ других фотосинтезирующих организмов и включал следующие компоненты: фосфатидилхолины (ФХ) (1,3-6,0 мг/г), фосфатидилэтаноламины (ФЭ) (0,7-2,9 мг/г), фосфатидилглицерины (ФГ) (0,95,3 мг/г), фосфатидилинозитолы (ФИ) (0,5-1,5 мг/г), фосфатидные кислоты (ФК) (0,0-2,7 мг/ г), дифосфатидилглицерины (ДФГ) (0,1-0,6 мг/ г сухой массы). Доля первых трех липидов обычно составляет более 70 % от суммы ФЛ, поэтому их можно отнести к основным ФЛ. Оставшиеся компоненты считают минорными. Мы проанализировали суточные и годовые изменения в содержании доминирующих в количественном от- ношении компонентов ФХ, ФЭ и ФГ (рисунок).
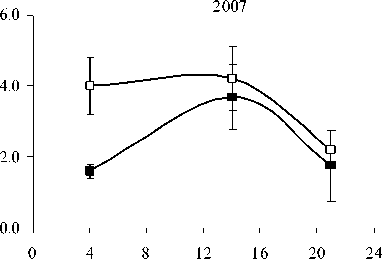
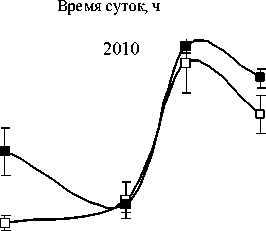
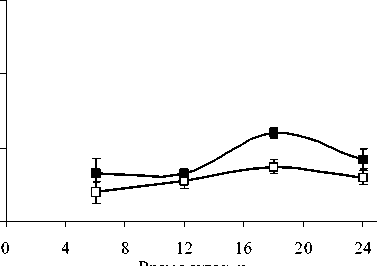
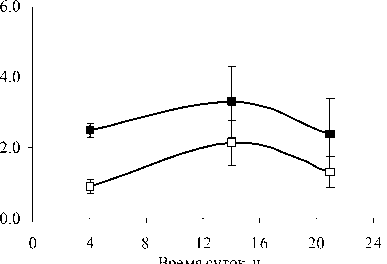
В 2007 г. ФХ были преобладающими липидами в составе световых и теневых растений, но у световых их содержание выше, чем у теневых. Максимальные количества ФХ приходятся на утреннее и дневное время. Такая же динамика характерна и для других главных ФЛ. В аномально влажном и прохладном 2009 г. Различия в содержании этого класса ФЛ между С- и Т-растения-ми менее выражены. В засушливом 2010 г. минимальное количество ФХ и ФЭ наблюдали в послеполуденные часы (14 ч), к вечеру (18 ч) отмечалось их значительное увеличение. Причем, динамика содержания ФХ и ФЭ была одинаковой как для С-, так и для Т- растений. Значительным отличием в содержании главных ФЛ в листьях растений 2010 г. было большее количество ФГ у Т-растений, по сравнению с С-растениями.
Из минорных компонентов ФЛ, стоит отметить ФК, уровень которых зависел от фенотипа, времени суток и года исследований (табл. 4). Например, в 2007 г. максимальное содержание ФК в листьях С-растений было отмечено в дневное, а у Т-растений – в вечернее время. В 2009 г. содержание ФК в период 6-18 ч практически не менялось, однако к вечеру возрастало в 1,3-1,4 раза у обоих фенотипов растений. Наибольшее содержание ФК (2,1-2,7 мг/г сухой массы) за все 3 года исследования отмечены в листьях С-растений в 2010 г. При этом, концентрация ФК в листьях Т-и С-растений различались в 1,3-2,6 раз.
Изменение состава жирных кислот
В составе ЖК листьев P. media идентифицировано около 20 компонентов. Для удобства анализа все ЖК распределили на несколько групп в зависимости от длины углеводородной цепи: ЖК с длиной цепи менее 16 атомов С, ЖК – 16-18 атомов С, ЖК – 20 и более атомов С; и в зависимости от степени ненасыщенности: насыщенные ЖК (НЖК) - двойные связи отсутствуют и ненасыщенные (ННЖК). Динамика содержания основных групп ЖК представлена в таблице 5. Среди ЖК листьев P. media кислоты С16 и С18 ряда составили более 90 %. Листья растений характеризовались сравнительно невысоким содержанием ЖК с короткой углеводородной цепочкой (1,56,9%) и ЖК с длиной цепи более 20 атомов С (1,03,1%). Сумма ННЖК составляла 60,5-76,8% и была представлена, в основном, кислотами С18 ряда. Большее содержание ННЖК было характерно для растений, собранных в прохладном 2009 г., а различия в содержании ЖК в зависимости от световых условий были отмечены 2007 г.
Более информативной характеристикой ненасыщенности ЖК считают ИН ЖК, который
Содержание ФГ, Содержание ФХ, мг/г сухой мас сы Р Н ^ ^ О М J^ m мг/г сухой мас сы
0 4 8 12162024
Время суток, ч
6.0
4.0
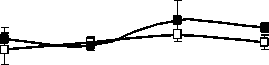
0.0
0 4 8 12162024
Вре мя суток, ч
6.0
0.0 н111111—
0 4 8 12162024
Время суто к, ч
6.0
4.0
2.0
0.0
0 4 8 12 16 20 24
Время суток, ч
Рис. 1. Изменение количества ФХ, ФЭ, ФГ в листьях P. media в течение суток по данным 2007, 2009 и 2010 г.г.
-
□ – С-растения, ■ – Т-растения
учитывает вклад кислот в зависимости от длины цепи и количества двойных связей. Эта величина согласно данным таблицы 5, также была максимальной у растений, выросших на свету в 2009 г. В этот год различия ИН между растениями световыми (1,85-2,05) и теневыми (1,931,99) были минимальны. В условиях 2007 г., характеризующихся более теплой температурой, обеспеченностью солнечным светом и влагой, ИН ЖК у световых растений был ниже (1,491,71) в сравнении с растениями, выросшими в тени (1,56-1,79).
Биосинтез ННЖК, таких как олеиновая (С18:1), линолевая (С18:2) и линоленовая (С18:3), у большинства видов высших растений осуществляется с участием ацил-липидных десатураз, обеспечивающих образование двойных связей в углеводородных цепях ЖК типа С18 (Лось, 2001). По данным литературы оценка активности ЖК десатураз с помощью стеароил- (SRD), олеил-(ORD) и линолеил- (LDR) десатуразных отношений позволяет в определенной мере судить о механизмах синтеза и роли ненасыщенных ЖК в устойчивости растений к неблагоприятным воздействиям [1]. Активность ацил-липидной 9 десатуразы, обеспечивающей введение первой двойной связи в стеариновую кислоту (С18:0), которая оценивается по стеароил – (SRD) десатуразному отношению, была более высокой в 2007 г. Активность 6- десатуразы, ответственной за введение второй двойной связи, была выше 2009 г. Иными словами, превращение олеиновой кислоты в линолевую протекало интенсивнее в 2009 г. В целом можно видеть, что активность 6 и 3 десатураз выше, чем активность 9 десатуразы (табл. 5).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Фосфолипиды являются главными липидами плазмалеммы и других непластидных эндомембран, и одними из первых реагируют на изменения в среде обитания. Действие различных физических и химических факторов приводит к освобождению из ФЛ плазмалеммы ФК, которая выступает в роли вторичного посредника, передающего сигнальный импульс на протеин-киназы и затем на факторы регуляции транскрипции, вызывая в конечном итоге экспрессию защитных генов [11]. Лучшими субстратами для фосфолипаз являются ФХ, ФЭ и ФГ [23]. Снижение уровня ФХ и ФЭ, наблюдаемое в полуденное время в растениях, собранных во влажный и аномально засушливый годы, по-видимо-му, свидетельствует об активации фосфолипазы D, сигнализирующей об избытке света и тепла (2010 г.) или, наоборот, о недостатке света (2009 г.). Ответной реакцией на этот сигнал стало усиление восстановительных процессов, о чем свидетельствует увеличение количества ФХ и ФЭ в последующий период (18.00 ч). Нельзя исключать также возможность снижения метаболической активности, которая происходит у растений при стрессе. Подобные стратегии были описаны для растений средиземноморского климата в условиях засухи [13].
Модификации пула ЖК отводят ведущую роль в адаптации организмов к условиям обитания. В литературе имеются данные, указывающие на значение количественных и качественных изменений ЖК для репарации ФС II при ингибировании [20]. Нами установлено влияние световых и температурных условий на комплекс ЖК листьев P. media . Так, превращение олеиновой ЖК в линолевую и линолевой ЖК – в линоленовую (ODR=0,96 и LDR=0,76) протекало интенсивнее в 2009 г., который отличался более низкой температурой в период вегетации. Такая динамика ОRD подтверждает, что экспрессия генов ацил-липидной 6 десатуразы зависит от температуры. Наибольшее содержание НЖК наблюдали в листьях световых растений в 2007 г. Следует подчеркнуть, что в условиях приближенных к норме, различия в составе ЖК между С- и Т-растениями были более выражены, чем у растений этих экотипов, выросших в засушливый и влажный годы .
Полученные результаты свидетельствуют о
Таблица 4. Изменение количества ФК (мг/г сухой массы) в листьях P. media в течение суток по данным 2007, 2009 и 2010 г.г.
|
Время суток, ч |
2007 г. |
2009 г. |
2010 г. |
|||
|
С-растения |
Т-растения |
С-растения |
Т-растения |
С-растения |
Т-растения |
|
|
4-6 |
1,3±0,1 |
1,6±0,1 |
0,9±0,0 |
1,0±0,1 |
1,4±0,1 |
2,5±0,1 |
|
12-14 |
1,1±0,1 |
1,9±0,2 |
0,7±0,1 |
0,9±0,1 |
1,3±0,1 |
2,7±0,2 |
|
18 |
- |
- |
0,9±0,0 |
1,2±0,1 |
1,6±0,1 |
2,1±0,1 |
|
21-24 |
1,8±0,2 |
1,5±0,1 |
1,3±0,1 |
1,5±0,1 |
1,0±0,1 |
2,6±0,1 |
Таблица 5. Динамика содержания основных групп ЖК липидов и активность ацил-липидных десатураз P. media
|
Показатель |
Содержание ЖК, % от суммы |
|||||
|
С-растения |
Т-растения |
|||||
|
4-6 ч |
12-14 ч |
21-24 ч |
4-6 ч |
12-14 ч |
21-24 ч |
|
|
2007 |
||||||
|
∑ С <16 ЖК |
6,90 |
3,55 |
4,25 |
4,30 |
2,80 |
5,30 |
|
∑ С 16 –С 18 ЖК |
90,70 |
95,20 |
94,80 |
93,95 |
95,85 |
91,60 |
|
∑ С 20 –С >20 ЖК |
2,40 |
1,25 |
0,95 |
1,75 |
1,35 |
3,10 |
|
∑ НЖК |
39,45 |
37,35 |
32,05 |
29,35 |
30,30 |
37,20 |
|
∑ ННЖК |
60,55 |
62,65 |
67,95 |
70,65 |
69,70 |
62,80 |
|
ИН |
1,49 |
1,48 |
1,71 |
1,77 |
1,79 |
1,56 |
|
SDR |
0,56 |
0,64 |
0,68 |
0,59 |
0,67 |
0,57 |
|
ODR |
0,89 |
0,85 |
0,93 |
0,95 |
0,92 |
0,93 |
|
LDR |
0,70 |
0,64 |
0,73 |
0,76 |
0,73 |
0,73 |
|
2009 |
||||||
|
∑ С <16 ЖК |
2,40 |
2,20 |
1,70 |
1,45 |
1,75 |
1,55 |
|
∑ С 16 –С 18 ЖК |
94,75 |
95,75 |
95,50 |
96,00 |
95,45 |
94,15 |
|
∑ С 20 –С >20 ЖК |
2,85 |
2,05 |
2,80 |
2,55 |
2,80 |
4,30 |
|
∑ НЖК |
28,50 |
23,20 |
24,40 |
24,75 |
26,25 |
26,60 |
|
∑ ННЖК |
71,50 |
76,80 |
75,60 |
75,25 |
73,75 |
73,40 |
|
ИН |
1,85 |
2,05 |
1,99 |
1,99 |
1,93 |
1,93 |
|
SDR |
0,49 |
0,52 |
0,52 |
0,47 |
0,51 |
0,44 |
|
ODR |
0,96 |
0,97 |
0,96 |
0,97 |
0,96 |
0,96 |
|
LDR |
0,71 |
0,76 |
0,73 |
0,74 |
0,71 |
0,70 |
|
2010 |
||||||
|
∑ С <16 ЖК |
2,65 |
2,30 |
2,10 |
1,50 |
1,60 |
1,80 |
|
∑ С 16 –С 18 ЖК |
94,40 |
95,85 |
96,00 |
95,95 |
96,60 |
94,80 |
|
∑ С 20 –С >20 ЖК |
2,95 |
1,85 |
1,90 |
2,55 |
1,80 |
3,40 |
|
∑ НЖК |
30,75 |
29,20 |
30,10 |
26,45 |
26,00 |
30,00 |
|
∑ ННЖК |
69,25 |
70,80 |
69,90 |
73,55 |
74,00 |
70,00 |
|
ИН |
1,70 |
1,78 |
1,75 |
1,88 |
1,89 |
1,77 |
|
SDR |
0,58 |
0,62 |
0,61 |
0,54 |
0,55 |
0,51 |
|
ODR |
0,92 |
0,92 |
0,92 |
0,95 |
0,95 |
0,94 |
|
LDR |
0,71 |
0,71 |
0,71 |
0,72 |
0,73 |
0,70 |
|
динамичности состава мембранных липидов в СПИСОК ЛИТЕРАТУРЫ зависимости от времени суток, погодных усло вий и типа местообитания. Способность к мор- 1. Алаудинова Е.В., Миронов П.В. Липиды меристем фологическим, функциональным и структур- лесообразующих хвойных пород центральной сиби ри в условиях низкотемпературной адаптации. 2. ным изменениям клетки обеспечивает устой- Особенности метаболизма жирных кислот фосфо- чивость растений подорожника к липидов меристем Larix sibirica Ledeb., Picea obovata произрастанию на Южном Тимане, широкому L. и Pinus sylvestris L. // Химия растительного сы- географическому распространению, а также к рья. 2009. № 2. С. 71-76. 2. Биологическое разнообразие особо охраняемых при- кратковременным и продолжительным коле- родных территорий Республики Коми. Вып. 4: Ох- баниям факторов среды. раняемые природные комплексы Тимана (Часть 1) |
||||||
/ СВ. [под ред. Дегтевой]. Сыктывкар, 2006. 272 с.
-
3. Головко Т.К., Далькэ И.В., Захожий ИГ. Дымова О.В., Табаленкова Г.Н. Функциональная пластичность и устойчивость фотосинтетического аппарата Plantago media L. к фотоингибированию. 1. Влияние световых условий местообитания на структуру, пигментный комплекс и фотосинтез листьев // Физиология растений. 2011. Т. 58. № 4. С. 490-501.
-
4. Гребенкина Т.М., Нестеров В.Н., Розенцвет О.А.,Бог-данова Е.С. Суточная динамика содержания липидов в листьях Plantago media L. // VII Съезд ОФР России «Физиология растений – фундаментальная основа экологии и инновационных биотехнологий». Нижний Новгород, 2011. Тез. Док. С. 199-200.
-
5. Гребенкина Т.М., Нестеров В.Н., Розенцвет О.А.,Богда-нова Е.С. Липиды листьев Plantago Media L // Известия Самарского НЦ РАН. 2011. Т. 13. № 5. С. 130-133.
-
6. Кейтс М. Техника липидологии. Выделение, анализ, и идентификация липидов. М: Мир, 1975. 322 с.
-
7. Кособрюхов А.А. Активность фотосинтетического аппарата при периодическом повышении концентрации СО2 // Физиология растений. 2009. Т. 56. № 1. С. 8-16.
-
8. Лакин Г.Ф. Биометрия. М.: Высшая школа, 1980. 293 c.
-
9. Лось Д.А. Структура, регуляция экспрессии и функционирование десатураз жирных кислот // Успехи биологической химии. 2001. Т. 41. С. 163-198.
-
10. Османова Г.О. Экобиоморфология и структура цено-популяций видов рода Plantago L. (Plantaginaceae Juss.) // Автореферат дисс. … докт. биол. наук. 2009. 37 с.
-
11. Тарчевский И.А. Сигнальные системы клеток растений. М.: Наука, 2002. 294 с.
-
12. Шишкин Б.К. Род 1381. Подорожник - Plantago L. Флора СССР. В 30-ти томах / Начато при руководстве и под главной редакцией акад. В.Л. Комарова. Л.: Издательство Академии Наук СССР. 1958. Т. XXIII. 148 с.
-
13. Grammatikopoulos G., Manetas Y. Direct absorption of water by hairy leaves of Phlomis fruticosa and its contribution to drought avoidance // Can. J. Bot. 1994. V. 72. P. 1805-1811.
-
14. Harwood J.L. Environmental factors which can alter lipid
metabolism // Progr. Lipid Res. 1994. V. 33, № 1/2. P. 193-202.
-
15. Kuiper P.J. Environmental Changes and Lipid Metabolism in Higher Plants // Plant Physiol. 1985. V. 64. P. l18-122.
-
16. Kuiper D., Smid A. Genetic Differentiation and Phenotypic Plasticity in Plantago major ssp. major. 1. The Effect of Differences in Level of Irradiance on Growth, Photo-synthesis, Respiration and Chlorophyll Content // Physiol. Plant. 1985. V. 60. P. 520-528.
-
17. Lambers H, Posthumus F., Stulen I., Lanting I., van de Dijk S.J., Hofstra R. Energy Metabolism of Plantago major ssp. major as Dependent on the Supply of Mineral Nutrients // Physiol. Plant. 1981. V. 51. P. 245-252.
-
18 . Lyons J.M., Weaton T.A., Pratt Y.K. Relationship between the Physical Nature of Mitochondrial Membranes // J. Plant Physiol. 1994. V. 143. P. 399-406.
-
19 . Mudrik V., Kosobrukhov A., Knyazeva I., Pigulevskaya T. Changes in the Photosynthetic Characteristics of Plantago major Plants Caused by Soil Drought Stress / / Plant Growth Regul. 2003. V. 40. P. 1-6.
-
20 . Murata N., Takahasi M. S., Nishiyama Y, Allakhverdiev S.I. Photoinhibition of Photosystem II under Environmental Stress // Biochem. Biophys. Acta. 2007. V. 1767. P. 414-421.
-
21 . Siegenthaler P.-A., Tremolieres A. Role of Acyl Lipids in the Function of photosynthetic membranes in Higher Plants // Lipids in Photosynthesis: Structure, Function and Genetics / Eds Siegenthaler P.-A., Tremolieres A. Dourdrecht: Kluwer Acad. Publ., 1998. P. 145.
-
22. Vaskovsky V.T., Latyshev N.A. Modified Jungnickels Reagent for Detecting Phospholipids and Other Phosphorus Compounds on Thin-layer Chromatograms // J. Chromatogr. 1975. V. 115. P. 246-249.
-
23. Wang X., Devaiah Sh.P., Zhang W., Welti, R. Signaling Functions of Phosphatidic Acid // Prog. Lipid Res. 2006. V. 45. P. 250-278.
-
24. Zunzunegui M., Barradas M.C.D., Alvarez-Cansino A.-L., Esquivias M.P., Novo F.G. Seasonal physiological рlasticity and recovery capacity after summer stress in Mediterranean scrub communities // Plant Ecol. 2011. V. 212. P. 127-142.
INFLUENCE OF SHORT-TERM AND LONG FLUCTUATIONS OF FACTORS OF ENVIRONMENT ON THE CONTENT OF LIPIDS PLANTAGO MEDIA L. IN THE CONDITIONS OF SOUTHERN TIMAN
-
1 Institute of Ecology of the Volga Basin Russian Academy of Science, Togliatti
-
2 Institute of Biology, Ural Branch, Russian Academy of Science, Syktyvkar
There were studied the influence of short-term (twenty-four hours) and long-term (annual weather conditions) fluctuations of environmental factors (temperature and light condition, provision with moisture) on the content of phospholipids and fatty acids of plants Plantago media L., growing in the Southern Timan. There were analyzed the plants of two ecotypes: the one from the open well lit site – C-plant, and another plants from dense herbage – T-plant. Stability of qualitative content of lipids and fatty acids in leaves of plants is shown. At the same time, changes in maintenance and correlation of separate lipids under the influence of external conditions are revealed. Environmental conditions exerted more expressed impact on the leaves lipids of light plants, than the shadow ones. The received results prove the dynamism of content of membrane lipids depending on part of day, weather conditions and habitat type.
Оlga Rozentsvet, Doctor of Biology, Leading Research Fellow.
Тatyana Grebenkina, Applicant
Тamara Golovko, Doctor of Biology, Professor.
Список литературы Влияние кратковременных и продолжительных колебаний факторов среды на состав липидов P lantago media L. В условиях Южного Тимана
- Алаудинова Е.В., Миронов П.В. Липиды меристем лесообразующих хвойных пород центральной сибири в условиях низкотемпературной адаптации. 2. Особенности метаболизма жирных кислот фосфолипидов меристем Larix sibirica Ledeb., Picea obovata L. и Pinus sylvestris L.//Химия растительного сырья. 2009. № 2. С. 71-76.
- Биологическое разнообразие особо охраняемых природных территорий Республики Коми. Вып. 4: Охраняемые природные комплексы Тимана (Часть 1)/СВ. [под ред. Дегтевой]. Сыктывкар, 2006. 272 с.
- Головко Т.К., Далькэ И.В., Захожий ИГ. Дымова О.В., Табаленкова Г.Н. Функциональная пластичность и устойчивость фотосинтетического аппарата Plantago media L. к фотоингибированию. 1. Влияние световых условий местообитания на структуру, пигментный комплекс и фотосинтез листьев//Физиология растений. 2011. Т. 58. № 4. С. 490-501.
- Гребенкина Т.М., Нестеров В.Н., Розенцвет О.А.,Богданова Е.С. Суточная динамика содержания липидов в листьях Plantago media L.//VII Съезд ОФР России «Физиология растений -фундаментальная основа экологии и инновационных биотехнологий». Нижний Новгород, 2011. Тез. Док. С. 199-200.
- Гребенкина Т.М., Нестеров В.Н., Розенцвет О.А.,Богданова Е.С. Липиды листьев Plantago Media L//Известия Самарского НЦ РАН. 2011. Т. 13. № 5. С. 130-133.
- Кейтс М. Техника липидологии. Выделение, анализ, и идентификация липидов. М: Мир, 1975. 322 с.
- Кособрюхов А.А. Активность фотосинтетического аппарата при периодическом повышении концентрации СО2//Физиология растений. 2009. Т. 56. № 1. С. 8-16.
- Лакин Г.Ф. Биометрия. М.: Высшая школа, 1980. 293 c.
- Лось Д.А. Структура, регуляция экспрессии и функционирование десатураз жирных кислот//Успехи биологической химии. 2001. Т. 41. С. 163-198.
- Османова Г.О. Экобиоморфология и структура ценопопуляций видов рода Plantago L. (Plantaginaceae Juss.)//Автореферат дисс. … докт. биол. наук. 2009. 37 с.
- Тарчевский И.А. Сигнальные системы клеток растений. М.: Наука, 2002. 294 с.
- Шишкин Б.К. Род 1381. Подорожник -Plantago L. Флора СССР. В 30-ти томах/Начато при руководстве и под главной редакцией акад. В.Л. Комарова. Л.: Издательство Академии Наук СССР. 1958. Т. XXIII. 148 с.
- Grammatikopoulos G., Manetas Y. Direct absorption of water by hairy leaves of Phlomis fruticosa and its contribution to drought avoidance//Can. J. Bot. 1994. V. 72. P. 1805-1811.
- Harwood J.L. Environmental factors which can alter lipid metabolism//Progr. Lipid Res. 1994. V. 33, № 1/2. P. 193-202.
- Kuiper P.J. Environmental Changes and Lipid Metabolism in Higher Plants//Plant Physiol. 1985. V. 64. P. l18-122.
- Kuiper D., Smid A. Genetic Differentiation and Phenotypic Plasticity in Plantago major ssp. major. 1. The Effect of Differences in Level of Irradiance on Growth, Photosynthesis, Respiration and Chlorophyll Content//Physiol. Plant. 1985. V. 60. P. 520-528.
- Lambers H, Posthumus F., Stulen I., Lanting I., van de Dijk S.J., Hofstra R. Energy Metabolism of Plantago major ssp. major as Dependent on the Supply of Mineral Nutrients//Physiol. Plant. 1981. V. 51. P. 245-252.
- Lyons J.M., Weaton T.A., Pratt Y.K. Relationship between the Physical Nature of Mitochondrial Membranes//J. Plant Physiol. 1994. V. 143. P. 399-406.
- Mudrik V., Kosobrukhov A., Knyazeva I., Pigulevskaya T. Changes in the Photosynthetic Characteristics of Plantago major Plants Caused by Soil Drought Stress//Plant Growth Regul. 2003. V. 40. P. 1-6.
- Murata N., Takahasi M. S., Nishiyama Y, Allakhverdiev S.I. Photoinhibition of Photosystem II under Environmental Stress//Biochem. Biophys. Acta. 2007. V. 1767. P. 414-421.
- Siegenthaler P.-A., Tremolieres A. Role of Acyl Lipids in the Function of photosynthetic membranes in Higher Plants//Lipids in Photosynthesis: Structure, Function and Genetics/Eds Siegenthaler P.-A., Tremolieres A. Dourdrecht: Kluwer Acad. Publ., 1998. P. 145.
- Vaskovsky V.T., Latyshev N.A. Modified Jungnickels Reagent for Detecting Phospholipids and Other Phosphorus Compounds on Thin-layer Chromatograms//J. Chromatogr. 1975. V. 115. P. 246-249.
- Wang X., Devaiah Sh.P., Zhang W., Welti, R. Signaling Functions of Phosphatidic Acid//Prog. Lipid Res. 2006. V. 45. P. 250-278.
- Zunzunegui M., Barradas M.C.D., Alvarez-Cansino A.-L., Esquivias M.P., Novo F.G. Seasonal physiological рlasticity and recovery capacity after summer stress in Mediterranean scrub communities//Plant Ecol. 2011. V. 212. P. 127-142.


