Влияние лектинов азоспирилл на активность протеолитических ферментов и их ингибиторов в корнях проростков пшеницы
Автор: Аленькина Светлана Александровна, Никитина Валентина Евгеньевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 1-1 т.18, 2016 года.
Бесплатный доступ
Резюме: Azospirillum brasilense обладающие потенциалом стимулировать рост растений, относятся к группе plant-growth-promoting bacteria (PGPB). Лектины, обнаруженные на поверхности бактерий Azospirillum brasilense Sp7 и Sp245 обладающие способностью связывать специфические углеводы, обеспечивают адгезию бактерий к поверхности корней. Целью данной работы явилось изучение возможного влияния лектинов A. brasilense Sp7 и A. brasilense Sp245 на активность протеаз и их ингибиторов в корнях проростков пшеницы. Для определения активности протеолитических ферментов и ингибиторов трипсина в клетках корней проростков пшеницы был использован спектрофотометрический метод. Было показано, что A. brasilense Sp7 вызывал снижение активности кислых (pH 3.5), нейтральных (рН 6.8) и щелочных (pH 7.8) протеиназ, в то же время лектин A. brasilense Sp245 оказывал активирующее действие на активность ферментов за исключением кислых протеиназ, активность которых оставалась неизменной. Лектины приводили к изменению соотношения активностей различных типов протеаз в прорастающих зерновках. Установлено увеличение трипсинингибирующей активности в корнях проростков пшеницы в присутствии изучаемых лектинов. Полученные в нашей работе результаты свидетельствуют о более широком, чем считалось ранее, спектре влияния лектинов азоспирилл на метаболизм растения-хозяина и в сочетании с уже имеющимися сведениями позволят внести коррективы в представления о механизмах взаимодействия бактерий с растениями при формировании ассоциации.
Ризосфера, ассоциативная азотфиксация, азоспириллы, лектины, корни проростков пшеницы, протеиназы, ингибиторы трипсина
Короткий адрес: https://sciup.org/148205718
IDR: 148205718 | УДК: 579.22
Текст научной статьи Влияние лектинов азоспирилл на активность протеолитических ферментов и их ингибиторов в корнях проростков пшеницы
дуктивность растения, остается открытым.
Образование азотфиксирующих систем, подобно как и любых других биологических межклеточных взаимодействий, согласно современным представлениям, включает функционирование молекул белковой природы – лектинов. Долгое время считалось, что в системе углевод-белкового взаимодействия при формировании азотфикси-рующих ассоциаций и симбиозов роль узнающих молекул выполняют лектины растений [2]. Однако появление новых знаний относительно лектинов азотфиксирующих бактерий заставило внести коррективы в систему взглядов по лектин-угле-водным взаимодействиям, реализуемым при возникновении азотфиксирующих ассоциаций с учетом роли бактериальных лектинов [8, 18].
Никитина с соавт. (1996) [6] показала присутствие на поверхности клеток азоспирилл лектинов, вовлеченных в бактериальную адгезию к корням. С поверхности двух отличающихся по способу колонизации растений штаммов ассоциативных азотфиксирующих бактерий - A. brasilense Sp7 и A. brasilense Sp245 были изолированы лектины, являющиеся гликопротеинами с различными молекулярными массами и углеводной специфичностью [8, 12]. Было показано, что лектины азоспирилл являются полифункциональными молекулами. Помимо адгезивной функции, они способны влиять на метаболизм растительной клетки - стимулировать прорастание семян [7], проявлять по отношению к растительной клетке митогенную и ферментмодифицирующую активности [11, 13], изменять содержание стрессовых метаболитов в растительной клетке, что свидетельствует о способности лектинов выступать в качестве индукторов адаптационных процессов корней проростков пшеницы [14].
Как известно, в защитно-приспособительные реакции растений на действие неблагоприятных факторов внешней среды вовлечены многие физиологические и биохимические процессы. Бóльшая их часть прямо или косвенно вовлечена в процесс формирования устойчивости [12].
Важную роль в обмене веществ живого организма и защите его от повреждения играют протеолитические ферменты. Они, контролируя концентрацию белков и пептидов, участвуют в модификации и устранении биополимеров, уже не выполняющих (или выполняющих не в полной мере) в этих условиях необходимые организму функции. Также протеолитические ферменты обеспечивают клетку мономерными субстратами для синтеза стрессовых (шоковых) белков, являющихся важным фактором устойчивости клеток [9]. В настоящее время установлено, что в процессах защиты растений от действия различных неблагоприятных факторов важная роль принадлежит ингибиторам протеолитических ферментов [10].
Целью данной работы была оценка возможного влияния лектинов A. brasilense Sp7 и A. brasilense Sp245 на активность протеаз и их ингибиторов в корнях проростков пшеницы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Микроорганизмы и условия культивирования. Объектом исследования служили два штамма азотфиксирующих ассоциативных бактерий рода Azospirillum – A. brasilense Sp7 (эпифитный) полученный из Института микробиологии им. С.Н. Виноградского РАН (г. Москва) и A. brasilense Sp245 (эндофитный) из коллекции микроорганизмов ИБФРМ РАН.
Получение препаратов лектинов . Выделение лектинов с поверхности клеток и очистку проводили ранее описанными способами [6].
Стерилизация семян, получение корней проростков и предобработка корней препаратами лектинов. Семена пшеницы Triticum aestivum L. сорта «Саратовская 29» (ГНУ НИИ Сельского хозяйства Юго-Востока РСХА, Саратов, Россия) были поверхностно стерилизованы в 70% (v/v) этаноле 1 мин, отмыты стерильной водой. Для получения корней проростков семена были выращены в асептических условиях в чашках Петри на стерильной дистиллированной воде.
Корни после экспозиции с препаратами лектинов (концентрации лектинов 5–40 мкг/мл, максимальное время инкубации – 1 ч), гомогенизировали в 0.15 М фосфатном буфере (рН 7.8). Гомогенат центрифугировали при 7000g, надосадочную жидкость использовали для определения протеолитической активности и активности ингибиторов.
Определение концентрации белка. Количество белка определяли по методу Бредфорд [15].
Определение протеолитической активности. Протеолитическую активность определяли по методу Ансона [3]. В качестве субстрата при определении кислых протеиназ использовали 0.5% гемоглобин (“Sigma”, США). Субстрат готовили на основе цитратно-фосфатного буфера с рН 4.5. При определении протеолитической активности нейтральных и щелочных протеиназ использовали 0.25% казеин (“Sigma”, США) на цитратно-фосфатном буфере (рН 6.8 и 7.8). Инкубационная среда содержала 0.1 мл гомогената, 0.1 мл субстрата, 0.1 мл буфера.
Для исследования влияния ингибиторов на активность ферментов в инкубационную среду добавляли ПХМБ (п- хлоромеркуриобензойная кислота) (“Sigma”, США), ЭДТА (этилендиамин-тетрауксусная кислота) (“Sigma”, США), ФМСФ (фенилметилсульфонилфторид) (“Sigma”, США) в конечной концентрации – 1 × 10-3, пепстатин – 2 × 10-5М (“Sigma”, США). Пробу выдерживали 1 ч при 37°С, после чего определяли остаточную активность. Остаточную активность выражали в процентах. За 100% (контроль) принимали активность фермента в отсутствие ингибиторов в реакционной смеси.
Определение активности ингибиторов трипсина. Ингибиторную активность оценивали по подавлению активности трипсина [4]. Использовали кристаллический трипсин фирмы “Serva” (Германия). Трипсинингибирующую активность выражали в мг чистого трипсина, связанного ингибитором на г сырой массы корней.
Статистическая обработка результатов. Статистическую обработку проводили с использованием критерия Стьюдента. На рисунках приведены средние арифметические значения по трем независимым опытам, проведенным в 5-кратной биологической повторности, и их стандартные ошибки. В статье обсуждаются величины, достоверные при P<0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
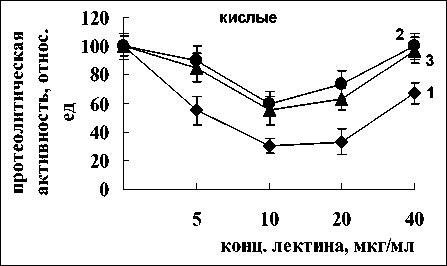
Определение уровня влияния лектинов A. brasilense Sp7 и A. brasilense Sp245 на протеолиз в корнях проростков пшеницы проводили при нескольких значениях рН, что позволило оценить влияние лектинов на активность различных протеиназ. Согласно данным, представленным на рис. 1, лектин A. brasilense Sp7 вызывал падение активности протеиназ при всех значениях рН. Наиболее значительным эффект оказался в отно-
a.
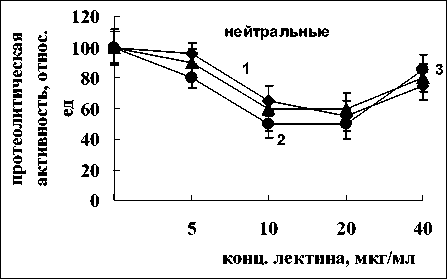
через 15 мин, достигая максимального значения после 30 мин инкубации. Для нейтральных ферментов повышение активности было более существенным. Наиболее эффективной в обоих случаях оказалась концентрация – 10 мкг/мл. Активность кислых протеиназ под влиянием лектина не изменялась (рис. 2).
Известно, что в распаде белков в семенах при прорастании участвуют ферменты, принадлежащие ко всем четырем механистическим классам протеаз – сериновые, аспартатные, цистеиновые, металлопротеазы. Для выяснения степени участия лектинов в изменении активности этих типов протеаз при используемых значениях pH
б.
в.
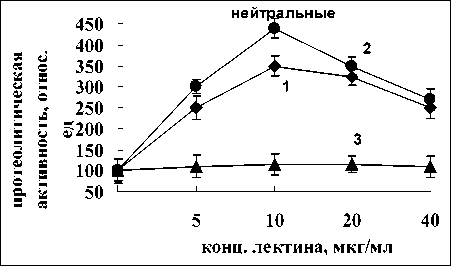
Рис. 1. Активность кислых, нейтральных и щелочных протеиназ в присутствии лектина A. brasilense Sp7:
контроль 100% - для кислых протеиназ –7 мкмоль тирозина мин-1 г сыр. массы-1, для нейтральных – 10 мкмоль тирозина мин-1 г сыр. массы-1, для щелочных – 0.5 мкмоль тирозина мин-1 г сыр. массы-1. 1-3 – время инкубации корней с лектином 15, 30, 60 мин, соответственно шении кислых и щелочных ферментов. Самыми эффективными ингибирующими концентрациями лектина при всех значениях рН явились 10 и 20 мкг/мл. Для кислых протеиназ наибольшее ингибирование наблюдалось при 15 мин инкубирования, для нейтральных протеиназ для всех временных промежутков активность ферментов не отличалась, для щелочных - наибольший ингибирующий эффект был отмечен при 15 и 30 мин воздействия лектина (рис. 1).
Лектин A. brasilense Sp245 оказывал противоположный эффект. Наблюдалось повышение активности нейтральных и щелочных протеиназ
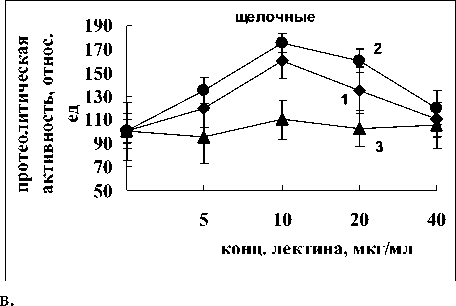
Рис. 2. Активность кислых, нейтральных и щелочных протеиназ в присутствии лектина A. brasilense Sp245:
контроль 100% - для кислых протеиназ –7 мкмоль тирозина мин-1 г сыр. массы-1, для нейтральных – 10 мкмоль тирозина мин-1 г сыр. массы-1, для щелочных – 0.5 мкмоль тирозина мин-1 г сыр. массы-1; 1-3 – время инкубации корней с лектином 15, 30, 60 мин, соответственно
нами была проведена самостоятельная серия опытов с применением ингибиторов протеаз. Для проведения этих экспериментов были взяты варианты с максимальными значениями ингибирования и активирования. В случае с лектином A. brasilense Sp7 вариант с концентрацией 10 мкг/ мл, временем инкубации 15 мин для кислых и 30 мин для нейтральных протеаз, 20 мкг/мл и 15 мин - для щелочных протеаз. Для лектина A. brasilense Sp245 вариант с концентрацией лектина – 10 мкг/мл и временем инкубации - 30 мин как для нейтральных, так и для щелочных протеаз.
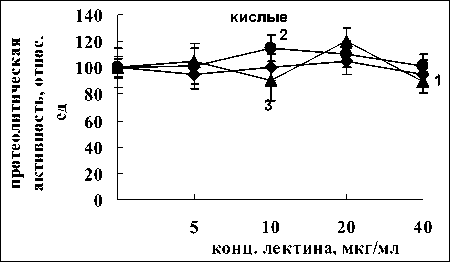
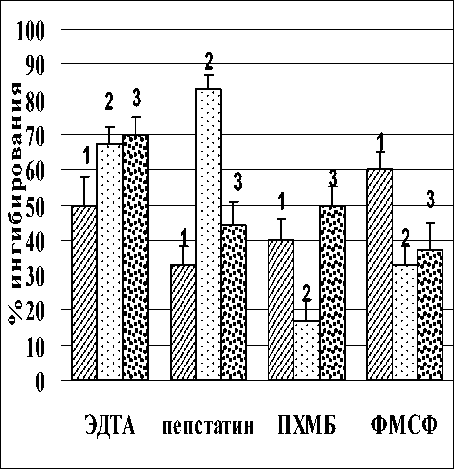
Как видно из рис. 3, основной вклад в уменьшение активности кислых протеиназ при воздействии лектина A. brasilense Sp7 вносили аспартатные протеиназы: в присутствии пепстатина активность снижалась на 50%. Влияние лектина на активность цистеиновых протеаз было значительно меньшим, так как снижение активности под влиянием ингибитора цистеиновых протеаз ПХМБ было ниже, чем в предыдущем случае. Добавление ЭДТА не приводило к изменению активности, что указывает на отсутствие влияния лектина на активность металлопротеаз при данном значении рН. Необходимо отметить, что именно аспартатные и цистеиновые протеазы, вносят большой вклад в расщепление запасных белков при прорастании зерновок злаковых культур при кислых значениях рН [1].
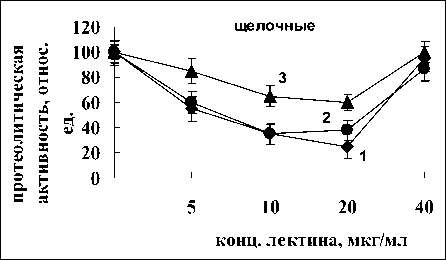
При рН 6.8 ингибирование активности протеаз после обработки лектином A. brasilense Sp7 происходило в большей мере за счет активности сериновых, аспартатных и металлопротеаз (степень ингибирования составила 33, 83 и 67 %, соответственно) и в меньшей за счет цистеиновых протеаз, так как ингибирование составляло всего лишь 17% (рис. 3 2 б). Обработка лектином A. brasilense Sp245 оказала большее влияние на активность металлопротеаз (степень ингибирования составила 70 %) и в меньшей на аспартатные, сериновые и цистеиновые протеазы, так как ингибирование составляло 44, 37 и 50%, соответственно (рис. 3).
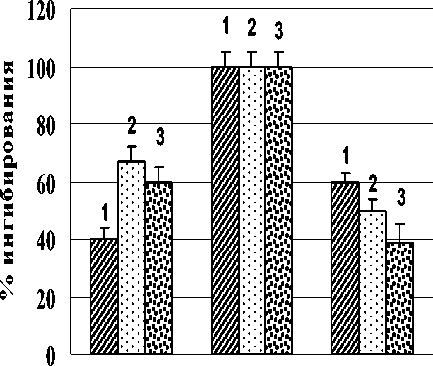
Анализ рис. 3 показал, что оба лектина не влияли на цистеиновые протеазы при щелочном значении pH. В то же время лектины оказывали влияние на металлопротеазы, так как в присутствии ЭДТА происходило существенное снижение активности (на 67% для A. brasilense Sp7 и 60% для A. brasilense Sp245). Отмечено влияние лектинов на сериновые протеазы. Добавление ФМСФ приводило к ингибированию активности в случае с лектином A. brasilense Sp7 на 50% и для лектина A. brasilense Sp245 на 39%. Очевидно, изменение активности щелочных протеаз, вызванное воздействием лектинов, происходит в значительной степени за счёт влияния на активность сериновых и металлопротеаз.
Один из способов регуляции активности протеолитических ферментов в клетках растений
ЭДТА
ПХМБ
ФМСФ
Рис. 3. Влияние ингибиторов на активность кислых, нейтральных и щелочных протеаз корней проростков пшеницы, подвергшихся воздействию лектинов A. brasilense Sp7 (2) и Sp245 (3): 1 – контроль реализуется с участием белков-ингибиторов, общим свойством которых является способность обратимо связывать ферменты в неактивные комплексы [18]. Растения синтезируют различные ингибиторы ферментов, среди которых наиболее широко представлены ингибиторы сериновых протеиназ, в частности, ингибиторы трипсина. У растений интенсивная выработка ингибиторов протеиназ наблюдается при механических повреждениях, при действии различных патогенов и т.д. [19].
Установлено, что оба лектина оказывали сходное воздействие на активность ингибиторов трипсина в корнях проростков (рис. 4). Обработка корней проростков лектинами штаммов Sp7 и
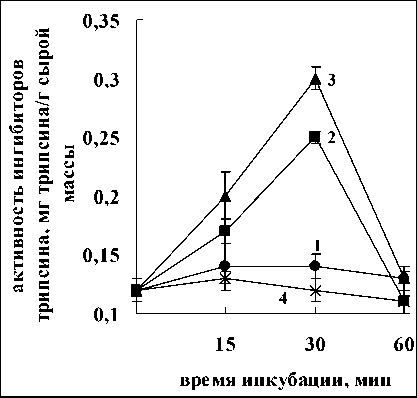
a.
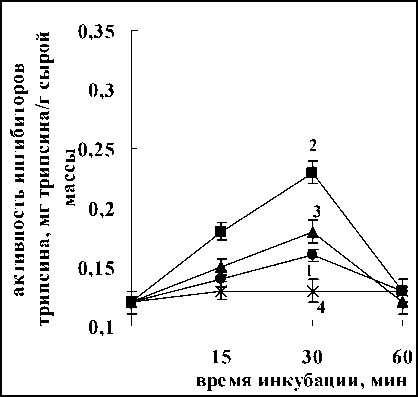
б.
Рис. 4. Активность ингибиторов трипсина в корнях проростков пшеницы после воздействия лектинов A. brasilense Sp7 (а) и A. brasilense Sp245 (б): контроль-корни (0,12 мг трипсина/г сырой массы);
1-4 – корни+лектины в концентрации – 5(1), 10(2), 20(3), 40(4) мкг/мл
Sp245 уже через 15 мин приводила к увеличению активности ингибиторов трипсина. Последующее воздействие вызывало дальнейшее повышение активности, которая достигала максимального значения к 30 мин. Затем происходило постепенное снижение активности. Необходимо подчеркнуть, что изменение активности ингибиторов трипсина для всех изучаемых концентраций лектинов имело сходную динамику, но максимальных значений активность ингибиторов достигала при различных концентрациях лектинов - 20 мкг/мл для лектина A. brasilense Sp7 и 10 мкг/мл для лектина A. brasilense Sp245 (рис. 4). Тот факт, что лектины, имеющие различную углеводную специфичность, проявляли одинаковый эффект, является очередным свидетельством того, что свойство лектинов связывать определенные углеводы не является основным для проявления биологических эффектов лектинами. Отмеченные различия в концентрациях, при которых достигался максимальный эффект, вероятно, можно объяснить различным количество сайтов связывания на молекулах лектинов, необходимых для проявления эффекта.
Таким образом, представленные результаты свидетельствуют о том, что обработка корней проростков пшеницы лектином A. brasilense Sp245 приводила к значительному повышению активности протеолитических ферментов и ингибиторов трипсина. В то же время, отмеченное для лектина A. brasilense Sp7 усиление активности ингибиторов трипсина, которое происходило на фоне снижения активности протеиназ, определяется их способностью обратимо связывать ферменты и переводить их в неактивное состояние [5].
Лектин A. brasilense Sp7 ингибирует активность протеолитических ферментов при всех из- учаемых значениях рН, в то же время воздействие лектина A. brasilense Sp245 связано с усилением протеолитических процессов лишь для нейтральных и щелочных значений рН. Лектины способны изменять соотношение активностей протеиназ различных типов. Наиболее существенные изменения при воздействии лектина A. brasilense Sp7 происходят за счёт падения активности кислых аспартатных и цистеиновых протеиназ, а также щелочных аспартатных и металлопроте-аз. Активирующий эффект лектина A. brasilense Sp245 обусловлен нейтральными аспартатными, цистеиновыми и металлопротеазами, а также щелочными металлопротеазами.
Как показывают данные других исследователей [9] изменение активности протеиназ и их ингибиторов в тканях является неспецифической ответной реакцией растений на действие стрессовых факторов биотического и абиотического характера. Из этого следует, что искусственное изменение баланса активности протеиназ и их ингибиторов в растительных тканях является одним из механизмов повышения их устойчивости. Наиболее перспективным в этом плане является возможность использования препаратов, приводящих к длительной индукции синтеза ингибиторов протеиназ в растениях. Изменения активности протеиназ и ингибиторов трипсина под воздействием лектинов на растения, когда, с одной стороны, в их клетках значительно усиливается накопление неактивных и поврежденных белков и пептидов, а с другой – возрастает необходимость в низкомолекулярных соединениях как исходного материала для синтеза стрессовых белков [12], вероятно, направлены на формирование устойчивости растений. В связи с этим вполне логично предположить, что лектины азоспирилл, имея несколько «каналов» воздействия на клетки [2, 11], могут влиять на устойчивость растений, в том числе и через изменение активности протеолитических ферментов и их ингибиторов.
Вероятной причиной различной функциональной активности лектинов может быть различная углеводная специфичность, структурные различия белков [13, 14], и как следствие, различное взаимодействие с поверхностью растительной клетки, что является определяющим фактором для включения последующих этапов. Различия могут быть связаны с возможным участием лектина A. brasilense Sp245 в проникновении бактерий во внутренние ткани корней, тем более, что ранее была показана активная роль протеолитических ферментов азоспирилл в этом процессе [11].
Все вышесказанное позволяет сделать вывод о том, что лектины могут влиять на устойчивость растений через изменение активности протеолитических ферментов и их ингибиторов. Полученные в нашей работе результаты демонстрируют более широкий, чем считалось ранее, спектр влияния лектинов азоспирилл на метаболизм растения-хозяина и в сочетании с уже имеющимися сведениями позволят сформировать целостную картину взаимодействия бактерий с растениями на молекулярном уровне.
Список литературы Влияние лектинов азоспирилл на активность протеолитических ферментов и их ингибиторов в корнях проростков пшеницы
- Александрова, И.Ф., Веселов, А.П., Ефременко, Ю.Р. Протеолитическая активность прорастающих семян пшеницы при тепловом стрессе//Физиология растений. 1999. Т. 46. № 2. С. 223-225.
- Антонюк Л.П., Евсеева Н.В. Лектин пшеницы как фактор растительно-микробной коммуникации и белок стрессового ответа//Микробиология. 2006. Т. 75. № 4. С. 544-549.
- Гильманов М.А., Фурсов О.В., Францев А.П. Методы очистки и изучения ферментов растений. Алма-Ата. 1981. 92 с.
- Ермаков А.И., Арасимович, В.В., Ярош, Н.П., Перуанский, Ю.В., Луковникова, Г.А., Иконникова, М.И. Методы биохимического исследования растений Л.: Агропромиздат, Ленингр. отд. 1987. 430 с.
- Мосолов В.В., Валуева Т.А. Участие протеолитических ферментов во взаимодействии растений с фитопатогенными микроорганизмами//Биохимия. 2006. Т. 71. № 8. С. 1034-1042.
- Изучение роли лектинов клеточной поверхности азоспирилл во взаимодействии с корнями пшеницы/В.Е. Никитина, С.А. Аленькина, Е.Г. Пономарева, Н.Н. Савенкова//Микробиология. 1996. Т. 65. № 2. С. 165-170.
- Влияние лектинов азоспирилл на способность семян к прорастанию/В.Е. Никитина, Н.В. Богомолова, Е.Г. Пономарева, О.И. Соколов//Известия РАН. Серия биологическая. 2004. № 4. С. 431-435.
- Никитина В.Е., Пономарева Е.Г., Аленькина С.А. Лектины клеточной поверхности азоспирилл и их роль в ассоциативных взаимоотношениях с растениями//Молекулярные основы взаимоотношений ассоциативных микроорганизмов с растениями . М.: Наука, 2005. С. 70-97.
- Тарчевский И.А. Метаболизм растений при стрессе. Казань: Фэн, 2001. 448 с.
- Фролова С.А., Титов А.Ф. Активность протеолитических ферментов и ингибиторов трипсина в листьях пшеницы в начальный период действия и в последействии низкой закаливающей температуры//Известия РАН. Сер. биол. 2008. № 5. С. 549-552.
- Внеклеточные протеолитические ферменты штамма Azospirillum brasilense Sp7 и регулирование их активности гомологичным лектином/М.П. Чернышева, С.А. Аленькина, В.Е. Никитина, В.В. Игнатов//Прикл. биохимия и микробиология. 2005. Т. 41. № 4. С. 444-448.
- Гемагглютинирующая активность и подвижность бактерий Azospirillum brasilense в присутствии разных источников азота/А.В. Шелудько, Е.Г. Пономарева, О.Э. Варшаломидзе, Е.И. Ветчинкина, Е.И. Кацы, В.Е. Никитина//Микробиология. 2009. № 6. С. 749-756.
- Effect of Azospirillum lectins on the activities of wheat-root hydrolytic enzymes/S.A. Alen’kina, O.A. Payusova, V.E. Nikitina//Plant and Soil. 2006. Vol. 283. P. 147 -151.
- Signal effects of the lectin from the associative nitrogen-fixing bacterium Azospirillum brasilense Sp7 in bacterial-plant root interactions/S.A. Alen’kina, V.A. Bogatyrev, L.Yu Matora, M.K.Sokolova, M.P. Chernysheva, K.A. Trutneva, V.E. Nikitina//Plant and Soil. 2014. Vol. 381. P. 337-349.
- Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding//Anal. Biochem. 1976. Vol. 72. P. 248-254.
- Azospirillum-plant relationships: physiological, molecular, agricultural, and environmental advances (1997-2003)/Y. Bashan, G. Holguin, L.E. de-Bashan//Can. J. Microbiol. 2004. Vol. 50. P. 521 -577.
- Bhattacharyya P.N., Jha D.K. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture//World J. Microbiol. Biotechnol. 2012. Vol. 28. P. 1327 -1350.
- Cell-surface lectins of Azospirillum spp/T. Castellanos, F. Ascencio, Y. Bashan//Curr. Microbiol. 1998. Vol. 36. P. 241-244.
- Joanitti G.A., Freitas S.M., Silva L.P. Proteinaceous protease inhibitors: Structural features and multiple functional faces//Current Enzyme Inhibition. 2006. Vol. 2. P. 199-217.


