Влияние липополисахарида из клеток Salmonella typhi на кровообращение и дыхание анестезированной крысы
Автор: Туманова Татьяна Сергеевна, Губаревич Елена Алексеевна, Александров Вячеслав Георгиевич
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Исследование механизмов, реализующих кардиореспираторные эффекты повышенного системного уровня бактериальных липополисахаридов (ЛПС), необходимо для понимания процессов, приводящих к нарушению дыхания и кровообращения при развитии системного воспалительного ответа. ЛПС разных видов бактерий отличаются по составу компонента, определяющего их активность. Цель настоящего исследования состояла в экспериментальной проверке предположения о том, что ЛПС, выделенный из клеток бактерии Salmonella tуphi, может оказывать влияние на рефлексы, участвующие в контроле кровообращения и дыхания. Материалы и методы. В острых экспериментах на крысах линии «Вистар» (n=23, масса 200-225 г), анестезированных уретаном (1800 мг/кг, в/б), регистрировали артериальное давление, пневмотахограмму и электромиограмму диафрагмы. Определяли среднее артериальное давление, частоту сердечных сокращений, дыхательный объём и минутный объём дыхания. Барорефлекс тестировали путем внутривенного введения раствора фенилэфрина, который вызывал дозозависимое повышение артериального давления и, как следствие, рефлекторное снижение частоты сердечных сокращений. Силу инспираторно-тормозящего рефлекса оценивали методом функциональной ваготомии. Величину учитываемых параметров определяли до и после внутривенного введения раствора, содержащего 100 мкг ЛПС или физиологического раствора. Отличия параметров от их исходных и контрольных значений оценивали по критерию Манна-Уитни и считали достоверными при p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Бактериальный липополисахарид, salmonella tуphi, кровообращение, дыхание, артериальный барорефлекс, инспираторно-тормозящий рефлекс
Короткий адрес: https://sciup.org/14117548
IDR: 14117548 | УДК: 612.1+612.2+612.017 | DOI: 10.34014/2227-1848-2020-1-138-149
Текст научной статьи Влияние липополисахарида из клеток Salmonella typhi на кровообращение и дыхание анестезированной крысы
Введение. Клеточная стенка грамотрица-тельных бактерий, входящих в состав микрофлоры кишечника, является источником липополисахарида (ЛПС), который постоянно присутствует в системном кровотоке и в нормальных условиях эффективно нейтрализуется антиэндотоксическими системами. Нарушение барьерной функции кишечника и массовое разрушение бактерий приводят к повышению системного уровня ЛПС. При попадании в системный кровоток ЛПС взаимодействует с циркулирующим ЛПС-связывающим белком, а затем с рецепторным комплексом
CD14/TLR4/MD-2, расположенным на поверхности иммунокомпетентных клеток. Это приводит к быстрой активации внутриклеточного сигнального пути, включению генов ядерного фактора каппа В (NF-kB) и усиленному синтезу провоспалительных цитокинов IL-1 и ФНО [1, 2]. В клинической картине развивающегося системного воспалительного ответа (СВО) доминируют сердечно-сосудистая и дыхательная дисфункции, которые проявляются, в частности, в изменении АД, тахикардии и гипервентиляции [3, 4]. Считается, что эндотоксическая активность ЛПС определя- ется главным образом одним из его компонентов, липидом А, который у разных видов бактерий отличается длиной, положением и количеством цепей жирных кислот. В частности, липиды А, входящие в состав ЛПС клеточной стенки Escherichia и Salmonella, являются бифосфорилированными, имеют асимметричное распределение жирных кислот, но различаются по их количеству. В состав липида А из Escherichia coli (E. coli) входит 6 жирных кислот, а в состав липида А из Salmonella typhi (S. tуfi) – 7 жирных кислот. MD-2 различает эту особенность структуры липида А и, в зависимости от неё, по-разному активирует TLR4 [2, 5, 6]. Кроме того, установлено, что и другие структурные компоненты ЛПС, которые отличаются у разных бактерий, могут влиять на эндотоксическую активность ЛПС [7]. Эти данные позволяют предполагать, что повышение системного уровня ЛПС, происходящего из разных видов бактерий, может по-разному воздействовать на продукцию цитокинов и, как следствие, оказывать различное влияние на функции систем дыхания и кровообращения при развитии СВО.
К настоящему времени установлено, что системное введение ЛПС приводит к повышению уровня провоспалительных цитокинов, в частности ФНО [8–12], и вызывает изменение артериального давления и повышение ЧСС [11, 12]. Кроме того, показано, что провоспа-лительные цитокины при повышении их системного и церебрального уровня изменяют паттерн внешнего дыхания, оказывают угнетающее действие на рефлекторные механизмы системы дыхания [13–18]. Установлено также, что эти эффекты реализуются посредством NO-ергических и простаноидзави-симых механизмов [16–18].
Таким образом, кардиореспираторные эффекты ЛПС, а также механизмы их реализации изучены достаточно подробно. Вместе с тем анализ литературных данных показывает, что особенности кардиореспираторных эффектов, которые могут проявляться в результате отличий в структуре ЛПС, выделенного из разных видов бактерий, практически не исследовались.
Цель исследования. Экспериментальная проверка предположения о том, что ЛПС, вы- деленный из клеток бактерии S. tуfi, может оказывать влияние на рефлексы, участвующие в контроле кровообращения и дыхания.
Материалы и методы. Эксперименты были проведены на 23 самцах крыс линии Wistar массой 200–225 г из ЦКП «Биоколлекция» ИФ РАН, анестезированных внутрибрюшинным введением уретана в дозировке 1800 мг/кг. Температура тела животных в ходе опытов поддерживалась на уровне 37±0,5 ºC. Содержание лабораторных животных, уход за ними, а также организация всех экспериментальных процедур осуществлялись в соответствии с Приложением А к Европейской конвенции о защите позвоночных животных, используемых в экспериментах и в других научных целях (ETS N 123).
Животные были разделены на две группы: контрольную (n=11) и экспериментальную (n=12). Хирургическая подготовка животного к эксперименту включала трахеостомию, катетеризацию бедренной артерии и вены, а также установку электромиографиче-ских электродов на реберную часть диафрагмы. К трахеостоме присоединялась пнев-мометрическая трубка, к артериальному катетеру – переходная камера датчика давления. Электроды, трубка и датчик подключались к предусилителям, которые формировали сигналы электромиограммы, пневмотахограммы и артериального давления. Cигналы поступали на вход устройства сбора данных PowerLab 8/32, работавшего под управлением пакета программ LabChart 7. Этот аппаратнопрограммный комплекс (AD Instruments, New Zealand) обеспечивал мониторинг и регистрацию артериального давления (АД), пневмотахограммы (ПТГ) и электромиограммы диафрагмы (ЭМГди). Кроме того, с его помощью производился расчёт и регистрация среднего артериального давления (АДср), частоты сердечных сокращений (ЧСС), дыхательного объема (ДО), частоты дыхания (ЧД), длительности вдохов (Тi) и минутного объема дыхания (МОД) в режимах on- и offline. Инспираторно-тормозящий рефлекс Геринга–Брейера (ИТР) оценивался методом функциональной ваготомии, который реализуется путем окклюзии верхних дыхательных путей в конце выдоха. Сила ИТР характеризовалась про- центным соотношением длительности первого окклюзионного «вдоха» и длительности последнего свободного вдоха перед окклюзией [18, 19], причем длительности вдохов определялись по ЭМГди. Тестирование артериального барорефлекса (БР) осуществлялось путем болюсного введения α-адреномиметика фенилэфрина в дозировке 0,05 мг/кг. Затем средствами программного пакета MS Excel определялся угловой коэффициент а в уравнении линейной функции y=ax+k, аппроксимирующей зависимость между ростом АДср и падением ЧСС. Величина a определяет наклон аппроксимирующей прямой линии и отражает силу БР: коэффициент увеличивается при усилении и уменьшается при ослаблении БР. Через час после начала эксперимента контрольным животным вводилось 2 мл физиологического раствора. Животным основной группы также через час вводилось 2 мл раствора, содержащего ЛПС, выделенный из клеток бактерии S. typhi (препарат «Пирогенал», пр-во «Медгамал», Россия), в дозировке 0,9 мг/кг. Общая длительность эксперимента составляла 3 ч. По завершении эксперимента животные усыплялись передозировкой анестетика. Значения величин определялись с интервалом 10 мин и нормировались относительно их фоновых значений на 60-й мин эксперимента, перед введением раствора. Тестирование БР производилось каждые 30 мин и нормировалось относительно 40-й мин.
Статистическая обработка данных производилась при помощи пакетов программ MS Excel и Statistica for Windows. Рассчитывались средние значения абсолютных и нормированных величин и ошибки средних. Полученные величины сводились в таблицы и использовались для построения графиков. Значения учитываемых параметров после введения ЛПС сравнивались со значениями, полученными непосредственно перед введением ЛПС (фоновые значения), а также со значениями, полученными в контрольных экспериментах. Для определения достоверности наблюдавшихся изменений использовался непараметрический критерий Манна–Уитни. Различия считались достоверными при р<0,05.
Результаты. Эксперименты показали, что к 60-й мин от начала регистрации показа- тели, характеризующие состояние систем кровообращения и дыхания, стабилизировались, поскольку не было обнаружено достоверных различий между их значениями на 20-й, 40-й и 60-й мин. Кроме того, не было обнаружено достоверных различий между их значениями, полученными в контрольных экспериментах и в экспериментах с введением ЛПС (табл. 1).
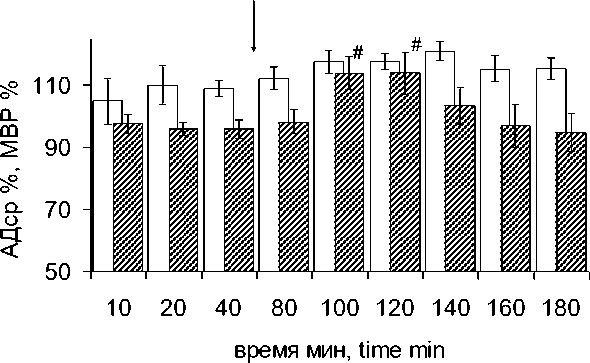
Полученные результаты свидетельствуют о том, что введение физиологического раствора не оказывало статистически значимого влияния на величину АД ср (рис. 1а). Вместе с тем через 40 мин после введения раствора, содержащего ЛПС, наблюдалось статистически значимое увеличение величины АД ср по сравнению с его фоновыми показателями, которое сохранялось и на 120-й мин. Затем значения АД ср возвращались к исходным величинам и не отличались от значений, полученных в контрольных экспериментах.
ЧСС была стабильна в контрольных экспериментах и начинала возрастать после введения ЛПС (рис. 1б). На 120-й мин ЧСС была достоверно выше фоновых и контрольных значений и продолжала расти до конца эксперимента.
Таким образом, полученные результаты свидетельствуют о том, что ЛПС при его внутривенном введении оказывает влияние на систему кровообращения, повышая ЧСС.
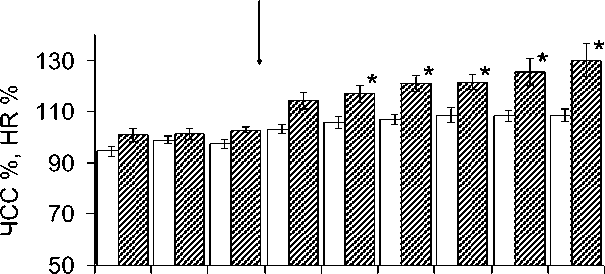
В контрольных экспериментах ДО оставался относительно стабильным, не обнаруживая каких-то определенных изменений (рис. 2а). В то же время ЛПС вызывал небольшое, но статистически значимое увеличение ДО начиная со 120-й мин эксперимента, т.е. через 60 мин после введения вещества (рис. 2а). При этом достоверных отличий между величинами ЧД, полученными в этих сериях экспериментов, получено не было. МОД в контрольной серии экспериментов был стабилен, несколько снижаясь к концу эксперимента (рис. 2б). Напротив, после введения ЛПС наблюдался постепенный рост МОД. На 140-й мин и до конца эксперимента величина МОД была достоверно больше его фоновых и контрольных значений. Очевидно, что введение ЛПС приводило к увеличению вентиляции, главным образом за счет роста ДО.
Таблица 1
Table 1
Абсолютные величины учитываемых показателей до введения контрольного и экспериментального растворов
Absolute values of relevant indicators before control and experimental solution administration
|
Показатели Parameters |
Группа Group |
10-я мин 10th min |
20-я мин 20th min |
40-я мин 40th min |
60-я мин 60th min |
|
АД ср , мм рт. ст. Mean ABP, mm Hg |
контрольная control |
76±4 |
73±4 |
72±2,8 |
73±3 |
|
экспериментальная experimental |
67±4 |
66±3 |
62±34 |
68±3 |
|
|
ЧСС, уд./мин HR, BPMs |
контрольная control |
359±15 |
362±12 |
375±12 |
385±14 |
|
экспериментальная experimental |
397±14 |
400±13 |
404±10 |
407±14 |
|
|
ЧД, ц/мин RF, min-1 |
контрольная control |
114±5 |
108±6 |
109±5 |
111±6 |
|
экспериментальная experimental |
120±6 |
122±7 |
123±10 |
122±6 |
|
|
ДО, мл TVe, ml |
контрольная control |
1,5±0,2 |
1,6±0,2 |
1,5±0,2 |
1,5±0,2 |
|
экспериментальная experimental |
1,9±0,3 |
2,0±0,4 |
1,8±0,2 |
1,9±0,3 |
|
|
МОД, мл/мин RMVe, ml/min |
контрольная control |
157±21 |
168±19 |
160±17 |
164±17 |
|
экспериментальная experimental |
235±53 |
241±55 |
221±60 |
236±53 |
|
|
Тi оккл, % Ti occl, % |
контрольная control |
142±6 |
140±6 |
140±3 |
148±4 |
|
экспериментальная experimental |
150±7 |
159±9 |
143±4 |
153±5 |
|
|
Коэффициент а Coefficient a |
контрольная control |
1,6±0,12 |
- |
1,6±0,19 |
- |
|
экспериментальная experimental |
1,5±0,18 |
- |
1,5±0,12 |
- |
а
а
б b
10 20 40 80 100 120 140 160 180время мин, time min
□ Контрольная группа Сontrol group^ Экспериментальная группа Еxperimental group
Рис. 1. Изменения АД ср (а) и ЧСС (б) в экспериментальной и контрольной группах. Стрелка – момент введения растворов.
-
# – достоверные отличия от фоновых значений при p<0,05;
* – достоверные отличия от фоновых и контрольных значений при p<0,05.
На рис. 2 и 3 обозначения те же
Fig. 1. Changes in mean blood pressure (a) and heart rate (b) in experimental and control groups. Arrow points the moment of injection.
-
# – the differences from the background values are significant at p<0.05;
-
* – the differences from the background and control values are significant at p<0.05 The designations in Fig. 2 and 3 are the same
а
а
б b
ш
О
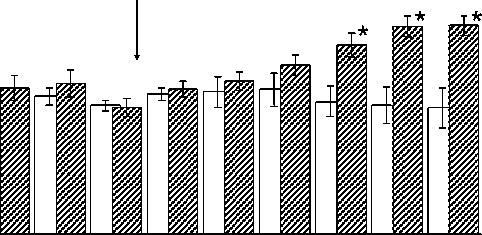
10 20 40 80 100 120 140 160 180время мин, time min
□ Контрольная группа Control groupЭкспериментальная группа Experimental group
Рис. 2. Изменение ДО (а) и МОД (б) в контрольных экспериментах и в экспериментах с введением ЛПС
Fig. 2. Changes in tidal volume (TVe) (a) and respiratory minute volume (RMVe) (b) in control experiments and in experiments with LPS administration
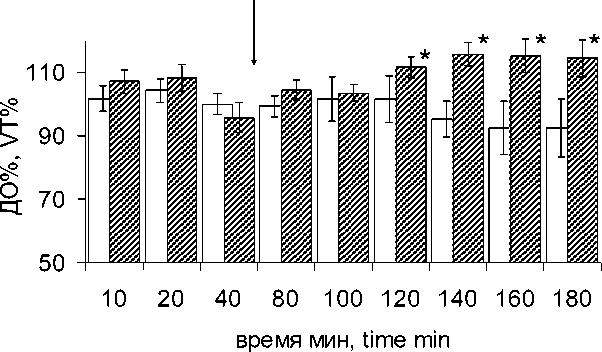
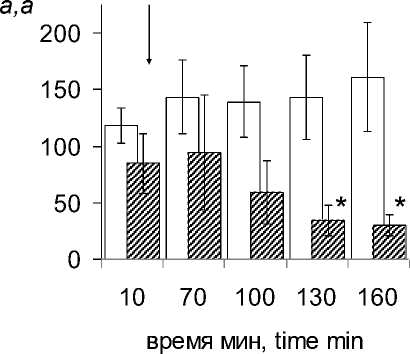
Тестирование БР в контрольных экспериментах и в экспериментах с введением ЛПС показало, что начальные значения показателя силы этого рефлекса, определенные до введения раствора, на 40-й мин эксперимента, составляли соответственно 1,6±0,2 и 1,4±0,4. Эти величины не имели достоверных отличий между собой; при нормировании данных, полученных в соответствующих сериях экспериментов, они были приняты за 100 % (рис. 3а). После введения физиологического раствора наблюдалось усиление барорефлекса, которое не было, однако, статистически значимым. Под влиянием ЛПС про- исходило достоверное ослабление барорефлекса (рис. 3а).
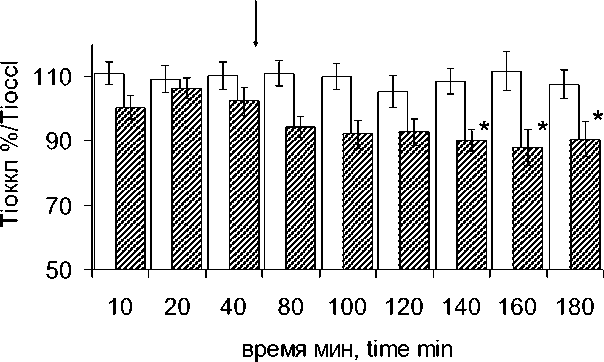
Тестирование ИТР показало его стабильность в контрольных экспериментах и постепенное ослабление после введения ЛПС (рис. 3б). Через 40 мин после введения показатель силы ИТР уменьшался до величины, статистически значимо отличавшейся от фоновых и контрольных значений, и продолжал постепенно снижаться вплоть до конца эксперимента. Таким образом, полученные результаты показали, что влияние ЛПС на рефлекторные механизмы регуляции систем кровообращения и дыхания проявляется в их ослаблении.
а
а
б b
Контрольная группа/Control groupЭкспериментальная группа/Experimental group
Рис. 3. Изменение силы БР (а) и ИТР (б) в контрольных экспериментах и экспериментах с введением ЛПС
Fig. 3. Changes in the power of baroreflex (a) and inspiratory-inhibitory reflex (IIR) (b) in control experiments and in experiments with LPS administration.
Обсуждение. Итак, в результате проведенных экспериментов было установлено, что системное введение ЛПС, выделенного из клеток бактерии S. typhi , вызывает повышение ЧСС и МОД у крыс, анестезированных уретаном. Кроме того, происходит ослабление двух важных рефлекторных механизмов, участвующих в контроле функций кровообращения и дыхания, а именно БР и ИТР. Нашими предыдущими исследованиями было установлено, что подобные эффекты вызывает введение
ЛПС, выделенного из клеток E. coli [21]. При системном введении этого вещества анестезированным крысам происходило повышение ЧСС, увеличение ДО и МОД, а также ослабление барорефлекса и инспираторно-тормозящего рефлекса. Вместе с тем следует отметить, что ЛПС из E. coli вызывал снижение АД, а в экспериментах с ЛПС из S. typhi мы не наблюдали снижения АД. Напротив, через 40 мин после введения вещества отмечалось временное увеличение АД ср , а ещё через
40 мин уровень АД ср возвращался к исходным значениям. Это различие могло быть вызвано разницей в дозировках, применявшихся при исследовании ЛПС разного происхождения. По-видимому, следует признать, что по основным параметрам, ЧСС и вентиляции, а также по рефлекторным механизмам циркуляторная и респираторная системы крысы, анестезированной уретаном, сходным образом реагируют на ЛПС, выделенный из разных видов бактерий.
С одной стороны, известно, что несмотря на то что механизмы действия липополисахаридов на иммунокомпетентные клетки могут изменяться в зависимости изменений в структуре их молекулы, конечным результатом будет выделение провоспалительных цитокинов, в частности ФНО [8]. С другой стороны, в предыдущих экспериментах на крысах, анестезированных уретаном, нами было установлено, что экзогенное повышение системного уровня ФНО усиливает вентиляцию за счет роста ДО и ослабляет инспираторно-тормозящий рефлекс [18]. Было показано, что эти эффекты устраняются диклофенаком, который оказывает ингибирующее действие на проста-гландин-эндопероксид синтазу (КФ 1.14.99.1, циклооксигеназа (ЦОГ)). Поскольку, кроме того, известно, что ФНО вызывает экспрессию ряда белков, включая ЦОГ, был сделан вывод о том, что респираторные эффекты, которые наблюдаются при повышении его системного уровня, являются следствием повышения системного уровня простагландинов и их действия на нервные механизмы регуляции дыхания. Таким образом, представляется вполне вероятным, что те изменения в функциях сердечно-сосудистой и респираторной систем, которые наблюдались в наших экспериментах в результате введения ЛПС из клеток S. tуfi , являются следствием повышения системного уровня ФНО, усиления синтеза ЦОГ и повышения уровня простагландинов.
Возможны и другие пути реализации наблюдавшихся нами эффектов, поскольку введение ЛПС вызывает продукцию не только ФНО, но и других провоспалительных цитокинов, в частности интерлейкина-1-бета (ИЛ-1β). Установлено, что экзогенное повышение системного уровня ИЛ-1β приводит к изменению состояния респираторной системы анестезированной крысы, причем его эффекты также реализуются посредством простаноид-зависимых механизмов [15, 16]. В свою очередь простагландины выступают в роли ингибирующих модуляторов, оказывающих своё действие на уровне продолговатого мозга, в цепях нейронов, осуществляющих контроль дыхания и кровообращения [21, 22].
Заключение. Полученные результаты свидетельствуют о том, что экзогенное повышение системного уровня ЛПС, выделенного из бактерии S. tуfi , взывает изменения в состоянии систем дыхания и кровообращения крысы, анестезированной уретаном. Эти изменения проявляются в тахикардии, усилении вентиляции и ослаблении рефлекторных механизмов регуляции систем дыхания и кровообращения. Подобные изменения наблюдались при моделировании СВО путем введения ЛПС из клеток E. coli , а также при экзогенном повышении системного уровня ФНО на том же объекте в аналогичных экспериментальных условиях. Поэтому вероятно, что обнаруженные эффекты ЛПС, выделенного из S. tуfi , также реализуются при посредничестве ФНО, который вызывает рост циклооксигеназной активности и, соответственно, усиление синтеза простагландинов. Таким образом, можно полагать, что в условиях модельных экспериментов на анестезированных животных ЛПС, выделенные из разных источников, несмотря на разницу в тонком строении их молекул, оказывают сходное действие на функции дыхания и кровообращения, в т.ч. на рефлекторные механизмы их регуляции.
Список литературы Влияние липополисахарида из клеток Salmonella typhi на кровообращение и дыхание анестезированной крысы
- Heumann D., Roger T. Initial responses to endotoxins and Gram-negative bacteria. Clin. Chim. Acta. 2002; 323 (1-2): 59-72.
- Yang H. Cellular events mediated by lipopolysaccharide-stimulated toll-like receptor 4MD-2 is required for activation of mitogen-activated protein kinases and Elk-1. J. Biol. Chem. 2000; 275 (27): 2086120866.
- Singer M., Deutschman C.S., Seymour C. W. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016; 315 (8): 801-810. DOI: 10.1001/jama.2016.0287
- Marik P.E., Taeb A.M. SIRS, qSOFA and new sepsis definition. J. Thorac. Dis. 2017. 9 (4): 943-945. DOI: 10.21037/jtd.2017.03.125
- Simpson B.W., Trent M.S. Pushing the envelope: LPS modifications and their consequences. Nat. Rev. Microbiol. 2019; 17 (7): 403-416. DOI: 10.1038/s41579-019-0201-x
- Tsukamoto H. Lipopolysaccharide-binding protein-mediated Toll-like receptor 4 dimerization enables rapid signal transduction against lipopolysaccharide stimulation on membrane-associated CD14-express-ing cells. Int. Immunol. 2010; 22 (4): 271-280.
- Steven S. Time response of oxidative/nitrosative S-stress and inflammation in LPS-induced endotoxe-mia - a comparative study of mice and rats. Int. J. Mol. Sci. 2017; 18 (10): 2176.
- Волошина Е.В., Зубова С.В., Прохоренко С.В. Сравнение эффектов разных хемотипов липополиса-харидов из Escherichia Coli и Salmonella на синтез TNF-а и IL-6 макрофаго-подобными клетками ТНР-1. Медицинская иммунология. 2009; 11 (6): 509-514.
- Shangze G. Histidine rich glycoprotein ameliorates endothelial barrier dysfunction through regulation of NFkB and MAPK signal pathway. Br. J. Pharmacol. 2019; 176 (15): 2808-2824.
- Koike-Kiriyama N., Adachi Y., Iwasaki M. High mortality rate of (NZWxBXSB) F1 mice induced by administration of lipopolysaccharide attributes to high production of tumor necrosis factor-alpha by increased numbers of dendritic cells. Clin. Exp. Immunol. 2008; 154: 285-293.
- Stahl O. Mimicry of human sepsis in a rat model - prospects and limitations. J. Surg. Res. 2013; 179 (1): e167-e175.
- Altavilla D., Squadrito G., MinutoliL. Inhibition of nuclear factor-kappaB activation by IRFI 042, protects against endotoxin-induced shock. Cardiovasc. Res. 2002; 54: 684-693.
- Aleksandrova N.P., Danilova G.A. Effect of intracerebroventricular injection of interleukin-1beta on the ventilatory response to hyperoxic hypercapnia. Eur. J. Med. Res. 2010; 15 (II): 3-6.
- Александрова Н.П. Цитокины и резистивное дыхание. Физиология человека. 2012; 38 (2): 119-129.
- Александрова Н.П., Меркурьев В.А., Александров В.Г. Влияние интерлейкина-1 на паттерн дыхания и инспираторно-тормозящий рефлекс Геринга-Брейера. Вестник ТвГУ. Сер. Биология и экология. 2013; 2: 9-17.
- Александрова Н.П., Меркурьев В.А., Туманова Т.С., Александров В.Г. Механизмы модуляции рефлекторного контроля дыхания при повышении системного уровня провоспалительного цитокина интерлейкина-1ß. Российский физиологический журнал им. И.М. Сеченова. 2015; 101 (10): 1158-1168.
- Александров В.Г., Александрова Н.П., Туманова Т.С., Евсеева А.Д., Меркурьев В.А. Участие NO-ер-гических механизмов в реализации респираторных эффектов провоспалительного цитокина интерлейкина-1бета. Российский физиологический журнал им. И.М. Сеченова. 2015; 101 (12): 1373-1385.
- Александров В.Г., Туманова Т.С., Александрова Н.П. Диклофенак устраняет дыхательные эффекты фактора некроза опухоли у крыс. Журнал эволюционной биохимии и физиологии. 2018; 54 (4): 298-300.
- Mortola J.P., Trippenbach T., Rezzonico R. Hering-Breuer reflexes in high-altitude infants. Clin. Sci. 1995; 88: 345-350.
- Aleksandrova N.P., Aleksandrov V.G., Ivanova T.G. Effects of Gamma-Aminobutyric Acid on the Hering-Breuer Inspiration-Inhibiting Reflex. Neurosci. Behav. Physiol. 2010; 40 (2): 165-171.
- Туманова Т.С., Александров В.Г. Влияние бактериального липополисахарида на рефлекторные механизмы кардиореспираторной системы анестезированной крысы. Научные труды V съезда физиологов СНГ. 4-8 октября 2016. Сочи - Дагомыс; 2016: 158.
- Forsberg D., Ringstedt T., Herlenius E. Astrocytes release prostaglandin E2 to modify respiratory network activity. Elife. 2017; 6. URL: https://elifesciences.org/articles/29566 (дата обращения: 24.11.2019).
- DOI: 10.7554/eLife.29566


