Влияние липосомальной формы полиненасыщенных жирных кислот на процессы перекисного окисления липидов
Автор: Ламажапова Г.П., Жамсаранова С.Д., Бурнашева Е.В.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 4 (49), 2014 года.
Бесплатный доступ
Изучены некоторые показатели перекисного окисления липидов и суммарное содержание антиоксидантов (CCA) в сыворотке крови и печени экспериментальных животных при гиперлипидемии, вызванной детергентом Твин-80. В работе установлено, что введение липосомальной формы полиненасыщенных жирных кислот вызывало снижение продуктов перекисного окисления липидов в тканях экспериментальных животных. Существенного изменения уровня CCA в анализируемых объектах не наблюдалось.
Полиненасыщенные жирные кислоты, перекисное окисление липидов, малоновый диальдегид, суммарное содержание антиоксидантов, липосомы, дислипидемия
Короткий адрес: https://sciup.org/142148186
IDR: 142148186 | УДК: 577.125.33:
Текст научной статьи Влияние липосомальной формы полиненасыщенных жирных кислот на процессы перекисного окисления липидов
Характерной особенностью утвержденных «Норм физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации» (МР 2.3.1.24.32-08) является установление нормативных уровней потребления целого ряда ранее не нормируемых, но очень важных минорных компонентов пищи, обладающих высокой биологической активностью. К числу таких компонентов относятся и полиненасыщенные жирные кислоты (ПНЖК).
Потребность в ПНЖК определена от 6 до 10% от энергетической ценности суточного рациона, при этом потребность в ω-3 ПНЖК от 1 до 2% от суммы ккал. При этом важно, чтобы соотношение ω-6/ω-3 ПНЖК в рационе здорового человека составляло 10:1, а в случае болезни – 5:1 и даже 3:1. В питании населения России реальное соотношение ω-6/ω-3 ПНЖК составляет от 10:1 до 30:1, таким образом, испытывается постоянный острый дефицит в ω-3 ПНЖК и, прежде всего, в эйкозапентаеновой (ЭПК) и докозогексаеновой (ДГК) кислотах. Известно, что ПНЖК оказывают выраженное влияние на липидный состав и атерогенный потенциал крови и других тканей организма.
Наличие большого числа двойных связей в структуре ПНЖК делает их главной мишенью для активных форм кислорода, что приводит к усилению процессов перекисного окисления липидов (ПОЛ) и развитию процессов, реализующих так называемый окислительный стресс. Однако наряду с данными о прооксидантных свойствах ПНЖК появляются сообщения и об их антиоксидантном действии [1].
Целью работы было изучение влияния липосомальной формы ПНЖК на некоторые показатели перекисного окисления липидов на модели гиперлипидемии, вызванной детергентами.
Материал и методы исследования
В работе были использованы липосомы, полученные из фосфолипидов печени байкальской нерпы с добавлением жира нерпы в концентрации 3 мг/мл по разработанному методу [2]. В качестве антиоксиданта был использован α-токоферол ацетат в концентрации 1% (по отношению к липидному компоненту), соответствующий требованиям ФС 42-2654-898.10. Жир байкальской нерпы получали согласно ТИ 9281-017-02069473-2001.
Экспериментальная работа выполнена на половозрелых крысах-самцах Вистар массой 220-280 г, полученных из питомника НИИ Биофизики Ангарской государственной технической академии. Животные находились в индивидуальных клетках. При этом все животные получали стандартный рацион питания.
Эксперименты выполнены с соблюдением всех правил и рекомендаций Европейской конвенции по защите позвоночных животных, используемых в экспериментальных работах (Страсбург, 1986).
Все животные были разделены на 3 группы: 1-я интактная группа крыс, содержащаяся на обычном режиме питания; 2-я контрольная группа, у которой была вызвана гиперлипидемия введением Твина-80; 3-я группа – опытная группа, которая в течение 14 дней получала липосомальную суспензию и Твин-80.
Гиперлипидемию у крыс вызывали по ускоренной методике внутрибрюшинным введением Твина-80 в дозе 250 мг на 100 г массы тела в 1 мл дистиллированной воды.
Степень выраженности окислительных процессов в организме экспериментальных животных определяли по содержанию малонового диальдегида (МДА) как вторичного продукта ПОЛ в сыворотке крови [3] и печени животных [4].
Определение суммарного содержания антиоксидантов (ССА) в сыворотке крови и печени экспериментальных животных проводилось на проточно-инжекционной системе «ЦветЯуза-01-АА» с амперометрическим детектированием в Биотехнологическом центре Восточно-Сибирского государственного университета технологий и управления.
Статистическую обработку результатов исследования выполняли в MS Excel 6.0 с использованием функции t-распределения Стьюдента. Полученные результаты считали достоверными при p≤0,05.
Результаты исследования
На рисунке 1 представлены данные по содержанию МДА в сыворотке крови экспериментальных животных.
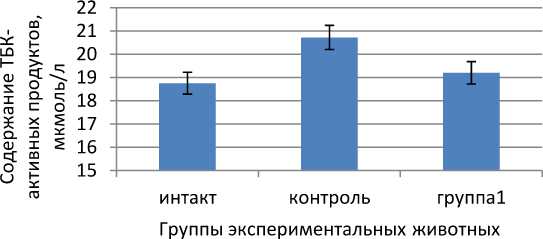
Рис. 1. Показатель уровня малонового диальдегида в сыворотке крови экспериментальных животных, получавших Твин-80 и липосомальную суспензию
Как следует из рисунка 1, введение детергента Твин-80 вызывало увеличение данного показателя по отношению к интактной группе, которое составило 10,5%, в то время как при введении липосом показатель в опытной группе животных снизился на 7,9% по отношению к контролю.
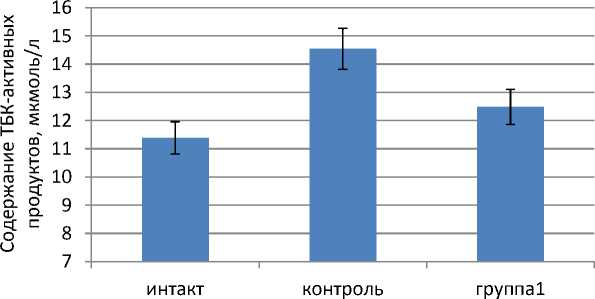
На рисунке 2 показаны изменения показателя МДА в печени экспериментальных животных.
Группы экспериментальных животных
Рис. 2. Показатель уровня малонового диальдегида в печени экспериментальных животных, получавших Твин-80 и липосомальную суспензию
Как видно из рисунка 2, при введении Твина-80 контрольной группе животных уровень содержания малонового диальдегида в печени достоверно увеличился на 38,4%. Это напрямую может быть связано с полученными нами данными по увеличению общего холестерина (ОХС) в крови. Можно полагать, что активация ПОЛ на фоне увеличения содержания ОХС связана с компенсаторной реакцией организма, направленной на сохранение исходной микровязкости мембран. Известно, что накопление ацилгидроперекисей в микросомальных мембранах гепацитов при гиперхолестеринемии сопровождается изменением активности ряда микросомальных ферментов и, в частности, ингибированием ключевого фермента катаболизма ОХС и образования желчных кислот микросомальной 7α-гидроксилазой ХС [5].
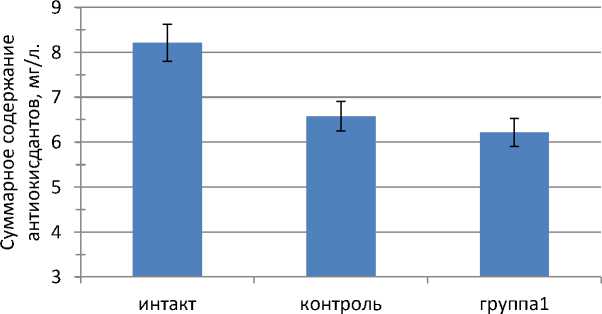
На рисунке 3 представлены данные суммарного содержания антиоксидантов в сыворотке крови экспериментальных животных.
Группы экспериментальных животных
Рис. 3. Суммарное содержание антиоксидантов в сыворотке крови экспериментальных животных
Полученные данные указывают на то, что в контрольной группе животных ССА достоверно снизилось на 24,7% по отношению к интакту. В то время как в группе животных, получавших липосомальную форму ПНЖК, суммарное содержание антиоксидантов также снизилось на 31,9%. Установлено, что снижение суммарного содержания антиоксидантов кор- релирует с уровнем малонового диальдегида в сыворотке крови экспериментальных животных. Данные результаты, по-видимому, указывают на участие липосомальной формы ПНЖК в процессах ингибирования процессов ПОЛ.
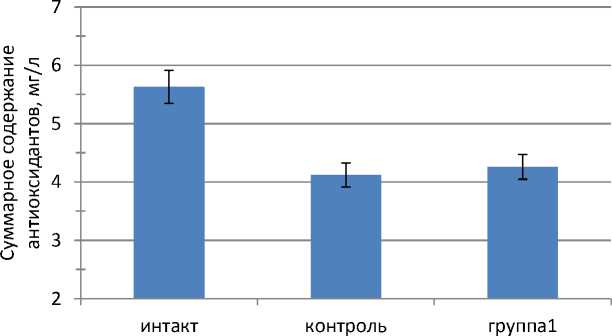
На рисунке 4 представлены данные суммарного содержания антиоксидантов в печени животных.
Группы экспериментальных животных
Рис. 4. Суммарное содержание антиоксидантов в печени экспериментальных животных
Из рисунка 4 следует, что суммарное содержание антиоксидантов в печени контрольной группы животных также снизилось на 36,6% в отличие от интактной группы животных. В 1-й группе животных ССА снизилось на 32,1% по отношению к интакту.
Развитие перекисного окисления липидов напрямую связано с содержанием антиоксидантов. Перекисное окисление липидов, развивающееся при накоплении активных форм кислорода, приводит к развитию оксидативной модификации макромолекул, которые способствуют развитию очень многих заболеваний и синдромов. Соотношение антиоксидантов и прооксидантов определяет, будет ли развиваться и прогрессировать оксидативный стресс [6]. Это соотношение участвует в регуляции многих очень важных биологических процессов.
Заключение
Поскольку первичные и вторичные продукты ПОЛ оказывают выраженное повреждающее действие, в организме существуют регуляторные механизмы, ограничивающие накопление высокотоксичных продуктов. Реакции автоокисления ПНЖК в биомембранах могут подавлять природные антиоксиданты, важнейшим из которых является а-токоферол.
Витамин Е (а-токоферол ацетат) - наиболее распространенный антиоксидант в природе - является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления.
Ведущую роль в регуляции процессов ПОЛ в организме играют «антиоксидантные» ферменты, способные утилизировать анион-радикалы кислорода (супероксиддисмутаза -СОД), Н2О2 (каталаза) и глутатионпероксидаза (ГП), глутатион-8-трансфераза.
Антиоксидантное действие ПНЖК, по мнению авторов [7], объясняется результатом как их радикалсвязывающей способности, или «экранирующим» эффектом последних, так и влиянием на активность антиоксидантных ферментов.
Таким образом, при воспроизведении дислипопротеинемии, вызванной введением индуктора, отмечалось усиление свободнорадикальных процессов, выражавшихся в повышении уровня продуктов ПОЛ и снижении суммарного содержания антиоксидантов в тканях экспериментальных крыс. Превентивное применение ПНЖК в липосомальной форме приводило к достоверному понижению уровня продуктов ПОЛ как в крови, так и в печени живот- ных, но при этом существенно не изменяло уровня ССА в анализируемых тканях гиперли-пидемированных крыс.


