Влияние лорноксикама на системную воспалительную реакцию у больных острым панкреатитом. Клиническое рандомизированное исследование
Автор: Галлямов Э.А., Агапов М.А., Малахов П.С., Какоткин В.В.
Журнал: Хирургическая практика @spractice
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Пусковым патогенетическим механизмом локальных и системных воспалительных изменений при остром панкреатите является продукция медиаторов воспаления и, в частности, цитокинов. Всё это обуславливает позиционирование системной воспалительной реакции как мишени для терапевтического воздействия.Целью исследования явилось оценить анальгетический эффект терапии лорноксикамом, а также изучить влияние препарата на системную воспалительную реакцию у больных острым панкреатитом.Материалы и методы: в рандомизированное проспективное исследование включены 334 пациента с острым панкреатитом в возрасте от 25 до 68 лет. Больные были разделены на две группы. Пациентам 1 группы (n = 246) проводилась только стандартная консервативная терапия; 88 пациентов 2 группы дополнительно получали препарат лорноксикам. Производилась оценка выраженности болевого синдрома и частоты послеоперационных осложнений.Результаты: Во второй группе больных системные осложнения развивались статистически значимо реже (р = 0,00034), летальность была также статистически значимо меньше (р = 0,006)...
Острый панкреатит, лорноксикам, обезболивание, цитокины
Короткий адрес: https://sciup.org/142224490
IDR: 142224490 | УДК: 617-089.844 | DOI: 10.17238/issn2223-2427.2019.4.32-39
Текст научной статьи Влияние лорноксикама на системную воспалительную реакцию у больных острым панкреатитом. Клиническое рандомизированное исследование
Тяжелый острый панкреатит (ТОП) остается одной из самых актуальных проблем ургентной хирургии. Проведенные эпидемиологические исследования свидетельствуют о том, что заболеваемость ОП составляет от 48 до 238 случаев на миллион населения, из них ТОП составляет 10–25 %, а общая летальность — 9–20 %. Причиной смертности в первые 6 суток являются в большинстве случаев легочные осложнения и, в частности, респираторный дистресс-синдром. Большинство летальных исходов после первой недели заболевания вызваны инфицированным панкреонекрозом и сепсисом. Таким образом, в настоящий момент отчетливо вырисовывается высокая медико-социальная значимость проблемы ОП [1]. При ОП в результате гибели большого количества собственных клеток организма происходит высвобождение значительных концентраций продуктов деградации тканей, что приводит к активации различных сигнальных путей, активации клеток иммунной системы и запуску выработки провоспалительных цитокинов [2]. В настоящее время доказана роль интерлейкинов (ИЛ): ИЛ-1, ИЛ-6, ИЛ-8, фактора некроза опухолей альфа (ФНОa), а также циклооксигеназы (ЦОГ). Последние занимают ведущее значение в патогенезе острого панкреатита [2]. Результатами их влияния является: увеличение сосудистой проницаемости, миграция лейкоцитов, локальное повреждение тканей, генерализация воспалительной реакции, повреждение почек, легких и других органов и в особо тяжелых случаях — развитие полиор-ганной недостаточности [3].
Патофизиология боли при ОП еще не до конца изучена. Тем не менее в настоящее время известен ряд основополагающих механизмов. Локальное высвобождение из поврежденных тканей медиаторов воспаления (в том числе цитокинов) стимулирует общую воспалительную реактивность [4]. Эти медиаторы непосредственно включаются в стрессовые реакции, так как, циркулируя в крови, они вызывают гормональные сдвиги в отдаленных «пусковых» органах (в том числе и в гипофизе). Эти медиаторы включаются в течение стрессовых реакций также и опосредованно, усиливая ноцицептивную афферентную трансмиссию, вызывая или потенцируя при этом высвобождение гипоталамических гормонов. То есть происходит и опосредованный запуск невральных стимулов, которые остаются ведущими в механизмах развития боли при ОП. Таким образом, природа реакций, приводящих к развитию болевого синдрома при ОП, сложна. Она включает невральные, гуморальные и воспалительные механизмы [5]. Пока еще невозможно выделить одну группу механизмов, которые бы в определенном соотношении были бы применимы к каждому из компонентов взаимосвязанного комплекса реакций [6, 7].
Учитывая вышесказанное, применение НПВС в комплексном лечении ТОП выглядит патогенетически обоснованным как с позиций контроля над выраженной воспалительной реакцией, так и с точки зрения адекватного обезболивания. Поэтому в данной работе мы проанализировали эффект терапии лорноксикамом на интенсивность болевого синдрома и уровень секреции цитокинов у больных ТОП.
Материалы и методы
В рандомизированное проспективное исследование включены 334 пациента с острым панкреатитом в возрасте от 25 до 68 лет, находившиеся на лечении с 2012 по 2018 г. в ГКБ имени И.В. Давыдовского Департамента здравоохранения г. Москвы. Мужчин было 211 (63,2 %), женщин — 123 (36,8%). Больные были разделены на две группы. Пациентам 1 группы (n = 246) проводилась только стандартная консервативная терапия ОП; 88 пациентов 2 группы дополнительно получали препарат лорноксикам. Последний вводили внутривенно капельно два раза в сутки в течение пяти суток от момента поступления.
Консервативная терапия ОП включала следующие компоненты: анальгетическую, спазмолитическую терапию, обеспечение функционального покоя поджелудочной железы путем медикаментозного подавление внешней секреции с использованием октреотида по 100–300 мкг 3 раза в сутки и ингибиторов протоновой помпы (контролок 40 мг два раза в/в), инфузионную корригирующую терапию. Всем больным проводилась комбинированная нутритивная поддержка (внутривенно и энтерально сбалансированные смеси через установленный назоинтестинальный зонд) с первых суток стационарного периода.
Интенсивность болевого синдрома в обеих группах мы оценивали каждые восемь часов с использованием визуальной аналоговой шкалы боли (ВАШ) [8], масштабируемой от нуля до десяти (где ноль означает отсутствие боли, а десять — сильную, но терпимую боль). В нашей клинике рутинное лечение болевого синдрома при ОП складывалось из нескольких ступеней. В случае неинтенсивного болевого синдрома использовали НПВС. При более выраженной боли к НПВС добавляли анальгетики из группы опиоидов. Интенсивный болевой синдром являлся показанием к постановке эпидурального катетера. В группе сравнения базовым препа- ратом из группы НПВС был кеторолак (30 мг два раза в сутки в/м).
Для определения эффективности противовоспалительного эффекта оценивали следующие показатели: частоту системных осложнений ОП, общую летальность, продукцию цитокинов: ИЛ-6, ИЛ-8, ФНОa. Содержание цитокинов определяли методом ИФА с использованием коммерческих наборов для иммуноферментного анализа (e-Biosciences). Для определения всех вышеописанных параметров забор крови производили у пациентов на 1, 3, 7 и 12-е сутки стационарного лечения.
Статистическую обработку результатов исследований производили в программном пакете StatSoft Statistica 6.0 с использованием непараметрических критериев. Для сравне- ния групп по количественным признакам использовали U-критерий Манна-Уитни и критерий Вилкоксона. Различия показателей в группах считали статистически значимым при р < 0,05.
Результаты
Системные осложнения ОП развились у 172 (51,5 %) из 334 пациентов (Таблица 1). У большинства больных в обеих группах зафиксировано сочетание нескольких системных осложнений ОП. Самым частым осложнением была недостаточность желудочно-кишечного тракта, проявляющаяся парезом кишечника. Во второй группе больных ОП системные осложнения развивались статистически значимо реже (р = 0,00034), летальность была также статистически значимо меньше (р = 0,006).
Таблица 1.
Системные осложнения у больных ОП
|
Вид осложнения панкреатогенной токсемии |
Группа 1 (n=246), n (%) |
Группа 2 (n=88), n (%) |
p |
Итого (n=334), n (%) |
|
Панкреатогенный шок |
30 (12,2) |
6 (6,8) |
0,276 |
36 (10,8) |
|
Острая сердечно-сосудистая недостаточность |
49 (19,9) |
12 (13,6) |
0,191 |
61 (18,3) |
|
Острая почечная недостаточность |
99 (40,2) |
28 (31,8) |
0,163 |
127 (38) |
|
Интоксикационные расстройства сознания |
42 (17,1) |
9 (10,2) |
0,126 |
51 (15,3) |
|
Недостаточность желудочно-кишечного тракта |
116 (47,2) |
30 (34,1) |
0,034 |
146 (43,7) |
|
Острая дыхательная недостаточность |
28 (11,4) |
9 (10,2) |
0,767 |
37 (11,1) |
|
Острая печеночная недостаточность |
61 (24,8) |
19 (21,6) |
0,546 |
80 (24) |
|
Всего |
141 (57,3) |
31 (35,2) |
0,00034 |
172 (51,5) |
|
Летальность |
47 (19,1) |
6 (6,8) |
0,006 |
53 (15,9) |
Оценка анальгетического эффекта лорноксикама
Анализ данных ВАШ показал, что в определенные временные промежутки существовала статистически значимая разница в интенсивности болевого синдрома между двумя группами пациентов. Первое измерение проводилось сразу при поступлении больного в стационар перед началом лечения. Средние значения баллов ВАШ в группах составили 6,53 (группа 1) против 7,28 (группа 2), р = 0,57. Таким образом, перед началом исследования статистически значимых различий в интенсивности болевого синдрома между группами не было. После первого введения 16 мг лорноксикама в первой группе средний бал ВАШ составил 1,8 против 3,5 во второй группе (р = 0,02).
После второго введения НПВС в первой группе бал ВАШ составил 0,53 против 1,1 (р = 0,86).
На третий день стационарного лечения средний бал ВАШ в первой группе был 1,38 против 1,86 (р = 0,69), на 7-й день — 0,2 против 2,33 (р = 0,034), на 12-й день — 1,0 против 2,8 (р = 0,053) (Рисунок 1).
Анализ синтеза цитокинов у пациентов с системными осложнениями ОП
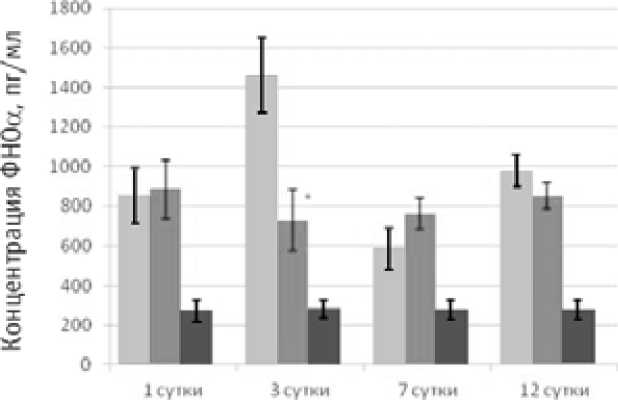
У пациентов с различными осложнениями панкреатогенной токсемии мы проанализировали секрецию ФНОa, ИЛ-6 и ИЛ-8 в динамике. У больных обеих групп в первые сутки отмечается значительное увеличение выработки про-воспалительных цитокинов ФНОa, ИЛ-6 и ИЛ-8 в перифе- рической крови по сравнению с группой здоровых доноров. У пациентов группы 1 на третьи сутки стационарного периода отмечается повышение уровня продукции ФНОa,
ИЛ-6 и ИЛ-8, тогда как у пациентов группы 2 секреция цитокинов снижается и статистически значимо отличается от уровня цитокинов у больных группы 1 (Рисунок 2–4).

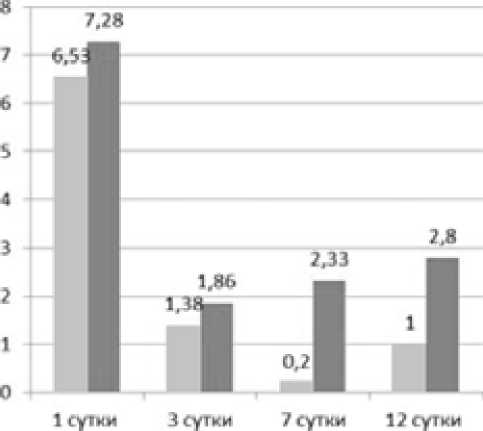
Рисунок 1. Динамика интенсивности болевого синдрома по ВАШ
больные группы 1
■ рольные группы 2
Больны? Группу 1
-
■ Больные группы 2
-
■ Здорп вые доноры
Рисунок 2. Секреция ФНОa у больных ОП.
*Статистически значимые различия значений между группами, р < 0,05
ItyiKW З-п'тня 7^утнн IltYitiH
Больные группы 1
-
■ Больные группы 2
-
■ Здоровые доноры
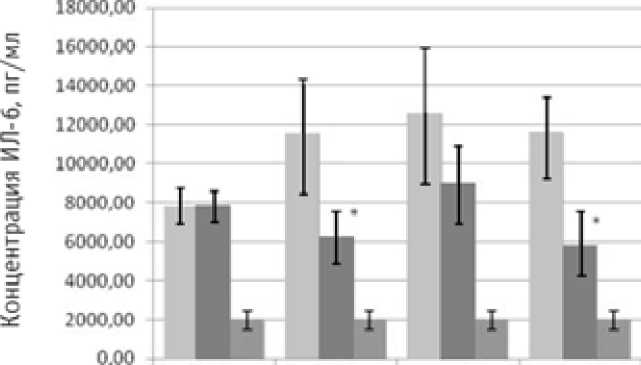
Рисунок 3. Секреция ИЛ-6 у здоровых доноров и больных с системными осложнениями ОП.
*Статистически значимые различия значений между группами больных
■ Больные группы 1■ Больные группы 2
Здоровые доноры
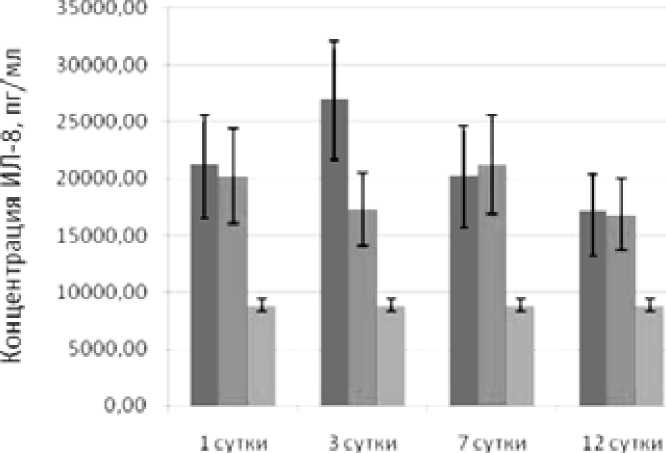
Рисунок 4. Секреция ИЛ-8 у здоровых доноров и больных с системными осложнениями ОП
В первые сутки в обеих группах уровень секреции ИЛ-8 значительно превосходит показатели, полученные в группе здоровых доноров. На третьи сутки ИЛ-8 во группе 2 снижается, в то время как в группе 1 данный показатель продолжает увеличиваться.
На 7-е сутки в группе 2 мы наблюдали некоторое повышение выработки цитокинов по сравнению с показателями в этой группе больных на третьи сутки, что может быть обусловлено прекращением проведения терапии лорноксика-мом.
Обсуждение
В нашем исследовании у больных отсутствовали осложнения, связанные с приемом лорноксикама, что говорит о безопасности препарата и выбранных режимов дозирования. Возрастание тяжести и частоты осложнений панкреатогенной токсемии происходит по мере увеличения распространенности деструктивного процесса в поджелудочной железе [9]. В свою очередь системные проявления в виде легочной, сердечно-сосудистой, почечной и печеночной недостаточности патогенетически обусловлены в основном массивным выбросом и циркуляцией медиаторов воспаления, в которых доминирующим пулом выступают провоспалительные цитокины (ИЛ-6, ИЛ-8, ФНОa) [10].
В нашем исследовании мы выявили повышенную выработку ФНОa, ИЛ-6 и ИЛ-8 у больных ОП на первой неделе заболевания. ФНОa — один из медиаторов системной прогрессии и разрушения тканей при тяжелых заболеваниях. Он участвует в индукции генов провоспалительных молекул, клеточной гибели, вовлечении и активации клеток иммунной системы. Чрезмерная продукция ФНОa приводит к развитию системного воспаления. В связи с этим ФНОa играет важную роль в развитии системных проявлений ОП и по-лиорганной дисфункции. Существуют противоречивые данные о продукции ФНОa при ОП. В работах исследователей показано, что уровень ФНОa, продуцируемый выделенными МНК больных ОП, не отличался от значений в контрольной группе и не коррелировал с тяжестью заболевания. В других исследованиях повышенные уровни ФНОa, вырабатываемые МНК больных ОП на первой неделе заболевания, коррелировали с развитием системного воспаления [11].
Известно, что у больных ОП важное прогностическое значение имеют уровни ИЛ-6 и ИЛ-8, которые коррелируют с тяжестью заболевания [12,13]. При анализе оцениваемых показателей в группе пациентов, получавших лорноксикам, выявили, что у больных этой группы происходит достоверное снижение выработки провоспалительных цитокинов на третьи сутки заболевания по сравнению с больными, находящимися на стандартной терапии. Наличие статистически значимого снижения секреции ФНОa, ИЛ-6 на третьи сутки в группе 2 может являться следствием проводимой терапии лорноксикамом. Снижение секреции ИЛ-8 в группе
-
1 на третьи сутки может являться следствием проведения терапии лорноксикамом.
Известно, что ИЛ-8 играет ключевую роль в механизмах развития повреждения тканей при гипоксии с последующей реперфузией [13]. На третьи сутки при ОП после коррекции нарушений центральной гемодинамики происходит реперфузия тканей после временной ишемии. При этом восстановление кровотока в тканях вызывает более значительные повреждения, чем это происходит в период ишемии. Механизм этого явления во многом связан с повышенной секрецией ИЛ-8. Последняя приводит к активации нейтрофильных лейкоцитов, генерации свободных радикалов кислорода и повреждению тканей. Поэтому в нашем исследовании пик продукции ИЛ-8 в группе сравнения зафиксирован на третьи сутки, т.е. повышенная экспрессия ИЛ-8 в начале заболевания может служить доказательством процессов реперфузионного повреждения тканей, усугубляющих течение ОП.
В 1986 г. ВОЗ представила пошаговую стратегию лечения боли, где вначале целесообразно использование монотерапии ПНВС, а при более выраженном болевом синдроме — комбинаций с опиоидами [14]. Ранее считалось, что использование производных морфина в лечении ОП является небезопасным из-за влияния последнего на сфинктер Одди [15]. Новейшие исследования, в том числе метаанализы, показали, что опиоидные анальгетики могут назначаться при ОП и выражение «опиоидам нет места в лечении ОП» следует считать устаревшим [16]. Тем не менее существует целый ряд неблагоприятных эффектов опиоидов (угнетение дыхания в первую очередь), что ограничивает их применение при ОП [17]. Более интенсивный болевой синдром является показанием к проведению эпидуральной анальгезии. Такой способ введения локальных анестетиков при ОП обеспечивает хорошее обезболивание, но не оказывает ингибирующего действия на стрессовые реакции, запущенные патологическим процессом, хотя в последнее время появляются данные об улучшении процессов микроциркуляции и окисгенации тканей зоны первичного повреждения [18].
Патофизиология болевого синдрома при ОП сложна, и в этом каскаде между местом повреждения и моментом восприятия боли лежит целая серия сложных электрохимических явлений, которые и рассматриваются как мишени терапевтического воздействия. Изначально воспалительный процесс в поджелудочной железе и парапанкреатической клетчатке трансформируется в виде электрической активности на окончаниях чувствительных нервов, затем по проводящим путям попадает в ЦНС. Таким образом, становятся понятны все точки приложения обезболивания при ОП. На проведение нервного импульса можно влиять при помощи эпидурального введения местных анестетиков, на процессы модуляции в ЦНС — системным введением опиоидов. Зона же первичного повреждения является точкой приложения НПВС, и в данном контексте применение последних выглядит как патогенетически обусловленное воздействие не только на болевой синдром, но и на зону первичного аффекта.
В нашем исследовании лорноксикам пациентам первой группы вводили как в качестве монотерапии (83 %), так и в комбинации с опиоидами (5,7 %) и эпидуральным обезболиванием (11,3 %). То есть лорноксикам в лечении ОП является эффективным анальгетиком как самостоятельно, так и в комбинации схем мультимодального обезболивания и обладает выраженным противовоспалительным эффектом, который, учитывая снижение концентрации цитокинов, носит системный характер.
Заключение
Боль в животе является самым ранним и ведущим симптомом у больных ОП. Существуют также веские доказательства того, что выраженность боли может являться прогностическим признаком дальнейшего клинического течения ОП. Купирование болевого синдрома при ОП по-прежнему остается сложной задачей и предполагает системное воздействие на все звенья патогенеза болевого синдрома.
В нашем исследовании применение лорноксикама на начальных этапах развития ОП снижало чрезмерную выработку провоспалительных цитокинов и риск развития ССВР, а также приводило к адекватному купированию боли. Таким образом, включение в комплекс консервативных мероприятий терапии лорноксикамом у больных ОП позволило добиться снижения не только интенсивности болевого синдрома, но и частоты развития осложнений панкреатогенной токсемии и уменьшить летальность у данной категории пациентов.
Список литературы Влияние лорноксикама на системную воспалительную реакцию у больных острым панкреатитом. Клиническое рандомизированное исследование
- Cartmell M.T., Kingsnorth A.N. Acute pancreatitis. Hosp Med. 2000 Jun; 61(6):382-5. [] DOI: 10.12968/hosp.2000.61.6.1350
- Guillaumes S., Blanco I., Villanueva A., Sans M.D., Clave P., Chabes A. et al. Chloroquine stabilizes pancreatic lysosomes and improves survival of mice with diet-induced acute pancreatitis.Pancreas. Pancreas. 1997 Apr; 14(3):262-6. [] DOI: 10.1097/00006676-199704000-00007
- Sawa H., Ueda T., Takeyama Y., Yasuda T., Shinzeki M., Nakajima T. et al. Role of Toll-like receptor 4 in the pathophysiology of severe acute pancreatitis in mice. Surg Today. 2007; 37(10):867-73. [10.1007/ s00595-007-3520-x] DOI: 10.1007/s00595-007-3520-x
- Carr D.B., Ballantyne J.C., Osgood P.F., Kemp J.W., Szyfelbein S.K. Pituitary-adrenal stress response in the absence of brain-pituitary connections. Anesth Analg. 1989 Aug; 69(2):197-201
- Hurgreaves K.M., Dionne R.A. Evaluating endogenous mediators of pain and analgesia in clinical studies, p. 579. In: Max MB, Portenoy RK, Laska EM (cds): The Design of Analgesic Clinical Trials. Advances in Pain Research and Therapy. Vol. 18. Raven Press, New York, 1991
- Factors determining the pattern of stress responses, p.17. In Usdin E., Kvetnansky R., Axelrod J. (eds): Stress. The Role of Catecholamines and Other Neurotransmitters. Gordon and Breach Science Publishers, New York, 1983
- Smelik P.G. Summary of panel discussions on stress, p. 69. In Usdin E., Kvetnansky R., Axelrod J. (eds): Stress. The Role of Catecholamines and Other Neurotransmitters. Gordon and Breach Science Publishers, New York, 1983
- Williamson A., Hoggart B. Pain: a review of three commonly used pain rating scales. J Clin Nurs. 2005 Aug; 14(7):798-804. [https://doi. org/.x]
- DOI: 10.1111/j.1365-2702.2005.01121
- Cruz-Santamaria D.M., Taxonera C., Giner M. Update on pathogenesis and clinical management of acute pancreatitis. World J Gastrointest Pathophysiol. 2012 Jun 15; 3(3):60-70. [10.4291/wjgp. v3.i3.60.]
- DOI: 10.4291/wjgp.v3.i3.60
- Kylanpaa M.L., Repo H., Puolakkainen P.A. Inflammation and immunosuppression in severe acute pancreatitis. World J Gastroenterol. 2010 Jun 21; 16(23):2867-72. []
- DOI: 10.3748/wjg.v16.i23.2867
- Malleo G., Mazzon E., Siriwardena A.K., Cuzzocrea S. Role of tumor necrosis factor alpha in acute pancreatitis: from biological basis to clinical evidence. Shock. 2007 Aug; 28(2):130-40. [10.1097/ shk.0b013e3180487ba1]
- DOI: 10.1097/shk.0b013e3180487ba1
- Inagaki T., Hoshino M., Hayakawa T., Ohara H., Yamada T., Yamada H. et al. Interleukin-6 is a useful marker for early prediction of the severity of acute pancreatitis. Pancreas. 1997 Jan; 14(1):1-8. [https://doi. org/]
- DOI: 10.1097/00006676-199701000-00001
- Novovic S., Andersen A.M., Ersboll A.K., Nielsen O.H., Jorgensen L.N., Hansen M.B. Proinflammatory cytokines in alcohol or gallstone induced acute pancreatitis. A prospective study. JOP. 20.09 May 18; 10(3):256-62.
- Helm J.F., Venu R.P., Geenen J.E., Hogan W.J., Dodds W.J., Toouli J et al. Effects of morphine on the human sphincter of Oddi. Gut. 1988 Oct; 29(10):1402-7. []
- DOI: 10.1136/gut.29.10.1402
- Jakobs R., Adamek M.U., von Bubnoff A.C., Riemann J.F. Buprenorphine or procaine for pain relief in acute pancreatitis. A prospective randomized study. Scand J Gastroenterol. 2000 Dec; 35(12):1319-23. [https:// ]
- DOI: 10.1080/003655200453692
- Mitchell R.W.D., Smith G. The control of acute postoperatice. Br J Anaesth. 1989 Aug; 63(2):147-58. []
- DOI: 10.1093/bja/63.2.147
- Bachmann K.A., Trepte C.J., Tomkotter L., Hinsch A., Stork J., Bergmann W. et al. Effects of thoracic epidural anesthesia on survival and microcirculation in severe acute pancreatitis: a randomized experimental trial. Crit Care. 2013 Dec 5; 17(6):R281.. [10.1186/ cc13142]
- DOI: 10.1186/cc13142
- Organization W.H. Traitement de la douleur cancereuse. Geneva, Switz: World Health Organization, 1987


