Влияние меди на образование биопленок у штаммов рода Enterococcus, выделенных из водной экосистемы с антропогенной нагрузкой
Автор: Ускова С.С., Мартынова А.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
Для выживания в неблагоприятных условиях внешней среды бактерии рода Enterococcus инициируют различные оборонительные стратегии. Например, они способны переходить в некультивируемое, но жизнеспособное состояние (VBNC – viable but noncultivable) или образовывать биопленки. Биопленка представляет собой пористую и сложную структуру, образованную микроорганизмами одного или нескольких видов, организованную в несколько слоев клеток, необратимо прикрепленных к биотической или абиотической поверхностям и заключенную в матрицу, состоящую из внеклеточных полимерных веществ. Цель настоящего исследования − изучить влияние меди на образование биопленок представителями рода Enterococcus, выделенных в период с 10 марта 2018 г. по 24 сентября 2020 г. из водной экосистемы с антропогенной нагрузкой. В результате исследования процесса формирования биопленок установлено изменение морфологии биопленок в зависимости от присутствия меди, концентрации и конкретного вида энтерококков.
Медь, биопленки, Enterococcus, E. faecalis, E. faecium
Короткий адрес: https://sciup.org/147250954
IDR: 147250954 | УДК: 579.86 | DOI: 10.17072/1994-9952-2025-2-196-203
Текст научной статьи Влияние меди на образование биопленок у штаммов рода Enterococcus, выделенных из водной экосистемы с антропогенной нагрузкой
В настоящее время существует серьезная проблема, связанная с устойчивостью энтерококков к клинически важным антибиотикам, в частности к аминогликозидам, гликопептидам, включая ванкомицин, и хинолонам [Tacconelli, Cataldo, 2008]. Энтерококки склонны к генетическому обмену через транспозоны и плазмиды, что привело к распространению генов устойчивости к антибиотикам [Witte, 2004]. Кроме того, в недавнем отчете [Warnes et al., 2010] подчеркивается разрыв между разработкой новых антибиотиков и растущим числом инфекций, вызываемых множественными устойчивыми к антибиотикам микроорганизмами.
Энтерококки являются кишечными комменсалами и могут выдерживать высокие концентрации соли и значения рН, типичные для кишечника человека. Известно, что они могут выживать в окружающей среде в течение длительного времени. Они также могут выживать на мягких поверхностях, включая больничные постельные принадлежности и пластмассы [Neely, Maley, 2000], обивку мебели, напольные и настенные покрытия, и могут быть устойчивыми к воздействию широко применяемых чистящих средств, включая гипохлорит натрия [Warnes et al., 2010].
Присутствие неподвижных микроорганизмов на абиотических поверхностях может вызвать серьезные проблемы, приводящие к значительным затратам и негативным последствиям в различных областях, таких как здравоохранение и лечебные учреждения, системы водного транспорта, судоходство и морская промышленность, а также теплообменники и системы охлаждения [Gomes, Simoes, Simoes, 2020].
Биопленка представляет собой многоклеточную структуру, образованную микроорганизмами. Помимо микробных клеток, в ее состав входят вода и внеклеточное полимерное вещество, известное как экзо-полисахаридный матрикс. Это вещество состоит из полисахаридов, белков, нуклеиновых кислот и поверхностно-активных веществ [Liu et al., 2019]. Биопленка служит защитой от повреждений, особенно при воздействии неблагоприятных факторов окружающей среды. Она позволяет микроорганизмам прочно прикрепляться как к биотическим, так и к абиотическим поверхностям [Lange et al., 2021]. Экзополи-сахаридный матрикс может быть непроницаемым для противомикробных препаратов, что затрудняет проникновение последних в биопленку [Mah, O’Toole, 2001].
«Чувство кворума» является основным средством коммуникации в бактериальных скоплениях. Каждая клетка вырабатывает химические соединения, такие как бактериоцины, и экспрессирует определенные гены. Это явление считается механизмом устойчивости. Чем выше плотность популяции микроорганизмов, тем больше выделяется самоиндуцирующих соединений. Происходят изменения в экспрессии генов, и в итоге меняется вся популяция [Liu et al., 2019]. Преобладание устойчивых к лекарствам бактерий в биопленках является одной из причин, по которой бактериальные инфекции трудно поддаются лечению. Лекарства также могут быть неэффективны против бактерий, находящихся в биопленке [Lange et al., 2021].
Для борьбы с образованием биопленки могут быть использованы различные подходы, зависящие от условий окружающей среды и области применения [Gomes, Simoes, Simoes, 2020]. Наиболее распространенные методы борьбы с биопленками включают использование противомикробных средств, таких как дезинфицирующие средства и биоциды для обработки поверхности, или антибиотиков для борьбы с биопленками, связанными со здоровьем человека. Однако использование химических веществ часто неэффективно и способствует развитию резистентности бактерий. Для удаления биопленок с различных поверхностей могут использоваться механические методы, которые основаны на воздействии механической нагрузки, способной преодолеть силы, удерживающие биопленку на поверхности тела. Это приводит к ее отсоединению [Boudarel et al., 2018].
Механические методы используются в различных областях медицины. Например, для контроля зубных биопленок используют зубную щетку или нагнетают жидкость высокоскоростными струями воды. В медицинских приборах используется водяная щетка под давлением, а в системах распределения питьевой воды используется промывка труб. Для контроля биопленок на поверхностях, контактирующих с пищевыми продуктами, в основном используется ультразвук в сочетании с химическими методами [Yu et al., 2020]. Ультразвук способствует физическому разрушению биопленок, создавая лучшие условия для антимикробного действия химических веществ. Использование поверхностных материалов с антимикробными и антиадгезивными свойствами является важной стратегией развития. Они широко изучаются в качестве профилактической меры и альтернативы традиционным протоколам дезинфекции или антибактериальной терапии. Антимикробные поверхности можно разделить на те, которые используются для предотвращения адгезии и не влияют на жизнедеятельность микроорганизмов, и те, которые препятствуют их адгезии [Boudarel et al., 2018].
Медь – это микроэлемент, необходимый для нормального функционирования метаболизма большинства прокариотических и эукариотических организмов. В природе медь может находиться в окисленном (Cu+2) или восстановленном (Cu+1) состоянии. Она может действовать как донор или акцептор электронов при восстановлении или окислении различных субстратов [Latorre et al., 2011]. Благодаря таким свойствам этот переходный элемент оказывается необходимым для нормального протекания ряда биохимических процессов. С другой стороны, избыток меди может вызывать образование свободных радикалов в результате реакций Габера — Вейса и Фентона, которые способны повреждать клеточные мембраны, белки и ДНК. Такая двойственная природа меди объясняет необходимость в специальных системах регуляции, которые поддерживают клеточный гомеостаз этого металла [Gomes, Simoes, Simoes, 2020].
Поступление, перемещение внутри клетки, хранение и выведение — вот четыре основных этапа, необходимых для работы с этим металлом в клеточной среде. У бактерий одна из наиболее изученных систем, контролирующих содержание меди, кодируется опероном cop . Этот оперон кодирует белки, которые могут контролировать внутриклеточное перемещение меди, регулировать поглощение и выведение металла, а также экспрессию самого оперона [Li et al., 2010]. Другой группой белков, которая также играет важную роль в поддержании уровня меди в клетке, является семейство cut . Одним из наиболее изученных представителей этого семейства является белок CutC. Хотя его роль в гомеостазе меди до конца не изучена, появляется все больше свидетельств того, что этот ген может экспрессироваться по-разному в ответ на воздействие меди, поскольку он может быть прямо или косвенно вовлечен в защиту от избытка этого металла [Latorre et al., 2011].
Существует несколько механизмов, приводящих к гибели бактерий при контакте с медью, они могут различаться в зависимости от вида микроорганизма и условий окружающей среды. Например, планктонные клетки, прикрепленные к поверхности или образующие биопленки, могут по-разному реагировать на взаимодействие с медью. При взаимодействии меди с микроорганизмами могут происходить различные процессы, такие как повреждение клеточной стенки, окислительное повреждение, вызванное образованием активных форм кислорода, ингибирование ферментов и деградация нуклеиновых кислот. Эти процессы могут привести к повреждению клеток и снижению клеточной активности [Hans et al., 2016]. Цель: изучить влияния меди на образование биопленок у штаммов рода Enterococcus, выделенных из водной экосистемы с антропогенной нагрузкой.
Материалы и методы исследования
Для исследования чувствительности штаммов рода Enterococcus к тяжелым металлам было изучено 18 образцов воды из устья р. Вторая Речка (43°16'045" с. ш., 131°54'05" в. д.), т. к. река находится в черте города и подвержена загрязнению тяжелыми металлами [Шулькин, Богданова, Киселев, 2007].
Было выделено 30 штаммов бактерий рода Enterococcus , идентификация которых проводилась методом полимеразной цепной реакции. Штаммы идентифицировали с помощью ПЦР с использованием известных праймеров гена 16S РНК: 5'-AACGCGAAGAACCTTAC-3' и 5'-CGGTGTGTACAAGACCC-3'. Размер амплифицированного фрагмента составил 440 п. о. [Skowron et al., 2016]. Синтез праймеров был осуществлен компанией «Синтол» (Москва, Россия).
Изучение устойчивости бактерий рода Enterococcus к меди проводилось на питательной среде для морских микроорганизмов (СММ), содержащей: CaCO₃ – 1.0 г/л, MgSO₄ – 1.0 г/л, пептон – 5.0 г/л, дрожжевой экстракт – 5.0 г/л, K₂HPO₄ – 0.2 г/л, глюкозу – 0.2 г/л, агар – 15.0 г/л и дистиллированную воду – 1 000 мл. В качестве селективной добавки добавляли соли меди CuSO₄ в возрастающих концентрациях. Автоклавирование проводили при 121°C в течение 15 мин. Суточную культуру бактерий засевали на чашки Петри с питательной средой СММ. Посев проводили в трех повторах. Культуру выращивали при комнатной температуре в течение 2–3 суток. Результаты учитывали по наличию или отсутствию роста на чашках с металлами [Бузолева, 2011].
Исследование устойчивости биопленок к меди проводился на жидкой питательной среде ГРМ (ФБУН ГНЦ ПМБ, Оболенск, Россия) с добавлением возрастающей концентрации соли меди CuSO₄. Из суточной культуры бактерий делали суспензию мутностью 0.5 по стандарту МакФарланда и засевали по 50 мкл в одноразовую чашку Петри с жидкой питательной средой ГРМ. Посев проводили в трех повторах. Культуру выращивали при температуре 37ºС в течение 2–3 суток. Результаты учитывали по наличию или отсутствию роста на чашках с металлами после окрашивания 1% раствором генциан фиолетовым [Мар-данова и др., 2016].
Морфологию бактериальных клеток оценивали методом окраски по Граму [Прунтова, 2005]. Биопленки окрашивали 1% раствором генциан фиолетовым [Марданова и др., 2016]. Исследование проводили с помощью микроскопа марки Primo Start производства Zeiss. Отмечали окраску мазка, а также размер, форму и способ расположения бактерий на предметном стекле.
Статистическая обработка данных проводилась в программе STATISTICA 10. Графики и таблицы формировались в программе Excel.
Результаты и обсуждение
При исследовании чувствительности бактерий рода Enterococcus , выделенных из р. Вторая Речка, было выявлено, что все изученные штаммы способны к росту при концентрациях меди, превышающих предельно допустимые значения (ПДК). ПДК для меди в морской воде составляет 0.05 мг/л, а в пресной — 0.01 мг/л [Коршенко, 2020].
При концентрации меди в среде 1 450 мг/л рост 43% (13) штаммов Enterococcus spp. значительно снижался, что позволяет классифицировать эти штаммы как чувствительные. Однако 17% (5) штаммов демонстрировали рост при концентрации 1 500 мг/л. Концентрация 1 550 мг/л являлась минимально ингибирующей концентрацией (рис. 1). Также были зафиксированы изменения в культуральных свойствах бактерий. При увеличении концентрации меди в среде культивирования бактерий до 1 400 мг/л формировались непрозрачные колонии оранжевого цвета с металлическим блеском. В то же время другие колонии становились прозрачными. Кроме того, наблюдались изменения в морфологии бактериальных клеток . При концентрации 800 мг/л клетки располагались парами. При концентрации 1 400 мг/л клетки также располагались парами, при этом размер клеток незначительно увеличивался. При концентрации 1 500 мг/л клетки располагались парами и короткими цепочками, а также становились более круглыми по сравнению с клетками, выращенными в присутствии более низких концентраций меди в среде [Ускова, Мартынова, 2024].
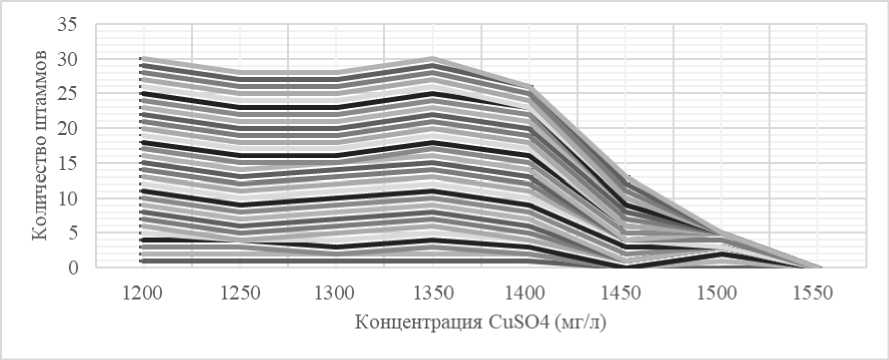
Рис. 1. . Влияние различных концентраций меди на рост бактерий Enterococcus [Ускова, Мартынова, 2024]
[Effect of different copper concentrations on the growth of Enterococcus bacteria [Ускова, Мартынова, 2024] ]
Биопленки, образованные представителями E. faecalis , состоят из плотных скоплений овальных кокков, объединенных внеклеточным матриксом. С увеличением концентрации меди до 800 мг/л клетки образуют менее плотные скопления, размер бактериальных клеток уменьшается. При концентрации 1 500 мг/л клетки также образуют менее плотные скопления, но появляются клетки разных размеров (рис. 2).
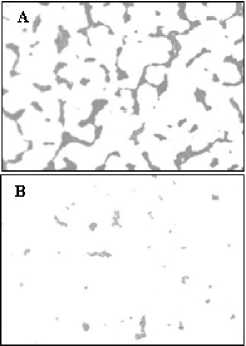
Рис. 2. Влияние различных концентраций меди на формирование биопленки E. faecalis (микроскоп Primo Start, 100x).
Концентрация CuSO 4 : А – контроль (среда ГРМ без добавления солей металлов), Б - 800 мг/л, В – 1 500 мг/л
[Effect of various copper concentrations on the formation of biofilm of E. faecalis (Primo Start microscope, 100x).
CuSO 4 concentration: A – control (timing medium without addition of metal salts),
B - 800 mg/l, C – 1 500 mg/L]
Биопленки штаммов E. faecium 1 состоят из плотных скоплений овальных кокков, объединенных внеклеточным матриксом. С увеличением концентрации меди до 800 мг/л значительные изменения не наблюдаются. При концентрации 1 500 мг/л клетки образуют менее плотные скопления, размер клеток увеличивается (рис. 3).
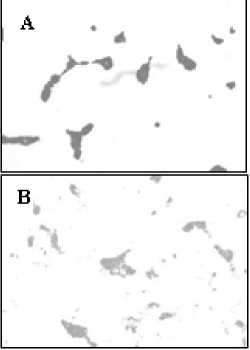

Рис. 3. Влияние различных концентраций меди на формирование биопленок штамма E. faecium 1 (микроскоп Primo Start, 100x). Концентрация CuSO 4 : А – контроль (среда ГРМ без добавления солей металлов), Б - 800 мг/л, В – 1 500 мг/л
[Effect of various copper concentrations on the formation of biofilms of E. faecium 1 strain (Primo Start microscope, 100x).
CuSO 4 concentration: A – control (timing medium without addition of metal salts), B -800 mg/l, C – 1 500 mg/L]
Биопленки штаммов E. faecium 2 состоят из плотных скоплений овальных кокков, объединенных внеклеточным матриксом. С увеличением концентрации меди до 800 мг/л образуются ромбовидные образования, в которых клетки расположены от одного края до противоположного. При концентрации 1 500 мг/л ромбовидные образования уменьшаются, а вокруг них образуется рыхлая биопленка, состоящая из небольших круглых кокков (рис. 4).
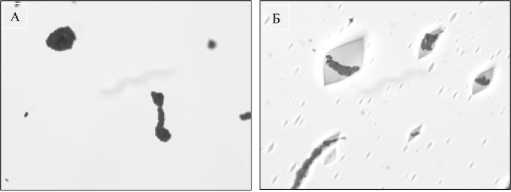
Рис. 4. Влияние различных концентраций меди на формирование биопленки штамма E. faecium 2 (микроскоп Primo Start, 100x). Концентрация CuSO 4 : А – контроль (среда ГРМ без добавления солей металлов), Б - 800 мг/л, В – 1 500 мг/л
[Effect of various copper concentrations on the formation of biofilms of E. faecium 2 strain (Primo Start microscope, 100x).
CuSO 4 concentration: A – control (timing medium without addition of metal salts), B - 800 mg/l, C – 1 500 mg/L]

Образование таких структур может быть связано с тем, что соли меди оказывают сильное окислительное воздействие на микроорганизмы. Это воздействие часто приводит к повреждению клеточных мембран, белков и ДНК. В ответ на это бактерии пытаются адаптироваться, что приводит к образованию биопленок. Внеклеточный матрикс биопленки может связывать ионы меди, снижая их концентрацию в окружающей среде. Внутри биопленки могут образовываться локальные области с разной концентрацией меди. Некоторые микроорганизмы способны выделять вещества, которые нейтрализуют токсичное действие меди.
Взаимодействие меди с биопленками отличается от взаимодействия с планктонными клетками. Процесс формирования биопленки включает в себя несколько этапов: первоначальное обратимое и необратимое прикрепление, созревание и дисперсию. Последний этап имеет решающее значение для закрепления биопленки в новых местах за счет отделения планктонных форм, которые инициируют формирование новых биопленок в других местах [Rabin et al., 2015].
Структура биопленки всегда одинакова, независимо от ее формы. Внутри бактериального сообщества находятся мелкие клетки с ограниченным потенциалом размножения, в то время как внешние области заняты метаболически активными клетками. Это связано с недостатком кислорода и питательных веществ в центре структуры биопленки [Lange et al., 2021]. Бактериальная неоднородность может способствовать развитию различных устойчивых свойств, которые могут распространяться на все бактериальное сообщество [Mah, O’Toole, 2001]. Бактерии, не обладающие устойчивостью, становятся менее чувствительными к про-тивомикробным препаратам при выращивании в структуре биопленки [Stewart, 2002].
В биопленках микроорганизмы защищены матрицей из экзополисахаридов. Следовательно, действие меди направлено не только на взаимодействие с микроорганизмами, но и нарушение структуры экзопо-лисахаридов. Однако влияние меди на образование экзополисахаридов изучено недостаточно [Lin et al., 2020]. Показано, что ионы меди в биопленках Pseudomonas aeruginosa в основном находятся в матрице экзополисахаридов, и лишь небольшая часть обнаруживается внутри клеток или в клеточной мембране и/или клеточной стенке [Gomes, Simoes, Simoes, 2020].
Однако механизмы действия меди могут варьироваться в зависимости от условий окружающей среды, таких как присутствие воды, температура, рН, присутствие других металлов или ионов, степень окисления, шероховатость поверхности и присутствие микроорганизмов на поверхности металла. Антимикробные свойства меди обычно связаны с высвобождением ионов меди, которые могут повреждать микробные клетки из-за изменения структуры и активности белков и ферментов.
Образование биопленки является эффективной стратегией для выживания и сохранения микробов в условиях стресса, например, в присутствии противомикробных препаратов и тяжелых металлов. Структура биопленки может быть связана с защитным механизмом, который позволяет бактериям выживать и сохраняться в средах с высокой концентрацией металлов [Muller, Medigue, Koechler, 2007]. Исследования показали, что субингибиторные концентрации тяжелых металлов могут вызывать образование биопленки [Kaplan et al., 2012], что изучалось на примере кадмия [Wu, Santos, Fink-Gremmels, 2015] и других металлов.
Заключение
Изучение влияния солей меди (CuSO 4 ) на штаммы бактерий рода Enterococcus , выделенных из водной экосистемы с антропогенной нагрузкой, показало, что концентрация меди 1 550 мг/л являлась минимально ингибирующей. С увеличением концентрации CuSO 4 изменялись морфология бактериальных клеток, культуральные свойства и форма биопленок. При концентрации CuSO 4 1 400 мг/л колонии приобретали оранжевый цвет и становились непрозрачными, а при 800 мг/л CuSO 4 клетки располагались попарно. При концентрациях CuSO 4 1 400 и 1 500 мг/л размер клеток увеличивался, клетки формировали пары и цепочки. Биопленки E. faecalis при 800 мг/л становились менее плотными, а при 1 500 мг/л в них появлялись клетки различных размеров. Биопленки E. faecium 1 в присутствии 1 500 мг/л CuSO 4 увеличивались в размере. У E. faecium 2 при 800 мг/л образовывались ромбовидные структуры, которые при концентрации CuSO 4 1 500 мг/л уменьшались, а вокруг формировалась рыхлая биопленка.


