Влияние мелатонина на динамику некоторых морфофункциональных параметров опухолевого роста в условиях экспериментального канцерогенеза
Автор: Плотникова Н.А.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Проблемы экспериментальной и клинической онкологии
Статья в выпуске: 2, 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14718731
IDR: 14718731
Текст статьи Влияние мелатонина на динамику некоторых морфофункциональных параметров опухолевого роста в условиях экспериментального канцерогенеза
В последнее время отмечается значительный рост онкологической заболеваемости, что определяется различными факторами и во многом связано с естественным старением населения. В связи с этим проблема комплексного изучения процессов канцерогенеза представляет несомненный научный интерес. Возникает необходимость возможной фармакологической коррекции и профилактики процессов опухолевого роста.
Одним из направлений является изучение дозозависимого эффекта действия онкопротек-теров на процессы канцерогенеза и определение оптимальных терапевтических доз применяемых антиоксидантов. Необходимо было изучить влияние разных доз мелатонина на некоторые морфологические и биохимические параметры экспериментального канцерогенеза мягких тканей у мышей.
Для этого требовалось: 1) изучить влияние Мелатонина на частоту, множественность и размеры опухолей подкожной клетчатки, индуцированных бенз[а]пиреном у мышей; 2) исследовать динамику содержания малонового диальдегида и активность каталазы в сыворотке крови и опухолевой ткани у мышей в условиях индуцированного канцерогенеза; 3) изучить влияние мелатонина на динамику патоморфологических изменений в опухолевой ткани; 4) исследовать латентный Период опухолей, продолжительность жизни животных и выживаемость опухоленосителей при коррекции мелатонином; 5) изучить дозовую зависимость действия мелатонина на морфологические и биохимические показатели канцерогенеза мягких тканей у мышей-
Опыт был поставлен на 140 самках аут-бредных белых мышей SHR/u массой 20 — 22 г в возрасте 3 мес. Животные содержались в стандартных условиях содержания ви вария:! в металлических клетках (60x40x30 см), по 20 мышей в каждой клетке, при температуре 22 ± 2 6С при стандартном режиме освещения (12 часов свет, 12 часов темнота). Животные получали гранулированный корм и водопроводную воду без ограничений. В возрасте 3 мес. мыши были рандомизи-рованно поделены на 3 группы по 40 мышей в каждой. Оставшиеся 20 мышей служили интактным контролем. Животным 1-й, 2-й и 3-Й групп однократно подкожно был введен канцероген — бенз[а]пирен в дозе 2 мг/мышь. Со следующего после введения канцерогена дня животные 2-й и 3-й групп получали с питьевой водой в ночные часы (с 1900 до 07м) мелатонин (Sigma, St. Louis; MS, США) в дозах 20 мг/л и 2 мг/л соответственно. Животные 1-й группы составили контрольную группу (канцерогенез без коррекции). Экспозиция составила 7 мес. После окончания эксперимента животные забивались декапитацией. Для каждой группы определяли частоту и множественность опухолей, латентный период развития опухолей, продолжительность жизни животных и выживаемость опухоленосителей. Кусочки опухолевой ткани после обычной гистологической обработки заливали в парафин. Тонкие гистологические срезы 5—7 мкм были окрашены гематоксилином и эозином и затем тщательно изучены микроскопически. Опухоли классифицировали согласно рекомендациям МАИР. Микропрепараты легких фотографировали цифровой камерой Nikon Coolpix 4500 с помощью микроскопа Микмед-2 при увеличении в 80 и в 400 раз. Полученные микрофотографии обрабатывали с помощью пакета программ Adobe Photoshop 7.0. Для биохимических исследований собиралась кровь, свободно вытекающая после декапитации и ткань опухолей подкож
ной клетчатки. В сыворотке крови и гомогенатах ткани опухолей определяли уровень малонового диальдегида (МДА) и активность каталазы. Полученные результаты обрабатывали статистически с использованием /-критерия Стьюдента, точного метода Фишера и X2 с помощью пакета прикладных программ «МедСта-тистика» и «Биостат».
Нами были получены следующие результаты: по истечении 7 мес. у мышей контрольной группы опухоли возникали с частотой 73 % (24 из 33 животных). Начиная с 126-х суток у животных данной группы на спинке в области введения канцерогена возникало опухолевидное образование округлой формы плотной консистенции с неровной поверхностью. По мере увеличения размеров опухолевые узлы теряли подвижность, врастая в подлежащие ткани. Кожа над опухолью во всех случаях была изъязвлена, волосяной покров отсутствовал (рис. 1). Среди опухолей, возникающих после короткого латентного периода (126 — 140 суток), преобладали опухоли большого размера.
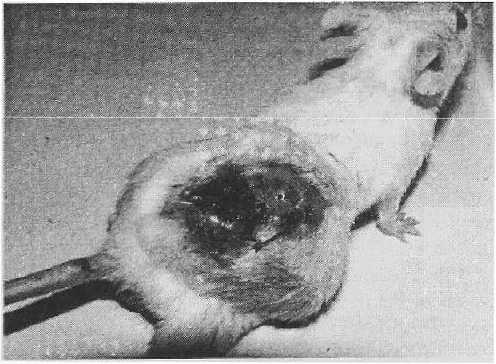
Рисунок 1
Саркома подкожной клетчатки поясничной области. Опухолевый узел больших размеров с изъязвлением
При исследовании post mortem мы наблюдали опухоли, не имевшие четких границ, туго-повижные, плотно спаянные с окружающими тканями. На разрезе — опухолевая ткань беловато-серого цвета, имевшая вид «рыбьего мяса», резавшаяся с хрустом, с очагами некрозов и кровоизлияний. При вскрытии в большинстве случаев выявлено распространение опухоли per continuitatem на подлежащие ткани и органы: мышцы спины, паранефраль-ную клетчатку, правую или левую почку.
При введении мелатонина в дозе 20 мг/л число животных с опухолями составило 35 % (14 мышей из 40), что на 38 % меньше по сравнению с контролем (р < 0,05). При введении мелатонина в дозе 2 мг/л частота развития опухолей уменьшилась на 46,7 % по сравнению с контролем и составила 26,3 % (12 животных из 38) (р < 0,001).
Макроскопически в группе животных, получавших мелатонин в дозе 20 мг/л, лишь в одном случае отмечалось изъязвление над поверхностью опухоли. В остальных случаях, а также в группе, получавшей мелатонин в дозе 2 мг/л, нарушения целостности кожных покровов не развивались, волосяной покров оставался сохранным (рис. 2). В опытных группах в половине случаев опухолевые узлы были окружены капсулой и имели эндофитную форму роста.
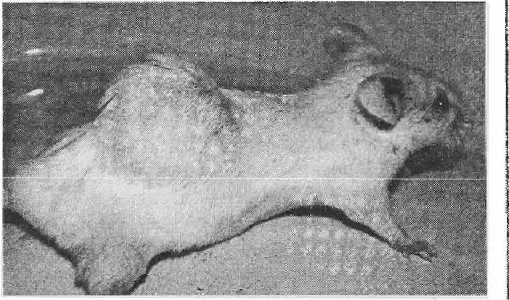
Рисунок 2
Саркома подкожной клетчатки поясничной области. Опухоль большого размера.
Кожные покровы над опухолью не изменены
В контрольной группе у 6,1 % животных (2 мыши из 24) выявлены метастазы опухоли в печень (в правую долю печени). Наблюдались метастатические опухолевые узлы размером 5 — 6 мм, округлой формы, плотной консистенции, четко отграниченные от паренхимы печени. В обеих опытных группах, получавших мелатонин, признаков метастатического поражения внутренних органов обнаружено не было.
Размеры опухолевых узлов под влиянием мелатонина существенно не изменялись. Так, в группе контроля средний размер опухолей составил 29,1 ± 1,28 мм (минимальный размер — 15 мм, максимальный — 37 мм). Аналогичные показатели в группах, получавших мелатонин в дозах 20 и 2 мг/л, соответственно составили 28,8 ± 1,27 мм (минимальный размер — 15 мм, максимальный — 33 мм) и 29,2 ± 0,75 мм (минимальный размер — 25 мм, максимальный — 33 мм) (р > 0,05).
Средняя длительность латентного периода опухолей в группе контроля составила 152 ± ± 13 суток. Первые опухоли появились через 126 суток после введения канцерогена. Максимальный латентный период составил 168 суток.
При введении мелатонина нами было отмечено увеличение латентного периода развития опухолей. Так, у мышей, получавших мелатонин в дозе 20 мг/л, средний латентный период развития опухолей составил 160 ± 6,3 суток, что на 5,3 % (8 суток) больше, чем в группе контроля. Минимальный латентный период составил 147 суток, максимальный — 168 суток. Различие значений среднего латентного периода в данной группе и в группе контроля недостоверно (р = 0,3271, тест Колмогорова — Смирнова).
В группе мышей, получавших, мелатонин в дозе 2 мг/л, средняя длительность латентного периода составила 165 ± 3,6 суток, что на 8,6 % (13,3 суток) больше, чем в группе контроля. Минимальный латентный период составил 161 сутки, максимальный — 168 суток. Различие значений среднего латентного периода в данной группе и в группе контроля статисти чески достоверно (р = 0,0046, тест Колмогорова — Смирнова). Различие данного показателя между группами, получавшими мелатонин в дозах 20 мг/л и 2 мг/л, недостоверно (р = 0,2718, тест Колмогорова — Смирнова). Влияние мелатонина на значение латентного периода развития опухолей представлено на рис, 3, 4.
Средняя продолжительность жизни мышей в группе контроля составила 165 ± 14,4 суток (минимальная — 133 суток, максимальная — 182 суток). После введения бензапирена под влиянием мелатонина значительно увеличивалась средняя, минимальная и максимальная продолжительность жизни мышей. При введении мелатонина в дозе 20 мг/л средняя продолжительность жизни мышей составила 175 ± 8,7 суток, что на 6,5 % (10,5 суток) больше, чем в группе контроля. Минимальная продолжительность жизни составила 161 сутки, максимальная — 189 суток. Различие средней продолжительности жизни в группе контроля и в группе, получавшей мелатонин в дозе 20 мг/л, несущественно (р — 0,2262, тест Колмогорова —-Смирнова).
В группе мышей, получавших мелатонин в дозе 2 мг/л, средняя продолжительность жизни увеличилась на 12,6 % (21 сутки) и составила 185 ± 6,4 суток (минимальная — 175 суток, максимальная — 192,5 суток). Различие средней продолжительности жизни в группе контроля и в группе, получавшей мелатонин в дозе 2 мг/л, статистически значимо (р = 0,0007, тест Колмогорова — Смирнова). Различие дан-
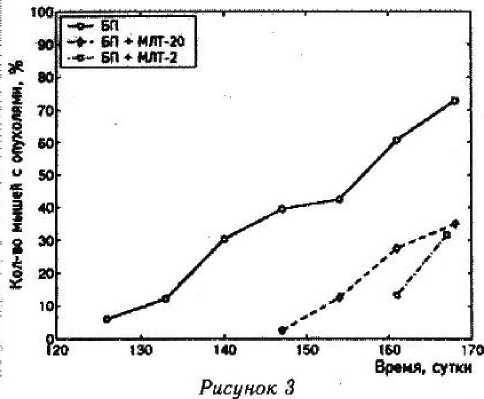
Влияние мелатонина на развитие опухолей и латентный период
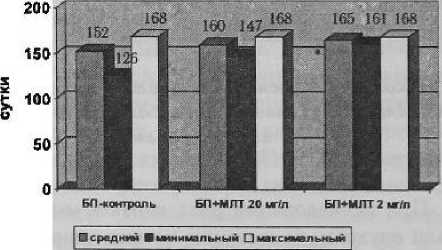
Рисунок 4
Значения среднего, минимального и максимального латентного периодов в группе контроля и в группах, получавших мелатонин
* — достоверность отличий по отношению к группе контроля
кого показателя между группами, получающими разные дозы мелатонина, существенно (р = 0,0248, тест Колмогорова — Смирнова).
Изменение значений средней, минимальной и максимальной продолжительности жизни мышей под влиянием мелатонина показаны на рис. 5. В группе контроля темп роста кривых Гомперца меньше, чем в опытных группах. Наибольший темп увеличения кривых Гомперца отмечался в группе, получавшей меньшую дозу мелатонина.
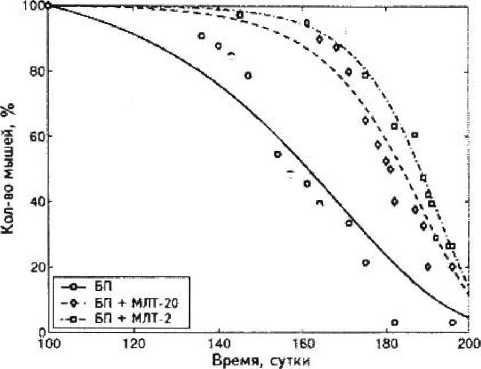
Рисунок 5
Кривые выживаемости Гомперца для мышей контрольной и опытных групп, получавших рЗЗЛ—ЧМЫЗ доЗЫ ирдлтлмРиу
Средняя продолжительность жизни мышей после появления опухолей составила 13 ± ± 2 суток (минимальная — 7 суток, максимальная —■ 14 суток). Введение мелатонина значительно увеличивало среднюю, минимальную и максимальную продолжительность жизни мышей после развития опухолей. Так, в группе, получавшей мелатонин в дозе 20 мг/л, средняя продолжительность жизни после развития опухолей составила 16 ± 4,9 суток, что на 23,1 % (3 суток) больше, чем в группе контроля (минимальная — 10,5 суток, максимальная — 24,5 суток). Различие средней продолжительности жизни после появления опухолей в группе контроля и в группе, получавшей мелатонин в дозе 20 мг/л, статистически значимо (р = 0,0665, тест Колмогорова — Смирнова).
Доза 2 мг/л оказалась более эффективной, чем доза 20 мг/л. В данной группе аналогичный показатель увеличился на 60,4 % (7 су ток) и составил 20 ± 4 суток (минимальная продолжительность жизни — 14 суток, максимальная — 24,5 суток). Различие средней продолжительности жизни после появления опухолей в группе контроля и в группе, получавшей мелатонин в дозе 2 мг/л, существенно (р = 0,0231, тест Колмогорова — Смирнова). После появления опухоли распределение продолжительности жизни в группах, получавших мелатонин, идентично с вероятностью 0,9983 (тест Колмогорова — Смирнова).
Изменение значений средней, минимальной и максимальной продолжительности жизни после появления опухолей у мышей в группе
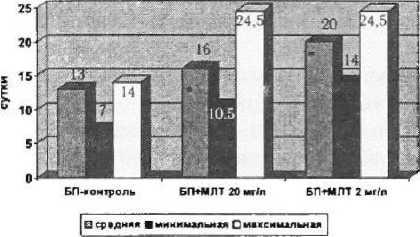
Рисунок 6
Средняя, минимальная и максимальная продолжительность жизни мышей в контроле и опытных группах после развития опухолей
* — достоверность отличий по отношению к контрольной группе
Кривые выживаемости Гомперца животных после развития опухолей в контроле и в группах, получавших разные дозы мелатонина
Рисунок 8 Злокачественная фиброзная гистиоцитома, плеоморфный вариант. ^Муаровые структуры» в ткани опухоли Окр. гематоксилин-эозин, увеличено в 80 раз
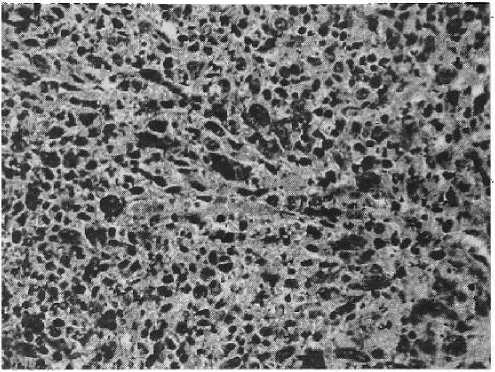
Рисунок 9
Злокачественная фиброзная гистиоцитома, плеоморфный вариант. Выраженный полиморфизм клеточных элементов
Окр, гематоксилин-эозин, увеличено в 400 раз
контроля и в получавших мелатонин группах представлены на рис. 6.
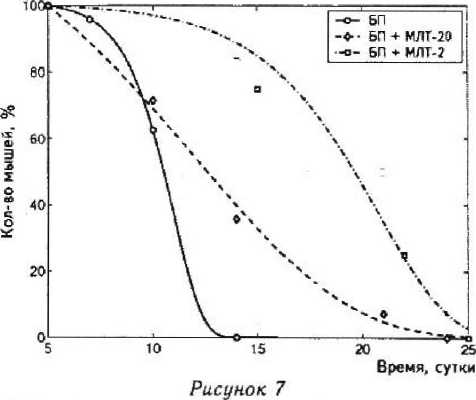
Темп нарастания кривых выживаемости Гом-перца после появления опухолей в труппе контроля наибольший. Самое медленное увеличение кривых Гомперца отмечено в группе, получавшей большую дозу мелатонина (рис. 7).
При микроскопическом исследовании согласно рекомендациям МАИР опухоли классифицировались как злокачественные фиброз-
ТГТ m НИАТиЛ tTXJ'I'nX t. 1 i LUK. А /IV i ПиЦл 1 ULI1 UI .
Микроскопически при малом увеличении опухоль состояла из веретеновидных клеток, заключенных в сеть разнонаправленных пучков коллагеновых волокон, часто формировавших характерные для данной опухоли «муаровые структуры» (рис. 8). При большом увеличении определялся выраженный клеточный полиморфизм. Нами было отмечено сочетание веретенообразных фибробластоподобных и гистиоцитоподобных клеток — одно- и многоядерных, уродливых или причудливой формы (рис. 9).
Все клеточные элементы имели признаки резко выраженной атилии: ядерный полимор- (ФтГАОХГ Сип QTTVnniKIinm'T ГТ Агл п 1~.ТТ/М Z П Г> Т 1 Улл Г» П АП Г»Л ф-iiUL'i, A н. iu^A.yvmiiAJL л и, Л С Ч- ^АА V A LVAT 1 epi 1 W р, «X-А1 j-V ' деление хроматина, нарушение ядерно-цито-плазматического соотношения. Наблюдались множественные митозы в опухолевых клет-
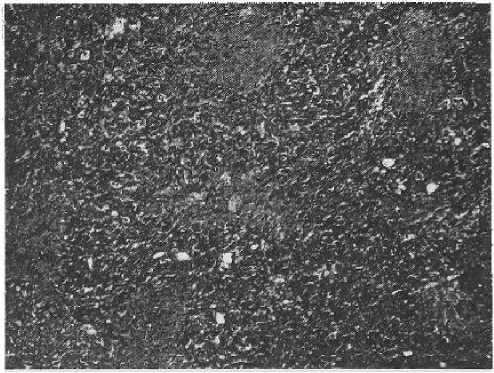
Рисунок 10
Злокачественная фиброзная гистиоцитома, плеоморфный вариант. Очаги некроза в ткани опухоли
Окр. гематоксилин-эозин, увеличено в 80 раз
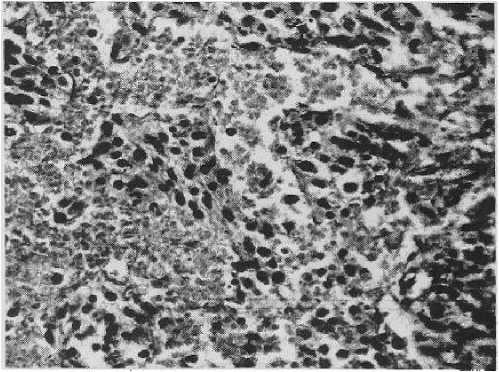
Рисунок 11
Злокачественная фиброзная гистиоцитома, плеоморфный вариант. Полнокровие и очаги кровоизлияний
Окр. гематоксилин-эозин, увеличено в 400 раз
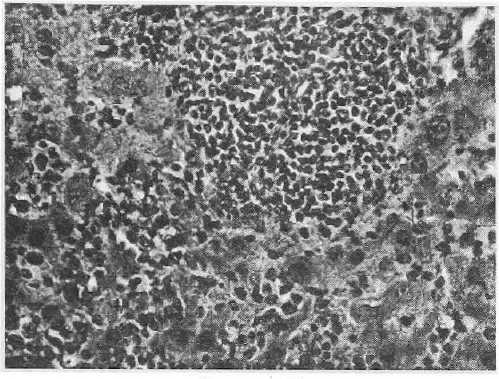
Рисунок 12
Метастаз в печени злокачественной фиброзной гистиоцитомы
Окр. гематокси.гин-эозин, увеличено в 80 раз
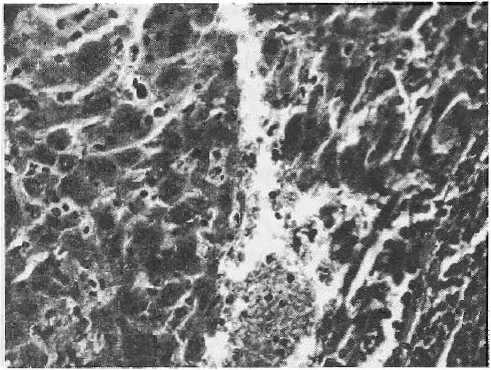
Рисунок 13
Метастаз в печени злокачественной фиброзной гистиоцитомы. Клетки опухоли в просеете сосуда
Окр. гематоксилин-эозин, увеличено в 400 раз
ках, хорошо васкуляризированная ткань опухоли. В ряде случаев обнаруживалась инвазия опухолевых клеток в стенки кровеносных сосудов. В большинстве случаев отмечались некрозы (рис. 10) и кровоизлияния (рис. 11) в опухолевой ткани.
Таким образом, в одних участках опухолевых узлов наблюдалась микроскопическая картина, характерная для круглоклеточной саркомы; в других — для веретеновиднокле-точной саркомы. В целом описанная гистологическая структура характерна для плеоморфного варианта злокачественной фиброзной гистиоцитомы с выраженной анаплазией клеточных элементов.
При микроскопическом изучении метастатических узлов в печени отмечались нарушение нормальной балочной структуры, диффузная и очаговая инфильтрация полиморфными гиперх-ромными опухолевыми клетками (рис. 12). Также имелись признаки инвазивного роста — опухолевые клетки в центральной вене (рис. 13). Отличий по гистологической структуре опухолевой ткани у животных контрольной и опытных групп отмечено не было.
При биохимическом исследовании было выявлено, что уровень МДА у интактных животных составил 4,98 ± 0,58 ммоль/л в сыворотке крови и 8,44 ±0,18 ммоль/л — в ткани опухоли подкожной клетчатки. Активность каталазы составила соответственно 0,41 ± 0,02 мккат/л в сыворотке крови и 0,73 ± 0,03 мккат/л в ткани опухоли (табл.).
Таблица.
Динамика содержания МДА и активности каталазы в сыворотке крови и ткани опухоли животных группы, контроля и при коррекции мелатонином
|
№ группы |
Воздействие |
Уровень МДА, ммоль/л |
Активность каталазы, мккат/л |
||
|
Сыворотка крови |
Ткань опухоли |
Сыворотка крови |
Ткань опухоли |
||
|
1 |
Интактный контроль |
4.98 ± 0,58 |
8,44 ± 0,18 |
0,41 ± 0,02 |
0,73 ± 0,03 |
|
(п = 6) |
(п = 5) |
(п = 6) |
(п = 5) |
||
|
2 |
Бенз[а]пирен |
13.1 ± 0,63 |
9,38 ± 0,26 |
0,51 ± 0,05 |
0,77 ± 0,13 |
|
(п = 10) |
(п = 5) |
(п = 9) |
(п = 5) |
||
|
3 |
Бенз[а]пирен + |
4,18 ± 0,39 |
6,68 ± 0,53 |
0,44 ± 0,04 |
0,57 ±0,11 |
|
+ мелатонин, 20 мг/л |
(п = 6) |
(п = 5) |
(п - 8) |
(п = 5) |
|
|
4 |
Бенз[а1пирен + |
3,18 ± 0,15 |
5,58 ± 0,55 |
0,35 ± 0,05 |
0,3 ± 0,04 |
|
+ мелатонин, 2 мг/л |
(п = 8) |
(п = 5) |
(п = 8) |
(п = 5) |
|
|
Достоверность различий между |
Р23< 0,001 |
рЬ2< 0,05 |
р12 < 0,05 |
Рм< 0,01 |
|
|
группами, р |
р1А< 0.001 |
р2,3< 0,01 |
ргА < 0,05 |
||
|
Рм < О-0»1 |
|||||
После введения канцерогена содержание МДА увеличилось по сравнению с контролем на 163 % в сыворотке крови и на 11,1 % в опухолевой ткани и составило соответственно 13,1 ± 0,63 ммоль/л (р < 0,001) и 9,38 ± 0,26 ммоль/л (р < 0,05). Активность каталазы в сыворотке крови достоверно увеличилась лишь в сыворотке крови, составив 0,51 ± 0,05 мккат/л, что на 25,4 % больше, чем в группе контроля (р < 0,05).
При введении мелатонина в дозе 20 мг/л содержание МДА в сыворотке крови уменьшилось на 68,1 % по сравнению с группой контроля и составило 4,18 ± 0,39 ммоль/л (р < 0,001). В опухолевой ткани аналогичный показатель составил 6,68 ± 0,53 ммоль/л, что на 28,8 % меньше, чем в группе контроля (р < 0,01), т. е. имело место уменьшение показателей до субнормальных величин; на 20,8 % меньше, чем в интактном контроле (р < 0,05).
Введение мелатонина в дозе 2 мг/л вызвало достоверное уменьшение уровня МДА в сыворотке крови на 75,7 % по сравнению с контролем (р < 0,001) и составило 3,18 ± 0,15 ммоль/л, что на 36,2 % меньше, чем в интактном контроле (р < 0,05). Аналогичные изменения содержания МДА произошли в ткани опухоли под действием малой дозы мелатонина. Уровень МДА составил 5.58 ± 0,55. что на 40,5 % меньше, чем в группе контроля (р < 0,001) и на 33,8 % меньше, чем у интактных животных (р < 0,01).
Введение мелатонина в дозе 20 мг/л не приводило к статистически значимому изменению активности каталазы как в сыворотке, так и в опухолевой ткани. Мелатонин в дозе 2 мг/л вызывал достоверное уменьшение активности каталазы по сравнению с контролем на 32 %, которая составила 0,35 ± 0,05 (р < 0,05). В то же время активность каталазы в опухолевой ткани под действием малой дозы мелатонина значительно снизилась по сравнению с контролем на 60,6 % и составила 0,3 ± 0,04 (р < 0,01), т, е. на 58,6 % меньше, чем в группе интактного контроля (р < 0,001).
Полученные результаты свидетельствуют о том, что мелатонин замедляет процессы опухолевого роста в мягких тканях у мышей в условиях экспериментального канцерогенеза, индуцируемого бенз[а]пиреном. Антиканцерогенный эффект мелатонина ранее был продемонстрирован на различных культурах опухолевых клеток in ultra. Сведения относительно влияния мелатонина на опухолевый рост in vivo немногочисленны. Было установлено, что введение экзогенного мелатонина тормозит развитие спонтанных опухолей и канцерогенез молочной железы, индуцируемый введением 7,12-диметилбенз(а)антрацена (ДМБА) или N-нитрозометилмочевиной (НММ) у самок крыс. Мелатонин также тормозит развитие опухолей шейки матки и влагалища, индуцируемых интравагинальными аппликациями ДМБА, папиллом кожи, индуцированных накожными аппликациями бенз[а]пирена и кротонового масла, а также канцерогенез толстого кишечника, индуцируемый 1,2-диметилгидрази-ном. Однако исследования влияния мелатонина на канцерогенез мягких тканей ранее не проводились. Таким образом, настоящая работа «заполняет пробел» в изучении онколротек-торных свойств данного гормона.
Эффект мелатонина имеет характер дозовой зависимости: эффект меньшей дозы выражен в большей степени, чем эффект большей дозы. Аналогичная зависимость была выявлена в опытах, выполненных in ultra на культурах опухолевых клеток, тогда как в большинстве работ tn ulvo мелатонин применялся в одной дозе.
Исследование позволило сделать следующие выводы: 1) мелатонин оказывает выраженное антиканцерогенное действие на развитие индуцированных опухолей мезенхимального гистогенеза у мышей, что проявляется в уменьшении частоты развития опухолей и увеличении их латентного периода; 2) мелатонин оказывает антиметастатическое действие на опухоли мягких тканей в эксперименте; 3) мелатонин значительно увеличивает продолжительность жизни животных, подвергнутых воздействию бенз[а]пирена, а также выживаемость опухоле-носителей; 4) мелатонин обладает антиоксидантным эффектом, ингибируя процессы перекисного окисления липидов как в сыворотке крови, так и в опухолевой ткани; 5) влияние мелатонина на изучаемые морфологические и биохимические параметры имеет характер дозовой зависимости: более выраженное антиканцерогенное и антиоксидантное действие оказывает меньшая доза препарата.
Поступала 20 ! I 06.
ФЛЮОРЕСЦЕНТНАЯ ДИАГНОСТИКА
И ФОТОДИНАМИЧЕСКАЯ ТЕРАПИЯ РАКА КОЖИ ПО ДАННЫМ ЛАБОРАТОРИИ ЛАЗЕРНЫХ
ТЕХНОЛОГИЙ
Список литературы Влияние мелатонина на динамику некоторых морфофункциональных параметров опухолевого роста в условиях экспериментального канцерогенеза
- Анисимов В. Н. Канцерогенез и старение/В. Н. Анисимов//Успехи геронтологии. 2002. № 10. С. 99 -123.
- Пальцев М. А. Межклеточные взаимодействия/М. А. Пальцев, А. А. Иванов, С. Е. Северин. М.: Медицина, 2003. 28


