Влияние мелатонина на макрофаги и клетки дисперсной эндокринной системы селезенки
Автор: Лузикова Елена Михайловна, Московский Александр Владимирович, Московская Олеся Игоревна, Ефремова Ольга Александровна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Краткие сообщения
Статья в выпуске: 1 т.24, 2016 года.
Бесплатный доступ
Изучена реакция Iba-I-позитивных клеток селезенки на введение мелатонина. Установлено, что введение мелатонина (препарат «Мелаксен») с водой перорально (раствор 4 мг препарата на 1 л Н2О) в течение 4 недель приводит к морфологическим изменениям: уменьшению среднего количества клеток макрофагального ряда (Iba-1+), увеличению количества лимфоидных узелков; уменьшению содержания катехоламинов и серотонина во всех иммунокомпетентных клетках красной и белой пульпы; снижению содержания гистамина в люминесцирующих гранулярных клетках красной пульпы.
Селезенка, мелатонин, макрофаги, нейроаминсодержащие клетки
Короткий адрес: https://sciup.org/143177079
IDR: 143177079
Текст научной статьи Влияние мелатонина на макрофаги и клетки дисперсной эндокринной системы селезенки
Введение. Мелатонин — нейропептид и нейротрансмиттер участвующий в синхронизации циркадных ритмов, оказывающий онкопротектор-ное [1], геропротекторное [5, 8] и иммуностимулирующее действие [5, 8, 9, 12]. Экстрапинеальный мелатонин играет ключевую роль в координации клеточных функций и межклеточных связей при иммунном ответе [14]. Одни исследователи считают, что мелатонин не оказывает ни прямого, ни опосредованного Т-лимфоцитами влияния на активированные макрофаги [16]. Результаты других исследований показывают, что количество натуральных киллеров и макрофагов в селезенке под влиянием мелатонина возрастает [11].
Ионизирующая кальций связывающая адапторная молекула (Iba-1) идентифицирована как кальций-связывающий белок, экспрессирующийся клетками моноцитарно-макрофагального происхождения [4]. Iba-1 принимает участие в реорганизации актинового скелета и образовании мембранных складок макрофагов при индуцированном фагоцитозе [13].
C помощью люминесцентно-гистохимических методов в селезенке обнаруживаются люминесцирующие гранулярные клетки (ЛГК), обладающие функцией синтеза и накопления и секреции биогенных аминов: ЛГК лимфоидных узелков, ЛГК на границе лимфоидного узелка (береговые ЛГК) и ЛГК красной пульпы (2, 3). ЛГК селезенки относятся к клеткам дисперсной эндокринной системы (APUD–серии) (9), которые играют большую роль в формировании местного гомеостаза Часть клеток диффузной эндокринной системы относится к макрофагальному ряду, например, дендритные клетки (3).
Цель исследования - выявить реакцию клеток макрофагального ряда и биоаминсодержащих клеток селезенки на экзогенный мелатонин.
Материал и методы исследования. Объектом исследования служила селезенки 60 двухмесячных мышей-самцов одной массы (18 - 22 г), содержавшихся при сбалансированном рационе питания и в различных условиях освещения.
Животные были разделены на 2 группы:
I - (n = 30) – животные, которые содержались в обычных условиях вивария в течение 4 недель эксперимента (естественное освещение; продолжительность светового дня 8 – 9 часов; освещенность на уровне клеток в утренние часы 50 – 150 люкс, днем в пасмурный день – до 500 люкс, в ясный день – до 1000 люкс, вечером 100 – 200
люкс; влажность воздуха 40 – 60%, свободный доступ к питьевой воде и корму);
II - (n = 30) – животные получали препарат мелаксен ad libium в концентрации 4 мг/литр с питьевой водой в течение 4 недель и находились в условиях обычного освещения (естественное освещение; продолжительность светового дня 8 – 9 часов; освещенность на уровне клеток в утренние часы 50 – 150 люкс, днем в пасмурный день – до 500 люкс, в ясный день – до 1000 люкс, вечером 100 – 200 люкс; влажность воздуха 50 – 70%);
Селезенка у животных забиралась после декапитации на 28-е сутки эксперимента во второй половине дня (1500 – 1700). Все действия, предусматривавшие контакт с лабораторными животными, осуществлялись с учетом требований «Правил проведения работ с использованием экспериментальных животных» («Приказ МЗ РФ от 19.06.2003 г. №267) и в соответствии с «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях».
Криостатные срезы селезенки толщиной 5 мкм обрабатывались следующими методами: непрямым иммунофлуоресцентным методом по стандартному протоколу:
эндогенная пероксидазная активность подавлялась путем инкубации срезов в 3% растворе H2O2 в течении 30 минут с последующей трехкратной промывкой 0,1 М фосфатным буфером. Блок неспецифического связывания проводился преинкубацией срезов с 10% козьей сывороткой и 0,05% тритоном Х-100. В качестве первичных антител были использованы анти-Iba-1 (1:1000; rabbit polyclonal anti-Iba-1,Wako Chemicals GmbH, Neuss, Germany). Для визуализации Iba-1 использованы меченные флуорохромом вторичные антитела Alexa Fluor 488 (1:250; goat anti rat IgG; Invitrogen) [15]. Препараты анализировались при помощи светового микроскопа Микмед 5, подсчет структур проводился при увеличении 1500; люминесцентно-гистохимическим методом Фалька – Хилларпа (В. Falk, N.A. Hillarp et al., 1962.) в модификации Е.М. Крохиной (Е.М. Крохина, П.Н. Александров 1969) для избирательного выявления катехоламинов и серотонина в морфо-функциональных структурах тимуса. Срезы органов толщиной 10-15 мкм обрабатывались в параформальдегидной камере в течение 60 минут при температурном режиме термостата 80°С. При обработке тканей парами формальдегида моноамины превращаются в сильнофлуоресцирующие вещества (флуорофоры). При облучении видимым сине-фиолетовым светом низкие концентрации флюорофоров светятся изумрудно-зеленым, высокие – желтым светом. Серотонин под воздействием паров формальдегида превращается в 3,4-дигидро- ß-карболин – флюорофор, дающий желтое свечение;
методом цитоспектрофлуориметрии: уровень биоаминов в ТК определялся на микроскопе ЛЮМАМ-4 с помощью спектрофлуорометрической насадки ФМЭЛ –1А (В.Н. Карнаухов, 1978; В.Л. Калмыков, 1982) при выходном напряжении 900 В. Принцип данной процедуры заключается в следующем: ультрафиолетовые лучи определенной длины (390 нм), проходя через специальное отверстие – зонд диаметром 0,5 мм, направляются на препарат в темном поле. Зонд вырезает в плоскости препарата область, свет от которой идет на интерференционный светофильтр с определенной длиной волны. Для выявления интенсивности свечения гистамина используется сетофильтр № 7 (длина волны 515 нм). Флуорофоры катехоламинов в срезах образца начинают светиться с максимумом эмиссии 480 нм (фильтр № 6), свечение серотонина регистрируется на длине волны 525 нм (фильтр № 8). Замер интенсивности свечения производился в единицах флуоресценции (условные единицы по шкале регистрирующего прибора-усилителя У-5);
определением серотонинового индекса (Js)– безразменной величины, являющейся средней величиной от суммы частных соотношений содержания серотонина и катехоламинов в одной и той же клетке.
Js = [С]/[КА ] x N, где [С] – уровень серотонина, [КА] – уровень катехоламинов, N – число наблюдений. По динамике уровней биогенных аминов не всегда можно достоверно судить об их влиянии на интегральную биоаминную обеспеченность органа и на иммуногенез. Даже при нарастании концентрации серотонина влияние его может уменьшаться, в зависимости от динамики катехоламинов. Статистическая обработка полученных цифровых данных проводилась с использованием пакета программ Microsoft office (Word и Exсel). Оценка статистической значимости производилась по критерию Манна-Уитни.
Результаты исследования и их обсуждение. Введение мелатонина в течение 4-х недель приводит к увеличению среднего веса селезенки от 0,19 ± 0,02 г в контрольной группе до 0,21 ± 0,05 г. (p = 0,01) и увеличению первичных лимфоидных узелков во II-й экспериментальной группе.
Исследование клеток моноцитарно-макрофагального происхождения показывает, что ежедневный введение мелатонина в течение 4 недель животным, находящимся в условиях естественного освещения приводит к уменьшению среднего количества Iba-1-позитивных клеток в 2 раза (p = 0,0006). Наблюдается уменьшение количества Iba-1-позитивных клеток в ПАЛМ и во всех зонах лимфоидных узелков. Исследование
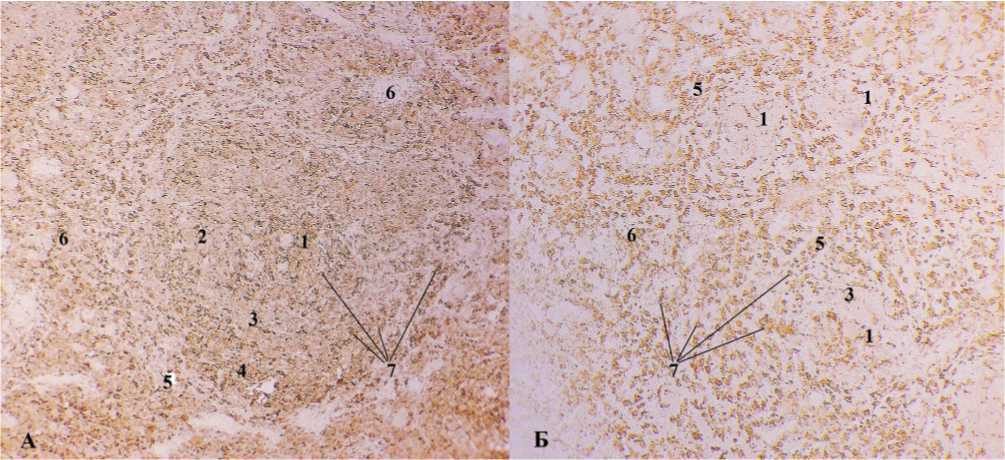
Рис. 1. Влияние мелатонина на Iba-1-позитивные клетки селезенки. Ув.100. А – лимфоидный узелок селезенки контрольных животных, Б – лимфоидные узелки селезенки животных, получавших мелатонин. 1 – периартериальная зона, 2 – зона размножения, 3 – мантийная зона, 4 – маргинальная зона, 5 – маргинальный синус, 6 – красная пульпа, 7 - Iba-1-позитивные клетки.
А
Б
контроль мелатонин
контроль мелатонин
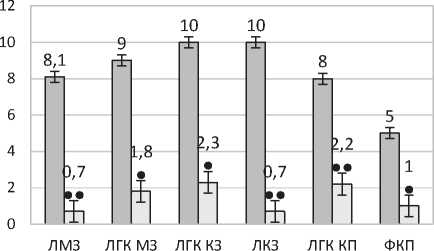
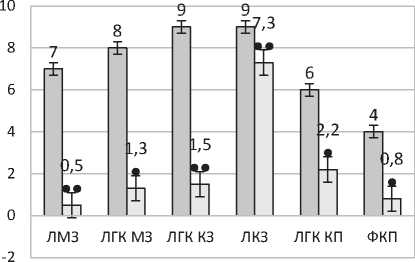
Рис. 2. Влияние мелатонина на содержание биоаминов (А — катехоламинов, Б серотонина) в иммунокомпетентных структурах селезенки: ЛМЗ — лимфоцитах мантийной зоны лимфоидного узелка, ЛГК МЗ — люминесцирующих гранулярных клетках мантийной зоны лимфоидного узелка, ЛГК КЗ — люминесцирующих гранулярных клетках маргинальной зоны лимфоидного узелка, ЛКЗ — лимфоцитах маргинальной зоны; ЛГК КП — люминесцирующих гранулярных клетках красной пульпы, ФКП — микроокружении ЛГК красной пульпы. • – p ≤ 0,01; •• - – p ≤ 0,001
красной пульпы селезенки животных, получавших мелатонин, показало уменьшение количества Iba-1-позитивных клеток в маргинальных синусах и увеличение в субкапсулярных синусах красной пульпы (рис. 1).
Изучение биоаминсодержащих иммунокомпетентных клеток селезенки показало, что под действием мелатонина содержание серотонина и катехоламинов во всех изученных структурах снижается.
По динамике уровней биогенных аминов не всегда можно достоверно судить об их влиянии на интегральную биоаминную обеспеченность органа и на иммуногенез. По серотониновому индексу (коэффициенту реципрокности) можно судить о преобладании серотонина в клетке (Js> 1), либо катхоламинов (Js < 1), что косвенно указывает о наличие процессов иммуносупрессии, либо об их отсутствии (Л.В. Девойно, 1972-1983).
В нашем эксперименте даже при снижении концентраций серотонина (рис. 2Б) и катехоламинов (рис. 2Б) во всех исследуемых структурах, их соотношение в клетках значимо не меняется: преимущественно наблюдается преобладание катехоламинов. Серотониновый индекс (Js) в структурах селезенки контрольных животных колеблется в пределах от 0,8 до 0,9 а в структурах селезенки животных, получавших мелатонин от 0,3 до 7,0. Под влиянием мелатонина Js лимфоцитов мантийной зоны увеличивается до 2, а Js лимфоцитов маргинальной зоны увеличивается до 7, что свидетельствует о преобладании серотонина в этих зонах. Таким образом, мы наблюдаем перераспределение биоаминов в лимфоидном узелке. Наиболее чувствительными к мелатонину являются ПАЛМ, маргинальные и субкапсулярные синусы красной пульпы селезенки.
Выводы. Мелатонин, вводимый перорально в течение четырех недель вызывает морфологические изменения в селезенке:
увеличение количества лимфоидных узелков;
уменьшение среднего количества клеток макрофагального ряда (Iba-1+) во всех зонах селезенки, за исключением зоны красной пульпы, прилегающей к капсуле.
снижение содержания катехоламинов и серотонина во всех иммунокомпетентных клетках красной и белой пульпы.
Список литературы Влияние мелатонина на макрофаги и клетки дисперсной эндокринной системы селезенки
- Арушанян, Э. Б. Гормон мозговой железы эпиф иза мелатонин - универсальный естественный адаптоген / Э. Б. Арушанян, Э. В. Бейер // Успехи физиологических наук. - 2012. - Т. 43. - № 3. - С. 82 - 100.
- Воронкова, О.В. Серотониновый индекс в биоаминсодержащих структурах селезенки при водном воздействии кальция / О.В. Воробьева. // Материалы Всероссийской конференции «Морфология в теории и практике». Чебоксары, 2008. - С. 59-60.
- Гордон, Д.С. Нейромедиаторы лимфоидных органов/Д.С. Гордон, В.Е. Сергеева, И.Г. Зеленова//Л.: Наука, 1982. -128 с.
- Кирик О.В. Кальций-связывающий белок Iba-1/ AIF1 в клетках головного мозга крысы /О.В. Кирик, Е.Г. Сухорукова, Д.Э. Коржевский //Морфология. 2010. Т. 136, № 2. С. 5 -7.
- Князькин, И. В. Экстрапинеальный мелатонин в процессах ускоренного и преждевременного старения у крыс / И. В. Князькин // Успехи геронтологии. - 2008. - Т. 21. - № 1. - С. 80 - 82.
- Маянский Н.А. Номенклатура и функции главного комплекса гистосовместимости человека /Н. А Маянский., А.Н. Маянский //Иммунология. 2006. Т. 27, № 1. С. 43-46.
- Сарилова И.Л. Эффект тестэктомии на структуры вилочковой железы, экспрессирующие главный комплекс гистосовместимости II класса /И.Л. Сарилова, В.Е. Сергеева, А.Т. Смородченко// Бюлл. Эксп. Биол. Мед. 2008. Т. 146, № 1. С. 103 - 106.
- Baeza, I. Improvement of leucocyte functions in ovariectomised aged rats after treatment with growth hormone, melatonin, oestrogens or phyto-oestrogens /I. Baeza, C. Alvarado, P. Alvarez, V. Salazar, C. Castillo, C. Ariznavarreta, J. A. Fdez-Tresguerres // J Reprod Immunol. - 2009. - V. 80. - № 1-2. - P. 70 - 79.
- Bugorkova S.A. Morphofunctional evaluation of the state of cells of APUD-system biomodel during anti-plague vaccine process /S.A. Bugorkova, V.V. Kutyreva // Zh Mikrobiol Epidemiol Immunobiol. - 2013. - № 4. - P. 49-55
- Cernysiov, V. Expression of melatonin receptors in the cells of immune system /V. Cernysiov, R. Bozaite, M. Mauricas, I. Girkontaite //Immunology. - 2012. - V. 137. - № 1. - P. 296.
- Currier, N. L. Exogenous melatonin: quantitative enhancement in vivo of cells mediating non-specific immunity /N. L. Currier, L. Z. Sun, S. C. Miller // J Neuroimmunol. -2000. V. 104. - № 2. - P. 101 - 108.
- Gupta, S. Photoperiodic regulation of nuclear melatonin receptor RORa in lymphoid organs of a tropical rodent Funambulus pennanti: role in seasonal oxidative stress [Электронный ресурс] /S. Gupta, C. Haldar, R. J. Ahmad// Photochem Photobiol B. - 2014. - Режим доступа: http://www.10.1016/j. jphotobiol.2014.11.013.
- DOI: 10.1016/j.jphotobiol.2014.11.013
- Ohsawa K. Microglia / macrophage-specific protein Iba1 binds to fimbrin and enhances its actin-binding activity / K. Ohsaw, Y. Imai, Y. Sasaki,S. Kohsaka // J. Neurochem. 2004. Vol. 88. P. 844 - 856.
- Ozkanlar, S. Melatonin Modulates the Immune System Response and Inflammation in Diabetic Rats Experimentally-Induced by Alloxan [Электронный ресурс]/S. Ozkanlar, A. Kara, E. Sengul, N. Simsek, A. Karadeniz, N. Kurt// Horm Metab Res. - 2015. -V. 47. - P. 1 - 8.
- Smorodchenko A. CNS - irrelevant T-cells enter the brain, cause blood-brain barrier disruption but no glial pathology/A. Smorodchenko, I. Wuerfel, E. Pohl, I. Vogt // Eur J. Neurosci. - 2007. V. 26. - № 6. - P. 1387-1398.
- Shafer, L.L. Assessment of melatonin's ability to regulate cytokine production by macrophage and microglia cell types / L. L. Shafer, J. A. McNulty, M. R. Young // J Neuroimmunol. - 2001. - V. 120. - №


