Влияние минерализатора и продолжительности синтеза на сорбционные свойства ситинакита и иванюкита
Автор: Перовский И.А., Паникоровский Т.Л., Шушков Д.А.
Журнал: Вестник геонаук @vestnik-geo
Рубрика: Научные статьи
Статья в выпуске: 3 (351), 2024 года.
Бесплатный доступ
На основе отходов обогащения кварц-лейкоксенового концентрата (Ярегское месторождение, Республика Коми) автоклавным способом синтезированы титаносиликаты со структурой ситинакита и иванюкита. Установлено, что при использовании смеси минерализатора КОН и NaOН в концентрации 0.15 и 1 моль/л соответственно формируется К-Na-ситинакит. При концентрации 0.45 моль/л для КОН и 0.7 моль/л для NaOН кристаллизуется иванюкит. Полученные титаносиликаты характеризуются высокой сорбционной активностью в отношении катионов Sr2+ и Сs+. Сорбционная емкость К-Na-ситинакита и иванюкита по Sr составила 95-110 и 102-114 мг/г соответственно. Сорбционная емкость по Cs+ для К-Na-ситинакита составляет 240 мг/г, для иванюкита значительно выше - 370-380 мг/г. Показано, что различия в сорбционной емкости К-Na-ситинакита и иванюкита обусловлены особенностями кристаллической структуры.
Титаносиликаты, ситинакит, иванюкит, сорбция, cs, sr
Короткий адрес: https://sciup.org/149145599
IDR: 149145599 | УДК: 549.057+549.08+544.77 | DOI: 10.19110/geov.2024.3.3
Текст научной статьи Влияние минерализатора и продолжительности синтеза на сорбционные свойства ситинакита и иванюкита
В последние годы активно развиваются технологии комплексной переработки минерального сырья, которые позволяют увеличивать глубину переработки и минимизируют негативное воздействие на окружающую среду. Такие подходы включают повторное вовлечение химических реагентов в производственный цикл, а также предусматривают переработку полученных отходов в новые материалы, создавая, таким образом, безотходное производство.
Создание безотходных технологий переработки актуально для титановой отрасли России, в частности для крупнейшего Ярегского месторождения титана, расположенного в Республике Коми. Основным товарным продуктом Ярегского титана является кварц-лейкоксеновый концентрат с содержанием 45–50 % TiO2 и 40–45 % SiO2 (Игнатьев, Бурцев, 1997). Предлагаемые на сегодняшний день технологии переработки кварц-лейкоксеновых концентратов, направленных на получение концентратов с высоким содержа- нием титана (Сысолятин, 1969; Конык, 1985; Zabolotskaya, 2011; Anisonyan, 2011; Nikolaev, 2017; Zanaveskin, 2022), а также попутного синтеза ценных товарных продуктов — волластонита, аносовита, карбосилицида титана, керамических композитов — имеют свои технологические сложности (Grass, 2009; Istomin, 2015; Sadykhov, 2016; Istomin, 2022). Недостатками предложенных способов являются высокие производственные затраты, связанные с многостадийностью процессов, энергоемкостью, утилизацией больших объемов твердых отходов и сточных вод. Это приводит к высокой себестоимости получаемых продуктов и делает концентрат неконкурентоспособным на рынке титанового сырья. Повышение качества продукции при снижении себестоимости переработки стимулирует интерес к созданию новых технологий, среди которых особое место уделяется использованию фторидных методов переработки минерального сырья (Карелин, 2004; Андреев, 2007; Demyanova, 2011; Крысенко, 2015; Smorokov, 2022).
Реализованный на базе Института геологии процесс фтораммонийного обогащения кварц-лейко-сеновых концентратов позволяет получить титановый концентрат, содержащий более 80 % TiO2 и менее 2 % SiO2, (Perovskiy, Burtsev, 2022). При этом температура процесса не превышает 300 °С, а время обескремнивания составляет менее 2-х часов. Полученные концентраты содержат титан в рутиле и могут быть без ограничений направлены для переработки в металлический титан и пигментный диоксид титана. Фтораммонийный подход обогащения позволяет не только получать титановый концентрат, но и повторно вовлечь реагент (NH4HF2) в технологический цикл, а также использовать отходы обогащения для синтеза востребованных материалов — синтетических титаносиликатов. Из отходов обогащения с помощью гидротермального синтеза нами был получен титаносиликат со структурой ситина-кита, имеющий также коммерческое название CST (IONSIV IE-911, выпускаемый компанией UOP) и проявляющий высокую селективность при извлечении радиоактивных изотопов 90Sr и 137Cs (Perovskiy, 2018). Синтезированный ситинакит характеризовался высокой сорбционной емкостью по Sr2+, однако в сравнении с синтетическим аналогом, полученным другими исследователями, имел более низкую сорбционную емкость по Cs+ (Perovskiy, 2021). Предположительно, снижение сорбционных свойств было вызвано отсутствием в структуре синтезированного ситинакита катионов калия. Поэтому целью данного исследования было установить влияние минерализатора (смеси NaOH–KOH) на структурный тип синтезируемого ти-таносиликата, а также выявить влияние продолжительности синтеза на кристалличность и сорбционные свойства получаемых титаносиликатов.
Материалы и методыСинтез титаносиликатов
В основе получения титаносиликатов лежит гидротермальный синтез. Для достижения стабильного результата синтеза титаносиликатов в соответствии с предложенной методикой (Perovskiy, Shushkov, 2023) проводилась наработка гидратированного осадка заданного состава из оборотных растворов фтораммонийного обогащения кварц-лейкоксеновых концентратов. Гидратированный осадок представляет собой смесь комплексных частиц SiO4–TiOn с содержанием SiO2 — 46 %, TiO2 — 49 %. Высушенный осадок массой 0.5 г смешивался с 37 мл раствора минерализатора, в качестве которого использовалась смесь щелочей NaOH и KOH. Для синтеза титаносиликата со структурой си-тинакита концентрация NaOH составляет 1 моль/л, концентрация КОН — 0.15 моль/л. Для синтеза тита-носиликата со структурой иванюкита концентрацию
NaOH снижали до 0.7 моль/л, а концентрацию KOH увеличивали до 0.45 моль/л. Гомогенизацию суспензий проводили в течение 20 мин. на магнитной мешалке со скоростью перемешивания 400 об/мин. Мольное соотношение основных компонентов Na2O:KOH: TiO2:SiO2:H2O в полученных системах представлено в таблице 1. Полученные суспензии переносили в автоклав с тефлоновым вкладышем объемом 45 мл, степень заполнения которого составляла 80 %. Гидротермальный синтез проводился при температуре 250 °С в течение 12 и 24 ч. Продолжительность синтеза варьировали для изучения влияния кристалличности материала на его сорбционные свойства. По завершении процесса синтеза автоклавы охлаждали до комнатной температуры на воздухе. Полученные продукты синтеза отмывали от избытка щелочи деионизированной водой, контролируя рН промывной воды. Отмывку считали завершенной, когда рН воды не превышал 7. Образцам титаносиликата со структурой ситинакита присвоены номера S-12 и S-24, для иванюкита — I-12 и I-24 (цифра обозначает продолжительность синтеза).
Для изучения сорбционных свойств синтезированных титаносиликатов проведена серия экспериментов по сорбции катионов Sr2+ и Cs+ из растворов нитратов с концентрацией 2 г/л на катион. Соотношение твердого сорбента к жидкой фазе для всех экспериментов составляло 1 : 250 (0.03 г материала : 7.5 мл раствора). Сорбция катионов проведена в области рН от 1.4 до 5.3 в статическом режиме с периодическим встряхиванием и температурой 23 ± 2 °С в течение 24 ч. Доведение растворов до нужного значения рН проводилось с помощью HNO3. По окончании сорбции материал отделяли от раствора с помощью центрифугирования при скорости 3000 об/мин в течение 5 мин и отбирали аликвоту раствора.
Расчет сорбционной емкости (СОЕ, мг/г) титано-силикатов проводили по следующей формуле:
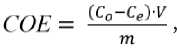
где Со и Се — начальная и равновесная концентрации ионов в растворе, мг/л; V — объем раствора, л; m — масса сорбента, г.
Методы исследования
Для синтеза титаносиликатов и сорбционных экспериментов были использованы реактивы производства ООО «Реахим», квалификации «х. ч.»: KOH, NaOH, Sr(NO3)2, CsNO3. Экспериментальная работа проведена на деионизированной воде с удельным сопротивлением 10 MΩ ⋅ cm. Химический состав исходного гидратированного осадка определяли с помощью рентгенофлуоресцентного спектрометра Clever A-17 (Элеран, Россия). Фазовый состав продуктов синтеза диагно-
Таблица 1. Мольное отношение компонентов для синтеза титаносиликатов
Table 1. Molar ratio of components for synthesis of titnaosilicates
|
Образец Sample |
Мольное отношение компонентов Molar ratio of components |
|||||
|
TiO 2 |
SiO 2 |
Na2O |
K2O |
F 2 O 3 |
H2O |
|
|
S-12 and S-24 |
1.0 |
1.2 |
6.07 |
0.95 |
0.07 |
700 |
|
I-12 and I-24 |
1.0 |
1.2 |
4.03 |
2.97 |
0.07 |
700 |

стирован с помощью порошковой рентгеновской дифракции на дифрактометре DX2700BH, Haoyuan (излучение CuK λ , 40кВ, 30 мА, в диапазоне от 2 до 60°). Оценка размера области когерентного рассеяния (ОКР) в полученных образцах осуществлена по ширине дифракционных линий на половине высоты с использованием формулы Селякова – Шеррера. Спектры комбинационного рассеяния получены на спектрометре с внешним источником возбуждения LabRAM HR Visible (Horiba, Jobin Yvon, мощность He-Ne-лазера 2 мВт, λ = = 632.8 нм). Спектры записывали при комнатной температуре, количество измерений на одном участке спектрального диапазона равно 3. Удельную площадь поверхности материала определяли методом низкотемпературной физической сорбции азота с помощью анализатора площади поверхности и размера пор NOVA 1200e, Quantachrome при температуре 196 °С с предварительной дегазацией при 110 °С в вакууме в течение 2 ч. Дзета-потенциал и pH изоэлектрической точки измеряли на приборе Zetasizer Nano ZS (Malvern Instruments Ltd). Измерения проведены на суспензиях, подготовленных диспергированием образца массой 0.3 г в деионизированной воде объемом 25 мл. Доведение рН суспензии до нужного значения осуществляли с помощью HNO3. После добавления кислоты суспензия размешивалась на магнитной мешалке до стабилизации рН, далее процесс перемешивания прекращали на 1 минуту. После оседания крупных частиц для измерения дзета-потенциала отбирали аликвоту суспензии объемом 750 мкл.
Элементный состав растворов до и после сорбции определен с помощью масс-спектрометра с индуктивно связанной плазмой Agilent 7700. Контроль рН растворов осуществлялся с применением анализатора жидкости «ЭКСПЕРТ-001», между измерениями электрод калибровался по дистиллированной воде и буферу с рН = 4.01. Химический состав титаносиликатов до и после сорбции анализировали с помощью сканирующего электронного микроскопа TESCAN VEGA 3 LMH с энергодисперсионной приставкой X-Max, Oxford Instruments при ускоряющем напряжении 20 кВ.
Результаты и обсуждение
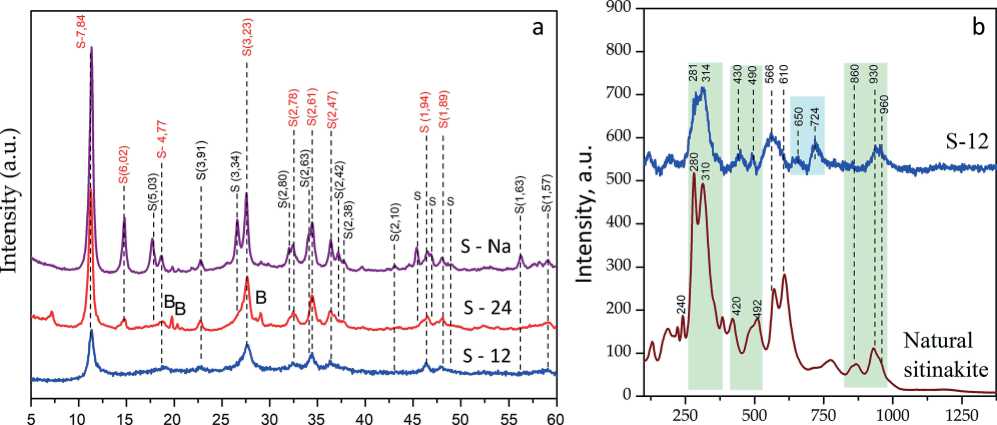
На рис. 1, а и 2, а представлены дифрактограммы продуктов синтеза, полученных при разных соотношениях NaOH и KOH. При добавлении 0.15 моль/л КОН происходит формирование титаносиликата со структурой ситинакита. Повышение концентрации КОН в составе минерализатора до 0.45 моль/л приводит к кристаллизации титаносиликата со структурой ива-нюкита. Ситинакит идентифицирован по серии рефлексов с межплоскостными расстояниями d/n (Å): 7.84, 6.02, 3.34, 3.23, 2.78, 1.94, 1.89, 1.63, 1.59, 1.57 (PDF Card No. 00-050-1689). Иванюкит диагностирован по серии рефлексов с межплоскостными расстояниями d/n (Å): 7.8, 5.5, 4.49 , 3.9, 3.18, 2.74, 2.6, 2.46, 2.38, 1.95, 1.89, 1.83, 1.74 (PDF Card 00-052-1204). При увеличении продолжительности синтеза с 12 до 24 ч происходит повышение кристалличности синтезируемых титаносилика-тов, что выражается в увеличении интенсивности основных рефлексов на дифрактограммах и размера кристаллитов, рассчитанных по формуле Селякова – Шеррера (табл. 2). Кроме того, в образцах S-24 и I-24 выявлена примесь титаносиликата со структурой виноградови-та. В образце ситинакита S-24 рефлексы виноградови-та выражены интенсивнее, что связано с докристал-лизацией аморфной компоненты, диагностируемой в образце S-12 методом КР-спектроскопии.
Как видно на рис. 1, а и 2, а, дифрактограммы слабокристалличных образцов довольно схожи, и диагностика структурного типа титаносиликата в них затруднена из-за совпадения положения основных рефлексов и слабой интенсивности некоторых характерных. В частности, рефлексы с межплоскостным расстоянием 3.34 и 3.23, характерные для ситинакита, полученного в 1 моль/л NaOH (образец № S-Na), при введении 0.15 моль/л KOH сливаются в один и не разделяются даже при увеличении времени синтеза (рис. 1, а). Такое изменение дифракционной картины может являться следствием встраивания катиона K+ в решетку сити-накита.
Для достоверной идентификации титаносилика-тов проведены спектроскопические исследования.
2Theta (degree) Raman shift, cm
Рис. 1. Дифракционные картины (а) и КР-спектры (б) ситинакита (В — виноградовит; S — ситинакит)
Fig. 1. XRD patterns (a) and Raman spectra (b) of titanosilicate with sitinakite structure (B –vinogradovite, S — sitinakite)
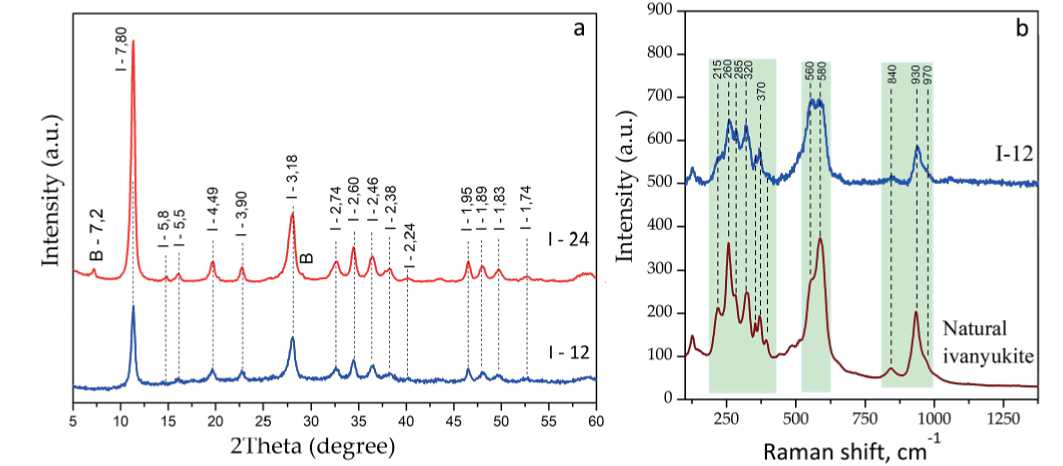
Рис. 2. Дифракционные картины (а) и КР-спектры (b) иванюкита (В — виноградовит; I — иванюкит)
Fig. 2. XRD patterns (a) and Raman spectra (b) of titanosilicate with sitinakite structure (B –vinogradovite, I — ivanyukite)
На рис. 1, b и 2, b представлены рамановские спектры слабокристалличных образцов титаносиликатов. Идентификация полос поглощения проведена по аналогии со структурно-родственными титаносиликата-ми (Kostov-Kytin, 2005; Ferdov, 2008; Celestian, 2013; Pakhomovsky, 2018; Yakovenchuk, 2019; Samburov, 2022).
На КР-спектрах титаносиликатов можно выделить следующие характеристические полосы:
-
1) интенсивные колебательные полосы при 930– 970 см–1, которые отнесены к асимметричным валентным колебаниям тетраэдров SiO4, а полосы при 840– 870 см–1 — к симметричным модам колебаний с участием тех же связей;
-
2) полосы в области 560 — 610 см–1, которые соответствуют асимметричным деформационным колебаниям связей Si-O или перекрывающимся валентными колебаниям и связей Ti-O;
-
3) полосы в диапазоне 440–510 см–1, которые относятся к валентным колебаниям связей Ti-O в TiO6-октаэдрах;
-
4) полосы в диапазоне 350–400 см–1, которые отнесены к симметричным деформационным колебаниям связей Si-O;
-
5) интенсивные полосы в области 200 и 340 см–1, которые соответствуют деформационным колебаниям связей Ti-O-Si и Ti-O-Ti (Ignatyev, 2007);
-
6) полосы в диапазоне до 200 см–1, которые относятся к трансляционным колебаниям решетки.
При общем сходстве характеристических полос синтезированные титаносиликаты хорошо различаются. Для ситинакита характерно наличие двух интенсивных полос с максимумами 280 и 308 см–1, 560, 610 см–1, а также полос 420, 490 см–1 связей Ti-O в TiO6-октаэдрах. Иванюкит характеризуется наличием интенсивных полос отражения при 215, 260, 285, 320, 370, 560, 580 см–1. Нужно также отметить, что для синтетического ситинакита наблюдается слияние полос 565 и 610 см–1 в единую широкую полосу с максимумом при 570 см–1. Такое уширение может объясняться наличием в синтезируемом материале аморфной компоненты, которая не выявляется методом рентгенофазового анализа. При этом на КР-спектрах аморфная фаза характеризуется полосой 650 см–1, соответствующей деформационным колебаниям связей Si-O и Si-OH, и полосой 724 см–1, обусловленной наличием октаэдров TiO6 в диоксиде титана и/или титанате натрия (Perovskiy, 2023).
Как было указано выше, в некоторых продуктах синтеза кроме основной фазы ситинакита и иванюки-та присутствует примесь виноградовита и рентгеноаморфной фазы. Они могут вносить вклад в текстурные и сорбционные характеристики синтезированных образцов.
В табл. 2 представлены текстурные характеристики синтезированных порошков. Видно, что увеличение кристалличности продуктов синтеза приводит к
Таблица 2. Текстурные характеристики титаносиликатов
Table 2. Textural characteristics of titanosilicates
|
Образец Sample |
Размер кристаллитов, нм Crystallite size, nm |
Удельная поверхность, м2/г Specific surface area (BET), m2/g |
Объем пор (BGH), см3/г Pore volume (BGH), cm3/g |
Объем микропор, м3/г Micropore volume, m3/g |
|
S-12 |
12 |
91.3 |
0.394 |
0.026 |
|
S-24 |
17 |
76.1 |
0.296 |
0.020 |
|
I-12 |
17 |
91.7 |
0.119 |
0.026 |
|
I-24 |
19 |
66.8 |
0.077 |
0.019 |
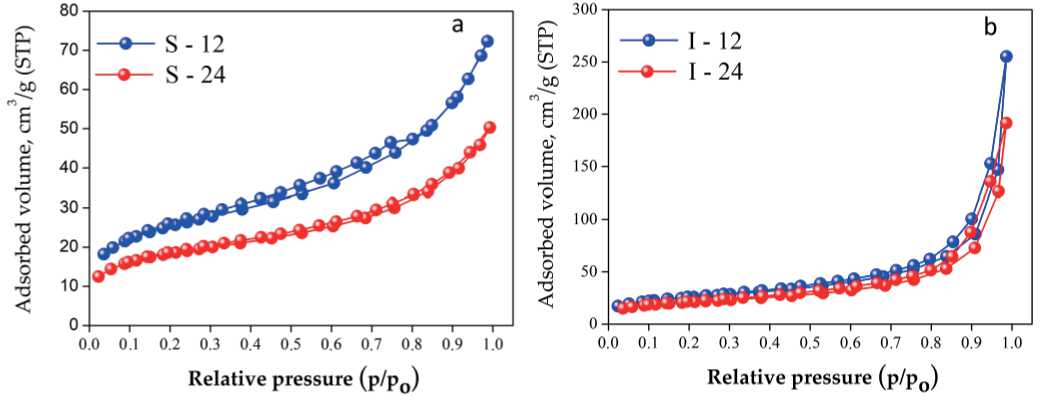
Рис. 3. Изотермы сорбции азота для образцов иванюкита (а) и ситинакита (b)
Fig. 3. Nitrogen sorption isotherms for ivanyukite (a) and sitinakite (b)
снижению удельной поверхности. Обращает на себя внимание форма изотерм, представленная на рис. 3. Все изотермы можно отнести к типу IVa, при этом формы петель гистерезиса различаются (Thommes, 2015). В образцах ситинакита S-12, S-24 форма петли гистерезиса близка к типу H3 (рис. 3, b), что свидетельствует о наличии щелевидных капилляров, образованных параллельными пластинами (частицами порошка). Этим можно объяснить высокие значения общего объема пор в ситинаките. В образцах I-12, I-24 форма петель гистерезиса соответствует типу Н4 (рис. 3, a).
Эффективность и механизм сорбционных процессов на титаносиликатах могут быть объяснены с точки зрения электрокинетических свойств дисперсной фазы. Как показано ранее (Perovskiy, 2021), синтетический ситинакит, полученный в чистой системе NаOH, является слабокислотным сорбентом, который может эффективно извлекать катионы из щелочных и слабокислых растворов. Для уточнения электрокинетиче-ских свойств образцов были получены зависимости их дзета-потенциала от рН растворов, которые представлены на рис. 4.
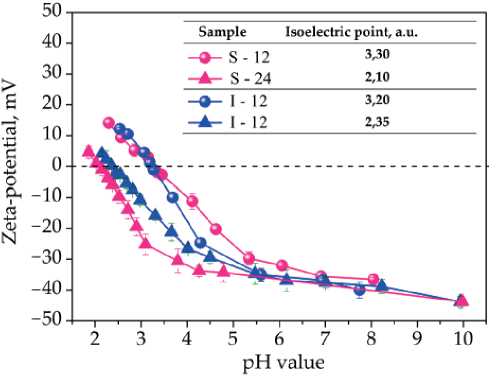
Рис. 4. Зависимость дзета-потенциала синтезированных титаносиликатов от рН
Fig. 4. Dependence of the zeta-potential ( ξ ) of titanosilicates on solution pH
Установлено, что при повышении кристалличности материала произошло смещение изоэлектрической точки в кислую область с рН от 3.3 до 2.1 для образца ситинакита и от 3.2 до 2.4 для иванюкита. Подобное смещение может объясняться ростом числа протонов (H+), связанных с группой Ti-O-H в структуре, механизм участия которой рассмотрен в работах (Clearfield, 2000; Perovskiy, 2021). Смещение изоэлектрической точки позволяет предположить, что титаносили-каты, синтезированные в течение 24 ч, будут эффективнее извлекать катионы в кислой среде, а также способствовать повышению сорбционной емкости всего материала.
На основании полученных данных дзета-потенциала подготовлена серия растворов, содержащих катионы Sr2+ и Cs+ со следующими значениями рН: 5.1, 2.8, 2.5, 1.4 для Sr; 5.3, 2.9, 2.4, 1.5 для Cs. Рассчитанные значения сорбционной емкости синтезированных тита-носиликтов представлены на рис. 5, 6. Нужно отметить, что сорбционные свойства продуктов синтеза, полученных в течение 24 ч, исследованы на смешанном материале без отделения примеси виноградовита.
Установлено, что при рН = 1.4 сорбционная емкость всех образцов титаносиликатов по Sr2+ составляет 0 мг/г (рис. 5). С изменением рН до 2.4 сорбционная емкость титаносиликатов возрастает, достигая значений 66–88 мг/г для иванюкита и 74–88 мг/г для си-тинакита. Максимальные значения сорбционной емкости образцов титаносиликатов выявлены при рН = = 5.1. В образцах ситинакита наблюдается следующая тенденция: материал, синтезированный в течение 24 ч, имеет меньшую СОЕ по сравнению с материалом, синтезированным в течение 12 ч. Максимальная СОЕ образца S-12 составляет 102 мг/г, образца S-24 — 95 мг/г. Вероятно, это происходит из-за более высокого содержания примесной фазы виноградовита в образце S-24. В образцах иванюкита видна противоположная тенденция — более кристалличные образцы имеют более высокую СОЕ по сравнению с менее кристалличными.
Интересный факт установлен для сорбции Cs+ на синтезированных титаносиликатах. Несмотря на положительные значения дзета-потенциала в области повышенной кислотности (рН = 1.5), сорбционная ем-
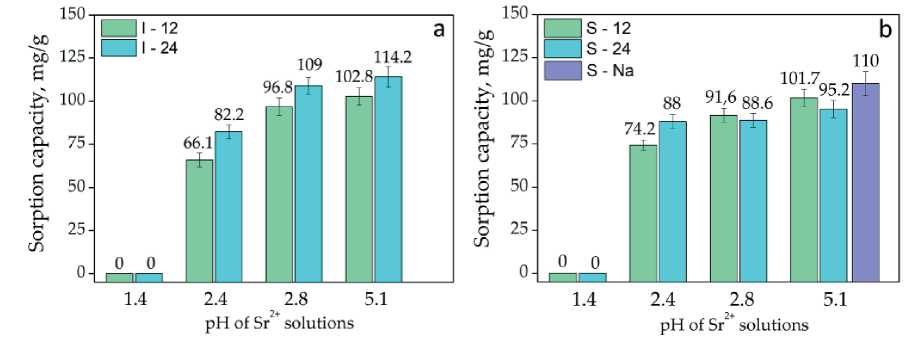
Рис. 5. Сорбционная емкость иванюкита (а) и ситинакита (b) по Sr в зависимости от кислотности исходного раствора
Fig. 5. Sorption capacity of ivanyukite (a) and sitinakite (b) for Sr depending on the acidity of the initial solution
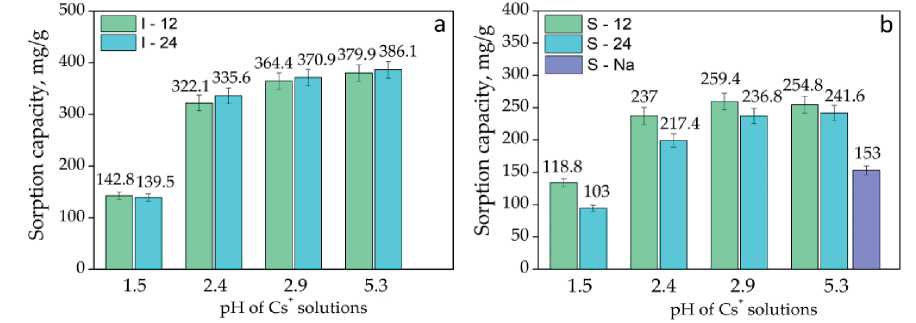
Рис. 6. Сорбционная емкость иванюкита (а) и ситинакита (b) по Cs в зависимости от кислотности исходного раствора
Fig. 6. Sorption capacity of ivanyukite (a) and sitinakite (b) for Cs depending on the acidity of the initial solution кость не равна 0 мг/г, как при сорбции Sr, а составляет примерно 1/3 от максимального значения: 139– 142 мг/г для иванюкита и 103–118 мг/г для ситинаки-та. При этом рН растворов после сорбции Cs снизился до 1.1 (табл. 5–6). Учитывая данный факт, можно предположить, что процесс сорбции на титаносиликатах является не только результатом ионного обмена, но и характеризуется специфической адсорбцией. При повышении кислотности растворов сорбционная емкость возрастает и достигает максимальных значений — 380– 386 мг/г для иванюкита и 241–254 мг для ситинакита при рН = 5.3.
Выбранный метод масс-спектрометрии с индуктивно связанной плазмой оказался не подходящим для количественного определения Na и K в растворах после сорбции. Связано это с высоким фоновым содержанием указанных элементов в деионизированной воде, на которой были подготовлены разбавленные растворы для определения Cs и Sr. Полуколи-чественное определение элементного состава образцов до и после сорбции было проведено с помощью элементного энергодисперсионного анализа порошков на сканирующем электронном микроскопе (табл. 3–6). Установлено, что в кислой среде катионы
Таблица 3. Элементный состав иванюкита до и после сорбции Sr Table 3. Elemental composition of ivanyukite before and after Sr sorption
|
Образец Sample |
pH растворов ∆ = ± 0.1 pH of solutions ∆ = ± 0.1 |
Атомный % ± ∆s Atomic % ± ∆s |
|||||||
|
перед before |
после after |
O |
Si |
Ti |
Fe |
Na |
K |
Sr |
|
|
– |
– |
61.1 ± 0.5 |
12.7 ± 0.9 |
14.6 ± 1.5 |
1.1 ± 0.2 |
6.1 ± 0.9 |
4.4 ± 0.4 |
- |
|
|
1.4 |
1.1 |
65.7 ± 0.6 |
13.6 ± 1.7 |
18.4 ± 1.9 |
1.3 ± 0.3 |
- |
1.2 ± 0.2 |
- |
|
|
I-12 |
2.4 |
5.9 |
64.1 ± 0.3 |
13.7 ± 0.7 |
15.7 ± 0.6 |
1.1 ± 0.2 |
0.5 ± 0.5 |
1.9 ± 0.2 |
3.1 ± 0.5 |
|
2.8 |
6.1 |
63.7 ± 0.2 |
12.6 ± 1.0 |
16.1 ± 1.1 |
1.1 ± 0.2 |
0.7 ± 0.3 |
1.9 ± 0.2 |
3.8 ± 0.4 |
|
|
5.1 |
6.3 |
63.7 ± 0.4 |
13.0 ± 0.5 |
15.6 ± 0.5 |
1.1 ± 0.2 |
0.7 ± 0.3 |
1.8 ± 0.2 |
4.1 ± 0.2 |
|
|
– |
– |
60.8 ± 0.7 |
12.1 ± 1.1 |
15.5 ± 1.3 |
1.0 ± 0.2 |
6.2 ± 0.8 |
4.8 ± 0.7 |
- |
|
|
1.4 |
1.1 |
65.6 ± 0.2 |
14.5 ± 1.2 |
17.5 ± 1.1 |
1.1 ± 0.2 |
- |
1.3 ± 0.2 |
- |
|
|
I-24 |
2.4 |
5.7 |
63.7 ± 0.3 |
13.7 ± 0.9 |
15.0 ± 1.7 |
0.9 ± 0.3 |
0.7 ± 0.2 |
2.0 ± 0.4 |
3.4 ± 0.5 |
|
2.8 |
6.4 |
63.5 ± 1.2 |
13.1 ± 2.0 |
16.4 ± 2.1 |
1.1 ± 0.5 |
0.8 ± 0.3 |
1.9 ± 0.2 |
4.1 ± 0.8 |
|
|
5.1 |
6.4 |
63.5 ± 0.4 |
13.1 ± 0.5 |
15.3 ± 0.8 |
0.9 ± 0.2 |
0.8 ± 0.2 |
2.0 ± 0.2 |
4.3 ± 0.5 |
|
Na и К из структуры титаносиликатов замещаются полностью. При этом рН растворов после сорбции не возрастает, а снижается с 1.4 до 1.1. Неполное замещение катионов Na на ситинаките объясняет пониженные показатели сорбционной емкости по Cs (табл. 6).
Синтетический ситинакит и иванюкит, полученные из отходов лейкоксенового концентрата, демонстрируют близкие, но высокие показатели сорбционной емкости по катиону Sr2+ (рис. 5). При этом в отношении ионов Cs+ показатели иванюкита выше более чем на 100 мг/г. Теоретически иванюкит-Na-T (KNa2Ti4(SiO4)3O4 ·7H2O) и ситинакит (KNa2Ti4(SiO4)2O5 (OH)·4H2O) обладают одинаковой ёмкостью в отношении к катионам при обменных реакциях (один атом К и два Na). Различия в реальных показателях могут быть связаны с деталями в кристаллическом строении.
Кристаллическая структура ситинакита (рис. 7, a, b) основана на кубаноподобных кластерах [Ti4O4]8+, образованных четырьмя октаэдрами TiO6 с общими гра-
Таблица 4. Элементный состав ситинакита до и после сорбции Sr
Table 4. Elemental composition of sitinakite before and after Sr sorption
|
Образец Sample |
pH растворов ∆ = ± 0.1 pH of solutions ∆ = ± 0.1 |
Атомный % ± ∆s Atomic % ± ∆s |
|||||||
|
перед before |
после after |
O |
Si |
Ti |
Fe |
Na |
K |
Sr |
|
|
– |
– |
61.7 ± 0.6 |
11.2 ± 0.8 |
16.7 ± 1.1 |
1.3 ± 0.3 |
6.5 ± 1.3 |
3.1 ± 0.2 |
- |
|
|
1.4 |
1.1 |
65.9 ± 0.7 |
12.9 ± 2.5 |
18.5 ± 2.3 |
1.4 ± 0.3 |
- |
0.7 ± 0.1 |
- |
|
|
S-12 |
2.4 |
6.3 |
64.0 ± 0.3 |
11.9 ± 0.3 |
17.3 ± 0.9 |
1.3 ± 0.1 |
1.0 ± 0.2 |
1.2 ± 0.2 |
3.3 ± 0.5 |
|
2.8 |
6.4 |
63.7 ± 0.4 |
12.5 ± 0.5 |
16.1 ± 0.5 |
1.2 ± 0.1 |
1.5 ± 0.2 |
1.1 ± 0.2 |
3.8 ± 0.2 |
|
|
5.1 |
6.3 |
63.6 ± 0.4 |
12.0 ± 1.0 |
16.6 ± 1.2 |
1.2 ± 0.1 |
1.5 ± 0.5 |
1.0 ± 0.1 |
4.3 ± 0.3 |
|
|
– |
– |
61.5 ± 0.7 |
10.9 ± 1.7 |
16.4 ± 1.2 |
1.0 ± 0.2 |
6.5 ± 1.7 |
2.8 ± 0.4 |
- |
|
|
1.4 |
1.1 |
65.3 ± 0.7 |
13.9 ± 2.1 |
17.7 ± 1.5 |
1.2 ± 0.5 |
0.6 ± 0.4 |
0.7 ± 0.3 |
- |
|
|
S-24 |
2.4 |
6.2 |
63.4 ± 0.7 |
13.4 ± 1.2 |
15.6 ± 1.8 |
1.4 ± 0.7 |
2.5 ± 1.1 |
1.0 ± 0.2 |
3.5 ± 0.8 |
|
2.8 |
6.3 |
63.4 ± 0.6 |
12.2 ± 0.9 |
15.9 ± 1.0 |
0.9 ± 0.3 |
2.2 ± 0.4 |
0.8 ± 0.3 |
3.9 ± 0.3 |
|
|
5.1 |
6.6 |
63.2 ± 0.9 |
12.5 ± 0.8 |
15.5 ± 0.9 |
0.9 ± 0.2 |
2.3 ± 0.3 |
0.8 ± 0.2 |
3.9 ± 0.5 |
|
Таблица 5. Элементный состав иванюкита до и после сорбции Cs Table 5. Elemental composition of ivanyukite before and after Cs sorption
|
Образец Sample |
pH растворов ∆ = ±0.1 pH of solutions ∆ = ±0.1 |
Атомный % ± ∆s Atomic % ± ∆s |
|||||||
|
перед before |
после after |
O |
Si |
Ti |
Fe |
Na |
K |
Cs |
|
|
– |
– |
61.1 ± 0.5 |
12.7 ± 0.9 |
14.6 ± 1.5 |
1.1 ± 0.2 |
6.1 ± 0.9 |
4.4 ± 0.4 |
- |
|
|
1.5 |
1.1 |
64.5 ± 0.3 |
13.3 ± 1.1 |
17.5 ± 1.8 |
1.2 ± 0.1 |
- |
- |
3.6 ± 0.3 |
|
|
I-12 |
2.4 |
5.9 |
62.0 ± 0.3 |
13.0 ± 1.4 |
15.3 ± 1.0 |
1.0 ± 0.2 |
- |
0.5 ± 0.1 |
8.1 ± 0.6 |
|
2.8 |
6.7 |
61.1 ± 0.4 |
12.3 ± 1.2 |
15.1 ± 1.1 |
1.1 ± 0.3 |
1.2 ± 0.3 |
0.6 ± 0.2 |
8.1 ± 0.5 |
|
|
5.3 |
7.2 |
61.0 ± 0.3 |
11.9 ± 1.6 |
15.3 ± 1.4 |
1.2 ± 0.2 |
1.4 ± 0.5 |
0.7 ± 0.2 |
9.1 ± 0.2 |
|
|
– |
– |
60.8 ± 0.7 |
12.1 ± 1.1 |
15.5 ± 1.3 |
1.0 ± 0.2 |
6.2 ± 0.8 |
4.8 ± 0.7 |
- |
|
|
1.5 |
1.1 |
64.5 ± 0.8 |
13.6 ± 1.2 |
17.2 ± 1.5 |
1.1 ± 0.2 |
- |
0.1 ± 0.1 |
3.5 ± 0.4 |
|
|
I-24 |
2.4 |
6.3 |
61.2 ± 0.6 |
12.3 ± 1.0 |
15.3 ± 1.0 |
1.0 ± 0.3 |
1.5 ± 0.7 |
0.7 ± 0.2 |
8.4 ± 0.5 |
|
2.8 |
7.3 |
60.8 ± 0.7 |
11.2 ± 1.3 |
15.9 ± 1.1 |
1.0 ± 0.1 |
0.8 ± 0.3 |
1.0 ± 0.1 |
9.5 ± 0.5 |
|
|
5.3 |
7.2 |
60.7 ± 0.4 |
12.4 ± 1.2 |
14.7 ± 1.0 |
0.9 ± 0.2 |
1.5 ± 0.4 |
1.0 ± .01 |
9.3 ± 0.4 |
|
Таблица 6. Элементный состав ситинакита до и после сорбции Cs Table 6. Elemental composition of sitinakite before and after Cs sorption
|
Образец Sample |
pH растворов ∆ = ± 0.1 pH of solutions ∆ = ± 0.1 |
Атомный % ± ∆s Atomic % ± ∆s |
|||||||
|
перед before |
после after |
O |
Si |
Ti |
Fe |
Na |
K |
Cs |
|
|
– |
– |
61.7 ± 0.6 |
11.2 ± |
16.7 ± 1.1 |
1.3 ± 0.3 |
6.3 ± 1.7 |
3.1 ± 0.4 |
– |
|
|
1.5 |
1.1 |
64.5 ± ± 0.7 |
12.6 ± 2.0 |
18.2 ± 1.7 |
1.3 ± 0.2 |
– |
– |
3.2 ± 0.7 |
|
|
S-12 |
2.4 |
5.8 |
62.0 ± 0.4 |
12.1 ± 0.7 |
16.2 ± 0.9 |
1.2 ± 0.2 |
1.6 ± 0.7 |
0.3 ± 0.1 |
6.4 ± 0.8 |
|
2.8 |
7.3 |
61.1 ± 0.5 |
12.4 ± 0.8 |
15.1 ± 0.8 |
1.1 ± 0.2 |
3.3 ± 1.0 |
0.4 ± 0.1 |
6.7 ± 0.6 |
|
|
5.3 |
7.2 |
60.9 ± 0.3 |
11.9 ± 0.7 |
15.3 ± 0.6 |
1.1 ± 0.3 |
3.6 ± 0.7 |
0.5 ± 0.2 |
6.5 ± 0.4 |
|
|
– |
– |
61.5 ± 0.7 |
10.9 ± 1.7 |
16.4 ± 1.2 |
1.0 ± 0.2 |
6.5 ± 1.7 |
2.7 ± 0.3 |
– |
|
|
1.5 |
1.1 |
64.4 ± 0.3 |
13.1 ± 1.6 |
17.7 ± 2.1 |
1.2 ± 0.3 |
0.9 ± 1.0 |
– |
2.8 ± 1.1 |
|
|
S-24 |
2.4 |
5.9 |
61.2 ± 0.3 |
13.0 ± 1.1 |
14.6 ± 0.9 |
0.8 ± 0.4 |
4.2 ± 1.2 |
0.2 ± 0.1 |
5.9 ± 0.3 |
|
2.8 |
7.4 |
60.9 ± 0.2 |
11.8 ± 0.6 |
15.5 ± 0.7 |
0.8 ± 0.3 |
4.0 ± 0.3 |
0.4 ± 0.2 |
6.2 ± 0.2 |
|
|
5.3 |
7.3 |
60.6 ± 0.3 |
10.4 ± 1.3 |
16.5 ± 1.3 |
1.2 ± 0.2 |
4.1 ± 0.7 |
0.7 ± 0.1 |
6.3 ± 0.7 |
|
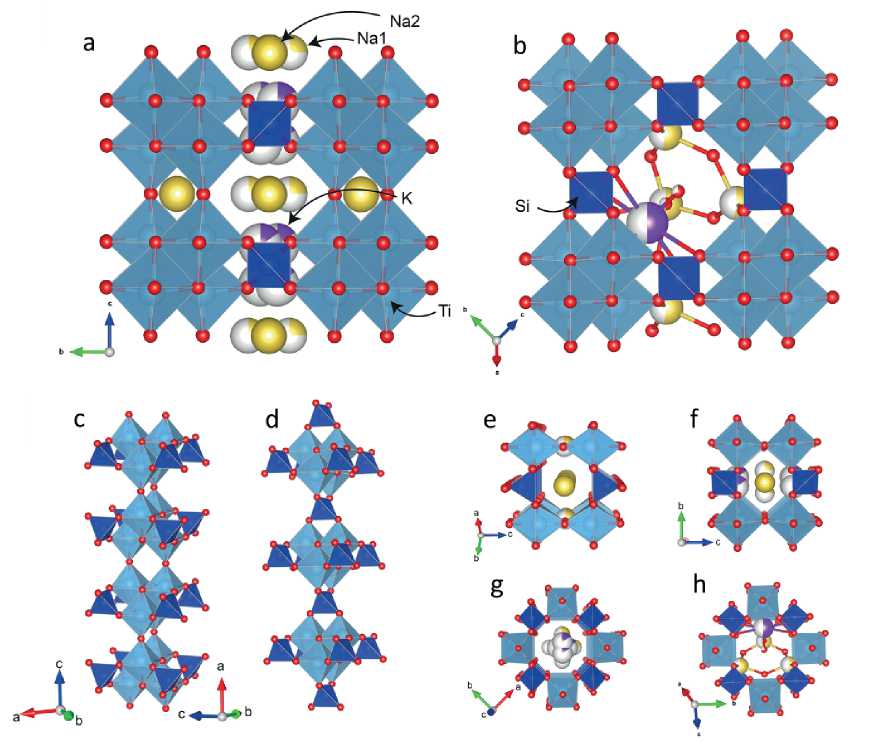
Рис. 7. Общая проекция кристаллических структур природных ситинакита (а) и иванюкита-Na- T (b), колонки [Ti4O4]8+∞ с прилегающими SiO4-тетраэдрами в ситинаките (c), соединение [Ti4O4]8+кластеров в кристаллической структуре иванюкита-Na- T (d), 8-членный канал I, (e), 6-членные каналы II (f) и III (g) в ситинаките, 8-членный канал в иванюките-Na- T (h)
Fig. 7. Projection of crystal structures of natural sitinakite (a) and ivanyukite-Na-T (b), [Ti4O4]8+∞ columns with adjacent SiO4 tetrahedra in sitinakite (c), connection of [Ti4O4]8+ clusters in the crystal structure of ivanyukite-Na-T (d), 8-membered channel I, (e), 6-membered channels II (f) and III (g) in sitinakite, 8-membered channel in ivanyukite-Na-T (h)
нями. Кластеры объединены через общие вершины в бесконечные колонны [Ti4O4]8+∞ вдоль [001] и соединяются в каркас через общие вершины с SiO4-тетра-эдрами вдоль направлений [100] и [010]. В минералах группы иванюкита, в отличие от ситинакита, кубано-подобные кластеры [Ti4O4]8+ связаны общими вершинами с тетраэдрами SiO4 вдоль направлений [001], [100] и [010] (рис. 7, b, d). Гетерополиэдрический каркас си-тинакита содержит трехмерную систему пересекающихся каналов, ориентированных вдоль основных кристаллографических направлений тетрагональной ячейки. Канал I (рис. 7, e) проходит вдоль направления [001] и характеризуется восьмиугольным сечением с эффективным диаметром (по номенклатуре ИЮПАК для не-изометричных каналов с эллиптическим сечением используются длины главной и малой осей минус сумма двух ионных радиусов кислорода 2.7 Å), равных 2.78 × × 3.50 Å2 (McCusker, 2023). Каналы II типа параллельны [100] и [010], тогда как каналы типа III параллельны [110] (рис. 7, f, g). Каналы II и III имеют гексагональное поперечное сечение и меньший эффективный диаметры — 2.16 × 3.31 Å2 и 1.31 × 3.31 Å2 соответственно. Эти каналы заполнены ионами Na+ и K+, а также молекулами H2O. Каналы в кристаллической структу- ре иванюкита (рис. 7, h) аналогичны каналам I в сити-наките и направлены вдоль всех главных направлений. При миграции Sr2+ c эффективным радиусом 1.32 Å не возникает никаких затруднений ни в ситинаки-те, ни в иванюките. При этом эффективный радиус Cs+ составляет 2.0 Å, что не позволяет ему мигрировать вдоль каналов III типа в ситинаките, в то время как возможность миграции по всем направлениям в ива-нюките сохраняется за счет одинаковых каналов по всем осям. Таким образом, часть каналов, пригодная для миграции Sr2+ в ситинаките, остается непригодной для миграции Cs+, чем, вероятно, и объясняется разница в сорбционной ёмкости ситинакита по к этому катиону.
Участие протонов в сорбционном процессе не так очевидно. Ранее нами было количественно установлено, что при сорбции на ситинаките происходит неэквивалентное замещение катионов. Такое же неэквивалентное замещение можно видеть при сравнении элементного состава титаносиликатов до и после сорбции. Отчетливо это прослеживается на образцах S-24 и I-24 после сорбции Cs при рН = 5.3, когда наблюдаются высокие СОЕ — 241 и 386 мг/г. В образце S-24, имеющем сорбционную емкость, приближающуюся к 27
максимальной (217 мг/г), при начальном рН раствора 2.4 содержание Na остается высоким — 4.2 % (табл. 6). В образце S-12 при таком же рН содержание Na составляет 1.6 %. Однако необходимо подчеркнуть, что на результаты элементного анализа в синтезированных образцах также может оказывать влияние примесь ви-ноградовита.
Заключение
Показано, что замена минерализатора с чистого NaOН на смесь КОН и NaOН в концентрации 0.15 и 1 моль/л соответственно позволяет получить К-Na-ситинакит. Повышение концентрации КОН до 0.45 моль/л и снижение NaOН до 0.7 моль/л приводит к кристаллизации титаносиликата со структурой иванюки-та. Увеличение времени синтеза с 12 до 24 ч способствует повышению кристалличности синтезируемых титаносиликатов, но также в продуктах синтеза происходит кристаллизация примеси в виде титаносили-ката со структурой виноградовита.
Синтезированные титаносиликаты показали высокую эффективность при извлечении катионов Sr и Сs из растворов нитратов. Сорбционная емкость по Sr для К-Na-ситинакита и иванюкита составила 100–110 и 102–114 мг/г соответственно. Частичная замена натрия на калий в структуре ситинакита приводит к повышению его сорбционной емкости по Cs со 150 до 240 мг/г. Титаносиликат со структурой иванюкита оказался наиболее эффективным при извлечении Cs из раствора, его сорбционная емкость составила 370– 380 мг/г и обусловлена особенностями его кристаллической структуры. Установлено, что даже в кислой среде, при рН ниже 2, титаносиликаты сохраняют свою сорбционную активность к катиону Cs. Данный факт позволяет утверждать о протекании сорбции на синтезированных титаносиликатах не только по ионообменному механизму, но и по механизму специфической сорбции.
Повышение кристалличности титаносиликатов при увеличении времени синтеза способствует смещению положения изоэлектрической точки материала в кислую область. При этом однозначно доказать, что данное смещение обусловлено ростом числа протонов, связанных с группой Ti-O-H в структуре тита-носиликатов, и показать их эффективность в кислых растворах пока не представляется возможным. Увеличение времени синтеза с 12 до 24 часов на данном этапе нецелесообразно, так как сорбционная емкость материала может снижаться в результате кристаллизации примесных фаз.
Работа выполнена при поддержке проекта РНФ № 22-77-00089, с использованием оборудования ЦКП «Гео наука».
Список литературы Влияние минерализатора и продолжительности синтеза на сорбционные свойства ситинакита и иванюкита
- Андреев А. А., Дьяченко А. Н., Крайденко Р. И. Фтороаммонийный способ переработки ильменита // Химическая промышленность сегодня. 2007. № 9. С.13–17.
- Andreev A. A., Dyachenko A. N., Kraidenko R. I. Fluoroammonium method for processing ilmenite. Chemical industry today, 2007, No. 9, pp. 13–17. (in Russian)
- Игнатьев В. Д., Бурцев И. Н. Лейкоксен Тимана: минералогия и проблемы технологии. СПб.: Наука, 1997. 213 с.
- Ignatiev V. D., Burtsev I. N. Timan leucoxene: mineralogy and problems of technology. St. Petersburg: Nauka, 1997, 213 p. (in Russian)
- Карелин В. А., Карелин А. И. Фторидная технология переработки концентратов редких металлов. Томск: Изд-во НТЛ, 2004. 221 с.
- Karelin V. A., Karelin A. I. Fluoride technology for processing rare metal concentrates. Tomsk: NTL Publishing House, 2004, 221 p. (in Russian)
- Конык О. А. Сернокислотное разложение продуктов обогащения лейкоксенового сырья // Науч. докл. Коми фил. АН СССР: Сер. препр. 1985. № 35. 29 с.
- Konyk O. A. Sulfuric acid decomposition of leucoxene raw material enrichment products. Preprint series, scientific reports of Komi Branch of USSR AS, 1985, No. 35, 29 p. (in Russian)
- Крысенко Д. Г., Эпов М. А., Медков Г. Ф. Комплексная переработка перовскитового концентрата по фторидной технологии // Вестник ДВО РАН. 2015. № 4. С. 113–117.
- Krysenko D. G. , Epov M. A., Medkov G. F. Complex processing of perovskite concentrate using fluoride technology. Bulletin of the Far Eastern Branch RAS, 2015, No. 4, pp. 113–117. (in Russian)
- Сысолятин С. А., Маркова A. A., Федорова М. Н. Обогащение лейкоксено-сидеритовых песчаников комбинированным флотационно-автоклавным методом // Комбинированные методы обогащения полезных ископаемых. М.: Изд-во АН СССР, 1969. С. 4–8.
- Sysolyatin S. A., Markova A. A., Fedorova M. N. Enrichment of leucoxene-siderite sandstones using a combined flotation- autoclave method. Combined methods of mineral processing. Moscow: Publishing House of USSR AS, 1969, pp. 4–8. (in Russian)
- Anisonyan K. G., Sadyhov G. B., Olyunina T. V., Goncharenko T. V., Leon L. I. Magnetizing roasting of leucoxene concentrate // Russian Metallurgy (Metally). 2011. 7, 656–659. doi:10.1134/s0036029511070020
- Celestian A. J., Powers M., Rader, S. In situ Raman spectroscopic study of transient polyhedral distortions during cesium ion exchange into sitinakite. American Mineralogist. 2013. 98(7), 1153–1161. doi:10.2138/am.2013.4349
- Clearfield A., Bortun L., Bortun A. Alkali metal ion exchange by the framework titanium silicate M2Ti2O3SiO4·nH2O (M=H, Na) // Reactive and Functional Polymers. 2000, 43(1-2), 85–95. doi:10.1016/s1381-5148(99)0000
- Demyanova L. P., Rimkevich V. S., Buynovskiy, A. S. Elaboration of nanometric amorphous silica from quartz-based minerals using the fluorination method // Journal of Fluorine Chemistry. 2011, 132(12), 1067–1071. doi:10.1016/j.jfluchem.2011.06.003
- Ferdov S., Lin Z., Sá Ferreira R. A., & Correia M. R. Hydrothermal synthesis, structural, and spectroscopic studies of vanadium substituted ETS-4 // Microporous and Mesoporous Materials. 2008, 110(2-3), 436–441. doi:10.1016/j.micromeso.2007.06.032
- Grass V., Istomin P., Nazarova L. X-ray diffraction refinement of the crystal structure of anosovite prepared from leucoxene // Crystal Research and Technology. 2009, 44 (1), 117–122. doi:10.1002/crat.200800213
- Ignatyev I. S., Montejo M., & López González J. J. Structure and Vibrational Spectra of Ti(IV) Hydroxides and Their Clusters with Expanded Titanium Coordination. DFT Study // The Journal of Physical Chemistry A. 2007, 111(32), 7973–7979. doi:10.1021/jp073423x
- Istomin P., Nadutkin A., Grass, V. Fabrication of Ti3SiC2-based composites from titania-silica raw material // Materials Chemistry and Physics. 2015, 162, 216–221. doi:10.1016/j.matchemphys.2015.05.060
- Istomin P. V., Belyaev I. M., Istomina E. I., Nadutkin A. V., Grass V. E. Fabrication and characterization of Ti3SiC2-TiB2-(TiC)-SiC composites through carbosilicothermic reduction of leucoxene concentrate // Ceramics International, Part A. 2022, 48 (19), 28480–28488. https://doi.org/10.1016/j.ceramint.2022.06.162.
- Kostov-Kytin V., Mihailova B., Kalvachev Y., Tarassov M. Atomic arrangements in amorphous sodium titanosilicate precursor powders // Microporous and Mesoporous Materials. 2005, 86(1-3), 223–230. doi:10.1016/j.micromeso.2005.07.024
- Thommes M., Kaneko K., Neimark A. V. et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report) // Pure Appl. Chem. 2015, 87 (9–10), 1051–1069. https://doi. org/10.1515/pac-2014-1117
- McCusker L. B., Liebau F., Engelhardt G. Nomenclature of structural and compositional characteristics of ordered microporous and mesoporous materials with inorganic hosts // Microporous and Mesoporous Materials. 2003, 58(1), 3–13. doi:10.1016/s1387-1811(02)00545-0
- Nikolaev A. A., Kirpichev D. E., Samokhin A. V., Nikolaev A. V. Thermo chemical plasma-Arc treatment of leucoxene concentrate // Inorganic Mater. 2017, 8, 406–411. https://doi.org/10.1134/S2075113317030182
- Pakhomovsky Y. A., Panikorovskii T. L., Yakovenchuk V. N., Ivanyuk G. Y., Mikhailova J. A., Krivovichev S. V., Kalashnikov A. O. Selivanovaite, NaTi3(Ti, Na, Fe, Mn)4[(Si2O7)2O4(OH, H2O)4] · nH2O, a new rock-forming mineral from the eudialyte-rich malignite of the Lovozero alkaline massif (Kola Peninsula, Russia) // European Journal of Mineralogy. 2018, 30(3), 525–535. doi:10.1127/ejm/2018/0030-2740
- Perovskiy I. А., Burtsev I. N., Ponaryadov A. V., Smorokov A. A. Ammonium fluoride roasting and water leaching of leucoxene concentrates to produce a high grade titanium dioxide resource (of the Yaregskoye deposit, Timan, Russia) // Hydrometallurgy. 2022. 210. P. 105858. https://doi.org/10.1016/j.hydromet.2022.105858
- Perovskiy I. A., Khramenkova E. V., Pidko E. A., Krivoshapkin P. V., Vinogradov A. V., Krivoshapkina E. F. Efficient extraction of multivalent cations from aqueous solutions into sitinakite- based sorbents // Chemical Engineering Journal. 2018, 354, 727–739. https://doi.org/10.1016/j.cej.2018.08.030
- Perovskiy I. A., Shushkov D. A., Ponaryadov A. V., Panikorov - skii T. L., Krivoshapkin P. V. Controlled reprocessing of leucoxene mconcentrate for environmental friendly production of titanosilicate — An effective sorbent for strontium and cesium ions // Journal of Environmental Chemical Engineering. 2023, 11(5), 110691. https://doi.org/10.1016/j.jece.2023.110691.
- Perovskiy I. A., Yanicheva N. Y., Stalyugin V. V., Panikorovskii T. L., Golov A. A. Sorption of multivalent cations on titanosilicate obtained from natural raw materials. The mechanism and thermodynamics of sorption // Microporous Mesoporous Mater. 2021, 311, 110716. https://doi.org/10.1016/j.micromeso.2020.110716.
- Sadykhov G. B., Zablotskaya Y. V., Anisonyan K. G., Olyunina T. V. Combined use of the leucoxene ores of the Yarega deposit with the formation of synthetic rutile and Wollastonite and the recovery of rare and rare-earth elements // Russ Metall. 2016, 11, 1005–1011. https://doi.org/10.1134/S0036029516110136
- Samburov G. O., Kalashnikova G. O., Panikorovskii T. L., Bocharov V. N., Kasikov A., Selivanova E., Bazai A. V., Bernadskaya D., Yakovenchuk V. N., Krivovichev S. V. A Synthetic Analog of the Mineral Ivanyukite: Sorption Behavior to Lead Cations // Crystals. 2022, 12, 311. https://doi.org/10.3390/cryst12030311
- Smorokov A., Kantaev A., Bryankin D., Miklashevich A., Kamarou M., Romanovski V. Low-temperature desiliconization of activated zircon concentrate by NH4HF2 solution // Minerals Engineering. 2022, 189, 107909. https://doi.org/10.1016/j.mineng.2022.107909.
- Yakovenchuk V., Pakhomovsky Y., Panikorovskii T., Zolotarev A., Mikhailova J., Bocharov V., Ivanyuk G. Chirvinskyite, (Na, Ca)13(Fe, Mn, □)2(Ti,Nb)2(Zr,Ti)3-(Si2O7)4(OH,O,F)12, a New Mineral with a Modular Wallpaper Structure, from the Khibiny Alkaline Massif (Kola Peninsula, Russia) // Minerals. 2019, 9(4), 219. doi:10.3390/min9040219
- Zabolotskaya Y. V., Sadykhov G. B., Goncharenko T. V., Olyunina T. V., Anisonyan K. G., Tagirov R. K. Pressure leaching of leucoxene concentrate using Ca(OH)2 // Russian Metallurgy (Metally). 2011, 11, 1030–1034. doi:10.1134/s0036029511110115
- Zanaveskin K. L., Meshalkin V. P. Chlorination of Quartz-Leucoxene Concentrate of Yarega Field // Metallurgical and Materials Transactions B. 2020, 51(2), 906–915. DOI: 10.1007/s11663-020-01810-2


