Влияние многостенных углеродных нанотрубок на биопленкообразование Escherichia coli
Автор: Максимова Ю.Г., Быкова Я.Е.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2021 года.
Бесплатный доступ
Исследовано влияние очищенных и неочищенных многостенных углеродных нанотрубок на процесс биопленкообразования штаммов Escherichia coli, выделенных из разных источников. Показано, что углеродные наноматериалы в среде культивирования не ингибируют биопленкообразование, а на 1-3 сут. роста приводят к формированию более массивных биопленок некоторых штаммов. Отмечено достоверно более интенсивное разрушение зрелых биопленок E. coli К12, E. сoli K12 TG1 (pXen7) и одного природного штамма в присутствии углеродных нанотрубок в среде. Не обнаружено четкой зависимости биопленкообразования и разрушения сформированных биопленок от степени очистки нанотрубок.
Биопленки, многостенные углеродные нанотрубки, escherichia coli
Короткий адрес: https://sciup.org/147235452
IDR: 147235452 | УДК: 579.22 | DOI: 10.17072/1994-9952-2021-2-87-92
Текст научной статьи Влияние многостенных углеродных нанотрубок на биопленкообразование Escherichia coli
Углеродные нанотрубки являются аллотропной модификацией углерода и представляют собой полые цилиндрические структуры из одной или нескольких плоскостей графена. Интерес к углеродным наноматериалам связан с их уникальными физико-химическими свойствами: высокой электро- и теплопроводностью, механической прочностью, необычными магнитными свойствами, значительной удельной поверхностью [Aqel et al., 2012].
Данные структуры стали широко применяться в различных отраслях промышленности относительно недавно, при этом возник закономерный вопрос об их цитотоксичности. Ряд работ посвящен влиянию углеродных нанотрубок на бактерии, и в качестве модельного организма в большинстве иссле- дований была выбрана Escherichia coli. Полученные результаты были неоднозначными и сильно зависели от характеристик нанотрубок, их концентрации и среды, в которой происходило взаимодействие. Так, было показано бактерицидное действие одностенных углеродных нанотрубок (ОУНТ) по отношению к E. coli K12, связанное с нарушением клеточной мембраны в результате прямого контакта с нанотрубками [Kang et al., 2007], а также изменение экспрессии стресс-зависимых генов [Kang et al., 2008]. Бактерицидное действие ОУНТ было показано и в других работах [Liu et al., 2010; Yang, 2010; Jackson et al., 2013]. В свою очередь, многостенные углеродные нанотрубки (МУНТ) были менее токсичны для бактерий [Kang et al., 2007; Jackson et al., 2013; Chi et al., 2016; Maas, 2016].
Однако в естественных условиях бактерии преимущественно существуют в виде биопленок, поэтому имеет смысл изучать воздействие различных факторов и веществ, в том числе и наноматериалов, не на планктонные клетки, а на биопленки. Известно, что в биопленке клетки менее чувствительны к действию углеродных нанотрубок, в основном за счет защитного действия полимерного матрикса [Rodrigues, Elimelech, 2010]. В ряде работ было показано, что антимикробные свойства нанотрубок предотвращают адгезию и биопленко-образование на таких поверхностях [Sun, Zhang, 2016; Teixeira-Santos et al., 2021], однако мертвые клетки могут экранировать токсический эффект нанотрубок, обеспечивая возможность дальнейшего формирования биопленки [Upadhyayula, Gad-hamshetty, 2010].
На биопленкообразование влияет введение углеродных нанотрубок в состав композиционных материалов. Так, например, было показано, что введение МУНТ в состав материала эндопротеза, с одновременной пропиткой материала антибиотиком рифампицином, эффективно против образования биопленки Staphylococcus epidermidis [Hirschfeld et al., 2017]. Анионный краситель, конъюгированный с МУНТ, повышал активность фоторазрушения биопленок E. coli [Anju et al., 2018] . Тем не менее, значимо не только влияние углеродных нанотрубок в составе композиционных материалов на биопленкообразование микроорганизмов, но и воздействие на этот процесс углеродных наноматериалов, диспергированных в среде.
Вопрос о влиянии углеродных нанотрубок на бактерии остается не до конца изученным, а полученные данные противоречивыми, что делает актуальным его дальнейшее изучение. В связи с этим, целью данной работы явилась оценка био-пленкообразования E. coli в ответ на присутствие многостенных углеродных нанотрубок в среде культивирования и разрушения биопленки под воздействием этих наноматериалов.
Материалы и методы исследования
Объекты исследования и условия культивирования . Объектами исследования явились штаммы кишечной палочки E. coli K12 АТСС, E. сoli K12 TG1 (pXen7), E. сoli, выделенные из разных источников [Гизатуллина и др., 2020]: кишечного тракта куриц (условно назван П), свиней (С), кроликов (К). Штаммы культивировали на жидкой среде LB (25 г/л, Sigma-Aldrich, США). Многостенные углеродные нанотрубки, очищенные (оМУНТ) и неочищенные (нМУНТ), добавляли в среду LB до конечной концентрации 200 мг/л.
МУНТ синтезировали в Уральском научноисследовательском институте композиционных ма- териалов (г. Пермь, Россия) осаждением из природного газа на катализаторе, содержащем оксиды магния, никеля, кобальта и частицы металлического сплава никеля и кобальта. Неочищенные МУНТ содержали 83.0% С, 16.6% MgO, 0,3% Со, 0.1% Ni, очищенные – 99.3% С и менее 0.1% примесей Co и Ni. МУНТ обладали следующими характеристиками: внешний диаметр 5–35 нм, внутренний диаметр 3–14 нм, длина не менее 2 мкм, удельная поверхность не менее 400 м2/г [Никулин, Руденко, 2011; Максимова и др., 2017].
Биопленки получали в полистерольном плоскодонном 96-луночном планшете (OAO "Фирма Медполимер", Россия). В лунки планшета вносили по 200 мкл среды LB с оМУНТ и нМУНТ и инокулировали 5 мкл суспензии бактерий (ОП 540 =0.5). В качестве контроля инокулировали среду LB без нанотрубок. Инкубировали 1–7 сут. в термостате при 30ºС.
Для изучения влияния МУНТ на зрелые биопленки после 7 сут. выращивания на среде LB биопленку отмывали 2 раза калий-фосфатным буфером (рН 7.2), в лунки вносили по 200 мкл 0.9%-ного раствора NaCI с оМУНТ или нМУНТ (200 мг/л) и на сутки помещали в термостат при 30ºС. В качестве контроля вносили 200 мкл 0.9%-ного раствора NaCI без нанотрубок.
Определение массивности биопленки . Из планшетов с биопленками удаляли питательную среду и планктонные клетки декантацией, отмывали биопленку 200 мкл калий-фосфатного буфера (рН 7.2) дважды. Биопленку окрашивали 0.1%-ным кристаллическим фиолетовым в течение 40 мин. в темноте, удаляли краситель, отмывали окрашенную биопленку 1 раз калий-фосфатным буфером и эстрагировали краситель 96%-ным спиртом (200 мкл) 20 мин. Биопленкообразование оценивали по оптической плотности раствора красителя при 540 нм на планшетном ридере Infinite M200 pro («TECAN», Швейцария).
Определение общего содержания АТФ в биопленках и интенсивности свечения E. сoli K12 TG1 (pXen7) . Для оценки энергетического статуса клеток к биопленкам добавляли 150 мкл диметилсульфоксида (ДМСО) и экстрагировали АТФ в течение 15 мин. на льду. Концентрацию АТФ определяли, используя стандартный набор реактивов (ATP Bioluminescent Assay Kit, Sigma). Пробы разводили в 10 раз деионизированной водой, смешивали 100 мкл образца с 100 мкл реагента, содержащего люциферин и люциферазу светляков. Интенсивность свечения измеряли на планшетном ридере Infinite M1000 pro («TECAN», Швейцария). Количество АТФ пересчитывали по калибровочной кривой.
Уровень свечения биопленок E. сoli K12 TG1 (pXen7) определяли на планшетном ридере Infinite M1000 pro («TECAN», Швейцария) и выражали в усл. ед. свечения.
Результаты и их обсуждение
Изучено влияние очищенных и неочищенных многостенных углеродных нанотрубок на биоплен-кообразование E. coli K12 и штаммов кишечной
Статистическую обработку проводили с ис- палочки, выделенных из различных экологических пользованием t-критерия Стьюдента, различия ниш (кишечного тракта куриц, свиней, птиц, кро-считали значимыми при p < 0.05. ликов). Показано, что наноматериалы по-разному влияли на общую массивность биопленки в зависимости от штамма и возраста биопленки (рис. 1).
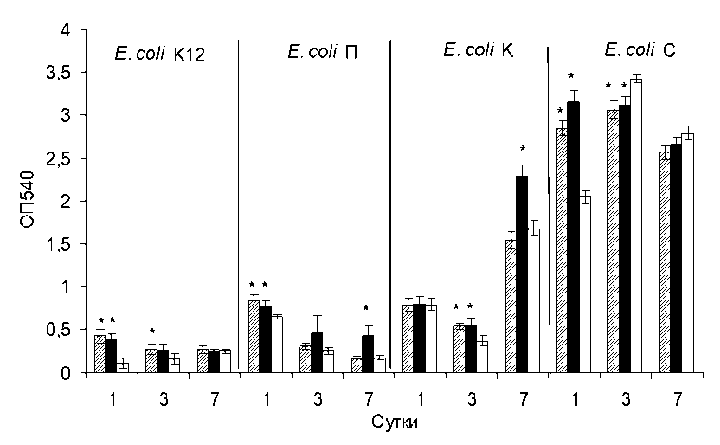
Рис. 1. Влияние оМУНТ (столбцы со штриховкой) и нМУНТ (черные столбцы) на формирование биопленок E. coli на 1; 3- и 7-е сут. роста. Контроль – рост биопленок на среде LB (белые столбцы). (*p < 0.05)
Показано, что в первые сутки роста углеродные нанотрубки разной степени очистки приводят к повышенному биопленкообразованию штаммов E. coli K12, П, С и на третьи сутки – E. coli К. К седьмым суткам роста разница в биопленкообра-зовании незаметна, за исключением штаммов E. coli П и К, к усиленному образованию биопленок которых приводит только нМУНТ. Разница в био-пленкообразовании может быть связана с различной гидрофобностью поверхности клеток, которая меняется в процессе старения культуры [Евтюгин и др., 2009], в скорости роста данного штамма, а следовательно, и в различных скоростях образования биопленки. Гидрофобные МУНТ образуют агрегаты с клетками, ускоряя преципитацию и увеличивая адгезию к поверхности. Формирование более массивной биопленки может быть вызвано как следствием адаптивной реакции бактерий, так и более интенсивной агрегацией клеток в присутствии нанотрубок.
Чтобы сделать заключение, на какой компонент биопленок воздействуют МУНТ, оценили содержание жизнеспособных клеток в биопленке. Так как метод подсчета КОЕ недостаточно точен для биопленок в связи со сложностью разрушения клеточных агрегатов, определили общее содержание
АТФ в клетках биопленки (табл. 1). Известно, что концентрация АТФ отражает количество жизнеспособных клеток [Ефременко и др., 2005] и в то же время свидетельствует о физиологическом состоянии клетки. В целом, из-за того, что в биопленке часть клеток находится в гипометаболиче-ском состоянии, общее содержание АТФ будет ниже, чем в аналогичном количестве планктонных клеток.
Таблица 1
Содержание АТФ в биопленках, нмоль/лунку
|
Штамм |
оМУНТ |
нМУНТ |
Контроль |
|
E. coli К12 |
0.005±0.001 |
0.007±0.003 |
0.005±0.001 |
|
E. coli П |
0.049±0.006* |
0.014±0.001 |
0.012±0.001 |
|
E. coli К |
0.040±0.005* |
0.052±0.012* |
0.016±0.002 |
|
E. coli С |
0.086±0.009 |
0.127±0.021* |
0.080±0.010 |
Примечание. *p < 0.05.
В биопленках E. coli K12 к седьмым суткам культивирования не было обнаружено достоверного отличия от контроля в содержании АТФ при формировании биопленки в присутствии углеродных наноматериалов. Для биопленок кишечной палочки, выделенной из природных источников, было отмечено достоверное отличие в содержании АТФ, однако полной корреляции с данными, от- ражающими общее биопленкообразование, обнаружено не было. Так как клетки в биопленке погружены в полимерный матрикс, ее общая массив- ность может зависеть не только от количества клеток, но и от интенсивности выработки внеклеточ- ных полисахаридов.
Изучено разрушение зрелых биопленок E. coli под действием МУНТ. После инкубации биопленок в физиологическом растворе в течение суток была определена общая массивность биопленок по методу, основанному на их окраске кристаллическим фиолетовым. Показано достоверно большее разрушение биопленок E. coli К12 и E. coli К под воздействием оМУНТ по сравнению с контролем
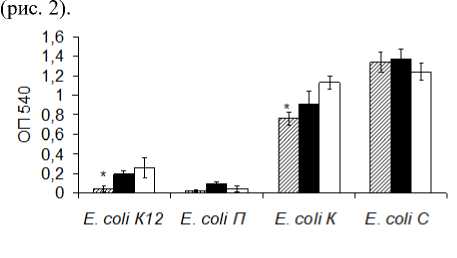
Рис. 2. Разрушение биопленок E. coli под воздействием оМУНТ (столбцы со штриховкой), нМУНТ (черные столбцы) по сравнению с контролем (белые столбцы). (*p < 0.05)
Оценили влияние МУНТ на свечение биопленок люминесцентного штамма E. сoli K12 TG1 (pXen7). Свечение биопленок, выращенных в присутствии МУНТ, не отличалось от контроля, тогда как свечение зрелых биопленок, инкубированных в физиологическом растворе с МУНТ в течение суток, было достоверно ниже контроля (табл. 2).
Таблица 2
Влияние МУНТ, добавленных в среду культивирования, на уровень биолюминесценции биопленок E. coli K12 TG1 (pXen7), усл. ед.
свечения
|
оМУНТ |
нМУНТ |
контроль |
|
|
1 |
37890±3727 |
45100±2864 |
36779±2404 |
|
2 |
1636±104* |
1173±56* |
2391±127 |
Примечание. 1 – воздействие МУНТ на рост биопленок в течение 7 сут., 2 – воздействие МУНТ на зрелые биопленки в течение суток, *(p < 0.05).
Следовательно, как очищенные, так и неочищенные МУНТ в среде вызывали более интенсивное разрушение биопленки. Известно, что люминесцентные бактерии являются тест-объектами для оценки биотоксичности углеродных наноматериалов [Дерябин, Алешина, Ефремова, 2012], и методом, основанным на принципе гашения люминесценции E. сoli K12 TG1, была показана токсичность одностенных углеродных нанотрубок [Зарубина и др., 2009]. МУНТ оказывают менее выра- женное бактерицидное действие, чем одностенные нанотрубки, что было показано в нашем исследовании и согласуется с литературными данными [Kang et al., 2007; Jackson et al., 2013; Chi et al., 2016; Maas, 2016].
Заключение
Таким образом, влияние многостенных углеродных нанотрубок на E. сoli штаммоспецифично. Не обнаружено четкой зависимости биопленкооб-разования и разрушения сформированных биопленок от степени очистки нанотрубок. Однако можно заключить, что в процессе роста культуры и формирования биопленки наноматериалы этого типа не оказывают отрицательного воздействия на жизнеспособность, и некоторые изученные штаммы формируют более массивную биопленку, чем в среде без нанотрубок. Присутствие углеродных нанотрубок в среде вызывает более интенсивное разрушение биопленок люминесцентного штамма E. сoli K12 TG1 (pXen7) и штаммов E. сoli K12 и E. сoli K. Данный тип углеродных наноматериалов не оказывает антибактериального действия на кишечную палочку и приводит к более интенсивному биопленкообразованию ряда штаммов E. сoli, выделенных из различных источников.
Авторы благодарят д-ра мед. наук М.В. Кузнецову и аспиранта Ю.С. Гизатуллину за предоставленные природные штаммы E. сoli и канд. биол. наук И.Л. Масленникову за предоставленный штамм E. сoli K12 TG1 (pXen7).
Исследование выполнено при финансовой поддержке РФФИ и Пермского края в рамках научного проекта № 20-44-596002.
Список литературы Влияние многостенных углеродных нанотрубок на биопленкообразование Escherichia coli
- Гизатуллина Ю. С. и др. Биологическая характеристика штаммов Escherichia coli, изолированных от сельскохозяйственных животных // Симбиоз-Россия 2020: сб. статей XII Всерос. конгресса молодых ученых-биологов с международным участием. Пермь, 2020. С. 78-82.
- Дерябин Д.Г., Алешина Е.С., Ефремова Л.В. Применение теста бактериальной биолюминесценции для оценки биотоксичности углеродных наноматериалов // Микробиология. 2012. Т. 81, № 4. С. 532-538.
- Евтюгин В.Г. и др. Сорбция микроорганизмов крупнопористыми агарозными криогелями, содержащими привитые алифатические цепи различной длины // Микробиология. 2009. Т. 78, № 5. С. 667-673.
- Ефременко Е.Н. и др. Определение биолюминесцентным методом минимальных ингибирующих концентраций веществ по отношению к бактериям, участвующим в биокоррозии // Прикладная биохимия и микробиология. 2005. Т. 41, № 4. С. 429-434.
- Зарубина А.П. и др. Биотестирование биологических эффектов одностенных углеродных нано-трубок с использованием тест-системы люминесцентных бактерий // Российские нанотехно-логии. 2009. Т. 4, № 11-12. С. 152-155.
- Максимова Ю.Г. и др. Гетерогенный биокатализатор на основе клеток нитрилгидролизующих бактерий и многослойных углеродных нанотру-бок для трансформации нитрилов и амидов // Прикладная биохимия и микробиология. 2017. Т. 53, № 5. С. 462-469.
- Никулин С.М., Руденко Д.А. Синтез многослойных углеродных нанотрубок и их применение в производстве композиционных материалов // Перспективные материалы. 2011. № 11. С. 54-62.
- Anju V.T. et al. Antimicrobial photodynamic activity of rose bengal conjugated multi walled carbon nanotubes against planktonic cells and biofilm of Escherichia coli // Photodiagnosis and Photodynamic Therapy. 2018. Vol. 24. P. 300-310.
- Aqel A. et al. Carbon nanotubes, science and technology part (I) structure, synthesis and characterisation // Arabian J. Chem. 2012. Vol. 5 (1). P. 1-23.
- Chi M.-F. et al. Inactivation of Escherichia coli planktonic cells by multi-walled carbon nanotubes in suspensions: Effect of surface functionalization coupled with medium nutrition level // J. Hazard. Mater. 2016. Vol. 318. P. 507-514.
- Jackson P. et al. Bioaccumulation and ecotoxicity of carbon nanotubes // Chem. Cent. J. 2013. 7 : 154. 21 p. DOI: 10.1186/1752-153X-7-154.
- Hirschfeld J. et al. Long-term release of antibiotics by carbon nanotube-coated titanium alloy surfaces diminish biofilm formation by Staphylococcus ep-idermidis // Nanomedicine: Nanotechnology, Biology and Medicine. 2017. Vol. 13 (4). P. 15871593.
- Kang S. et al. Single-walled carbon nanotubes exhibit strong antimicrobial activity // Langmuir. 2007. Vol. 23. P. 8670-8673.
- Kang S. et al. Antibacterial effects of carbon nanotubes: size does matter! // Langmuir. 2008. Vol. 24, № 13. P. 6409-6413.
- Liu S. et al. Antibacterial action of dispersed singlewalled carbon nanotubes on Escherichia coli and Bacillus subtilis investigated by atomic force microscopy // Nanoscale. 2010. Vol. 2. P. 27442750.
- Maas M. Carbon nanomaterials as antibacterial colloids // Materials. 2016. Vol. 9(8) : 617.
- Rodrigues D.F., Elimelech M. Toxic effects of singlewalled carbon nanotubes in the development of E. coli biofilm // Environ. Sci. Technol. 2010. Vol. 44. P. 4583-4589.
- Sun Y., Zhang Z. New anti-biofouling carbon nano-tubes-filled polydimethylsiloxane composites against colonization by pioneer eukaryotic microbes // Int. Biodeterior. Biodegrad. 2016. Vol. 110. P. 147-154.
- Teixeira-Santos R. et al. Antimicrobial and anti-adhesive properties of carbon nanotube-based surfaces for medical applications: a systematic review // iScience. 2021. Vol. 24. 102001.
- Upadhyayula V.K.K., Gadhamshetty V. Appreciating the role of carbon nanotube composites in preventing biofouling and promoting biofilms on material surfaces in environmental engineering: A review // Biotechnol. Adv. 2010. Vol. 28. P. 802-816.
- Yang C. et al. Antimicrobial activity of single-walled carbon nanotubes: length effect // Langmuir. 2010. Vol. 26, № 20. P. 16013-16019.


