Влияние N-адамантоил-α-аминокислот и N-(пиридин- 4-ил)- 3-(1-адамантанкарбоксамидо-этил)индола на индуцированную агрегацию тромбоцитов
Автор: Ермохин В.А., Кленова Н.А., Зарубин Ю.П., Ширмаер Е.Ф., Пурыгин П.П.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Коррекция экологического неблагополучия. Продукты питания
Статья в выпуске: 1-8 т.12, 2010 года.
Бесплатный доступ
Резюме: N-(1-адамантоил)-D,L-гистидин уменьшает агрегацию тромбоцитов, индуцируемую серотонином на 41%. 3-(1-Адамантанкарбоксамидоэтил)индол усиливает серотонин-индуцированную агрегацию на 26%.
Агрегация тромбоцитов, серотонин
Короткий адрес: https://sciup.org/148205486
IDR: 148205486 | УДК: 547.583,
Текст научной статьи Влияние N-адамантоил-α-аминокислот и N-(пиридин- 4-ил)- 3-(1-адамантанкарбоксамидо-этил)индола на индуцированную агрегацию тромбоцитов
Производные аминокислот, в частности N -ацил- α -аминокислоты, вызывают постоянный интерес благодаря своему исключительно широкому спектру действия и чрезвычайно важной роли в жизнедеятельности клетки. Наличие в молекуле ацильного фрагмента придает этим соединениям гидрофобные свойства и позволяет проявлять поверхностно-активные и седативные свойства. Для лечения болезни Паркинсона известен лекарственный препарат допамантин N -(1-адамантилкарбонил)-3,4-ди-гидро-ксифенилэтиламин [1]. Химия и сведения по фармакологической активности N -адамантоилированных пептидов изложены лишь в нескольких публикациях [2-4]. Ранее было показано, что объемный адамантильный заместитель оказывается необходимым для увеличения сродства соединений к 5-HT 2 -рецепторам тромбоцитов [5, 6]. В данной статье изучено влияние двух N -адамантоил- α -аминокислот и производного триптамина на индуцированную серотонином агрегацию тромбоцитов.
Экспериментальная химическая часть. В качестве объектов для N-адаман-тоилирования были выбраны две аминокислоты — D,L-гистидин 2а и D,L-триптофан 2б, которые декарбоксилируются в организме до
Кленова Наталья Анатольевна, доктор биологических наук, профессор кафедры биологической химии Зарубин Юрий Павлович, кандидат химических наук, старший преподаватель кафедры органической, био-органической и медицинской химии
Ширмаер Екатерина Федоровна, студентка Пурыгин Петр Петрович, доктор химических наук, профессор, заведующий кафедрой органической, био-органической и медицинской химии биогенных аминов, и один биогенный амин – 2-(3´-индолил)этиламин (триптамин) для исследования действия на серотониновые рецепторы тромбоцитов. Известно два основных способа синтеза N-ациламинокислот — ацилирование аминокислот либо ацилирование их эфиров [7, 8]. Ацилирование аминокислот хло-рангидридами – один из наиболее распространенных методов для получения N-ациламинокислот. Он был положен в основу промышленного производства целой серии продуктов, например «медиаланов» — производных саркозина. Существуют различные модификации этого метода. Реакцию проводят в водных растворах, водно-органических смесях, содержащих 30-50% инертного водорастворимого органического растворителя и в системах двух несмешивающихся растворителей, одним из которых является вода. Следует отметить, что в последнем случае, например в системе вода–толуол, выход целевого продукта значительно снижается [7].
При исследовании кинетики ацилирования α -аминокислот бензоилхлоридом в водных растворах показано [8], что аминогруппа изучаемых аминокислот обладает высокой реакционной способностью, которая определяется формой ее существования в растворе. Наиболее реакционноспособными являются формы, имеющие свободные аминогруппы H 2 NCHRCOO– (A) и H 2 NCH(R)COOH (B), при этом активность формы A выше. В воде реакции протекают медленно, в связи с чем увеличивается вероятность гидролиза амидной связи, особенно при нагревании.
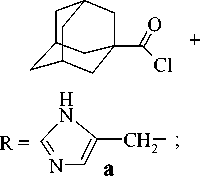
Ацилирование D,L-триптофана осуществляли 1-адамантоилхлоридом в присутствии триэтиламина при нагревании в течение 17 ч в среде абсолютного толуола. Выход составил
37%. Нами установлено, что выход целевого продукта увеличивается при проведении реакции в водно-диоксановой среде. При адаман-тоилировании D,L-гистидина и D,L-трипто-фана в присутствии гидроксида натрия в среде диоксан/вода (1:1) найдено, что для повышения степени чистоты получаемого продукта необходимо соблюдение ряда условий (рН=10, температура не выше 25 C, интенсивное перемешивание в процессе добавления 1-адамантоилхлорида). Для выделения чистых веществ реакционную массу упаривают, экстрагируют спиртом, отгоняют растворитель и осадок очищают флаш-хроматографией.
NH 2
R CH COOH
1а,б
NaOH диоксан ; H2O
R CH COOH
2а,б
CH 2
NH б
При ацилировании гистидина 1а и триптофана 1б по методу Шоттен–Баумана в вод-но-диоксановой среде выход продукта увеличился до 53%, время реакции сократилось до 2 ч. Синтез 3-(1-адамантанкарбоксамидоэтил)
индола 4 осуществлялся взаимодействием триптамина 3 в толуоле в присутствии триэти-ламина с хлорангидридом 1-адамантанкарбоновой кислоты по следующей схеме
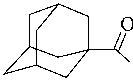
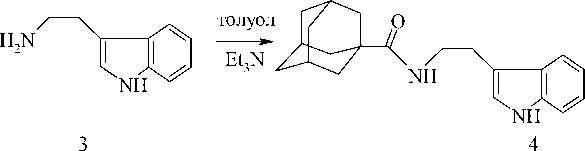
При ацилировании 2-(3´-индолил) этила-мина 6 выход целевого продукта увеличивается по сравнению с триптофаном 3б. Это можно объяснить протонированием аминогруппы в D,L-триптофане 2б и дополнительным стерическим препятствием со стороны карбоксильной группы. В табл. 1 и 2 представлены время протекания реакций и данные ИК и ЯМР 1Н спектров полученных соединений.
В ИК спектрах соединений наблюдаются полосы поглощения сильной интенсивности 2908-2847 см-1 и 1720-1654 см-1, соответствующие валентным колебаниям связей С-H адамантанового ядра и С=O фрагмента амидных и карбоксильных групп. Также наблюдается поглощение ν(N–H) в области 3413-3217 см-1. В спектрах 1Н ЯМР наблюдаются три сигнала протонов каркаса адамантана в области 1.70–2.21 м.д., также присутствует сигнал протона у азота гетероцикла в области 8.40–8.88 м.д. (1Н). Полученные соединения исследованы на агрегационную активность в отношении тромбоцитов крови человека в присутствии серотонина.
Таблица 1. Температуры плавления, Rf, время протекания реакций и выходы соединений 1а, 1б, 4
|
Название соединения |
Т.пл., °С |
R f |
Время реакции, ч |
Вы ход % |
|
|
2а |
N -(1-адамантоил)-D,L-гистидин |
194–196 |
0,45* |
2 |
55 |
|
2б |
N -(1-адамантоил)-D,L-триптофан |
84–86 |
0,64* |
2 |
53 |
|
17*** |
37*** |
||||
|
4 |
3-(1-адамантанкарбоксамидоэтил)индол |
70 |
0,87** |
5*** |
57*** |
Примечание: * - этанол, ** - этилацетат, *** - данные при проведении реакции в толуоле в присутствии триэтиламина
Таблица 2. Данные ИК и ЯМР 1 Н спектров для соединений 1а, 1б и 4
|
Соединение |
ИК спектр, v , см-1 |
Спектр ЯМР 1 Н, 5 (м.д., от ТМС); J , Гц |
||
|
ν(C–H) Ad |
ν (N–H), ν (C=O) |
H Ad, H CH2 |
H Ar(Het) , H NH |
|
|
1а |
2904, 2847 |
3413, 1700, 1640 |
1.64 м (6H, CH 2 ), 1.76 д (6H, CH 2 ), 1.92 c (3H, CH), 2.92 м (2H, CH 2 ), 3.99 к (8 Гц, 1H, CH) |
6.59 с (1H, Неt), 6.96 д (6 Гц, 1H, Het), 7.41 с (1H, NH), 8.43 c (1H, NH Нet) |
|
1б |
2908, 2850 |
3394, 3317, 1720, 1693, 1654 |
1.65 м (6H, CH 2 ), 1.76 м (6H, CH 2 ), 1.94 c (3H, CH), 2.80 с (2H, СН 2 ), 4.15 м (1H, CH) |
6.96 м (1H, Het ), 7.04 м (1H, Het), 7.10 с (1H, Het), 7.27 м (1H, Het), 7.45 м (1H, Het), 7.53 м (1H, NH), 8.40 c (1H, NH, Het) |
|
4 |
2908, 2850 |
3413, 3217, 1693, 1640 |
1.65 м (6H, CH 2 ), 1.76 м (6H, CH 2 ), 1.94 c (3H, CH), 2.79 т (7,8 Гц, 2H, СН 2 ) 3.30 к (7,8 Гц, 2H, СН 2 ) |
6.96 т (7,0 Гц, 1H, Het), 7.04 т (7,0 Гц, 1H, Het), 7.10 д (4 Гц, 1H, Het), 7.33 д (8 Гц, 1H, Het), 7.41 т (6 Гц, 1H, Het), 7.53 д (8 Гц, 1H, NH), 8.88 c (1H, NH Het) |
Экспериментальная биологическая часть. Для выявления у исследуемых соединений синергетических свойств по отношению к серотониновым рецепторам нами проведены опыты с серотонином в качестве активатора агрегации. Для получения богатой тромбоцитами плазмы крови использовали свежеза-бранную донорскую кровь с 3,8% цитрата натрия в качестве антикоагулянта. Кровь центрифугировали при 250 g , 10 минут, полученную плазму стандартизировали по количеству тромбоцитов, внося физиологический раствор (рН 7,2) до получения оптической плотности (600 нм, 1 см) 0,5 ед. Агрегацию тромбоцитов в присутствии исследуемых соединений исследовали фотометрическим методом Борна, основанном на определении оптической плотности плазмы, обогащенной тромбоцитами. В качестве агрегирующего агента использовали серотонина креатининсульфат фирмы «Merck» в конечной концентрации 1∙10-5 M. Интенсивность агрегации оценивали по падению оптической плотности (600 нм, 1 см, СФ-46) за 30 минут и выражали в у.е.=∆ О.П. ×1000.
Результаты исследований и их обсуждение. Определяли изменения агрегирующей активности тромбоцитов при воздействии на них синтезируемых соединений 1а, 1б, 4 и серотонина креатинисульфата. Для серотонина на мембране тромбоцитов существует два типа рецепторов – ионные каналы и рецепторы, сопряжённые с G-белками, поэтому, являясь их лигандом, он может индуцировать процессы агрегации тромбоцитов двумя путями. Влияние соединений на скорость агрегации тром- боцитов может быть обусловлено их способностью усиливать сродство индуктора агрегации к рецепторам (синергисты) или каким-либо образом блокировать доступ лиганда к своему рецептору. Кроме того, возможным является агонистическое влияние на рецептор с малой константой ассоциации агониста с рецепторной молекулой.
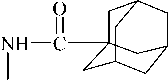
Показано что, N -адамантоильное производное биогенного амина триптамина 4 проявляет свойства слабого синергиста, при введении карбоксильной группы эффект полностью пропадает для 1б, а замена индольного гетероцикла на имидазольный в N -(1-адамантоил)-D,L-гистидине 1а приводит к уменьшению агрегирующего эффекта серотонина на 38% (рис. 3 и табл. 3). Полученные результаты с добавлением исследуемых веществ при индукции агрегации тромбоцитов серотонином показали способность одного из соединений блокировать проведение сигнала через сопряженные с G-белками серотониновые рецепторы. Наиболее активное уменьшение серотонин-индуцируемой агрегации оказывает соединение 1а, в молекуле которого расстояние между атомом азота пиридина и атомом кислорода амидной группы соответствует 5,75 Å, оно примерно такое же, как в молекуле серотонина (табл. 3). Это согласуется и с теоретическим предсказанием возможной антисеротонинэргической активности у данного соединения и является еще одним обоснованием того, что уменьшение агрегации, вероятно, связано с конкурентным блокированием серотониновых рецепторов.
Таблица 3. Влияние производных адамантана на серотонин-индуцированную агрегацию тромбоцитов человека in vitro
|
№ |
Структура соединений |
Интенсивность агрегации, усл.ед |
Характер действия |
|
|
контроль |
опыт |
|||
|
1а |
O COOH N CH CH N H2 N H |
34,2±3,8 |
20,8±0,7* |
антагонист |
|
1б |
O COOH N CH CH H2 N H |
27,8±1,9 |
24,3±1,0 |
не проявляет активности |
|
4 |
O N CH CH H 22 N H |
33,03,4 |
46,0±0,9* |
слабый синергист |
Примечание: * уровень достоверности Р<0,01
Таким образом, полученные экспериментальные данные подтверждают биологическую активность исследуемых соединений по отношению к тромбоцитам крови человека in vitro . Результаты наших исследований подтверждают известные литературные данные о том, что введение в молекулу производного высоколипофильного адамантильного радикала усиливает его взаимодействие с гидрофобными областями рецепторных молекул [1, 2], соединение 1б имеет подобную активность, препятствуя проведению сигнала активации серотонином.
Выводы: исследуемые производные адамантана оказывают различное действие на индуцируемую агрегацию тромбоцитов человека, было найдено 2 соединения, проявляющих свойства антагониста и синергиста, при серотонин-индуцированной агрегации тромбоцитов человека in vitro, что является следствием их способности влиять на функционирование тромбоцитарных рецепторов. Показано что наибольшая активность характерна для N-(1-адамантоил)-D,L-гистидина проявляющего свойства антагониста (увеличение на 38%). Эффект усиления агрегации в присутствии 3-(1-адамантанкарбоксамидоэтил)индола на 39% предположительно обусловлен способностью данного производного увеличивать эффективность функционирования гликопротеиновых рецепторов на поверхности тромбоцитов. Механизм влияния данных производных адамантана на серотонин-индуцированную аггрега-цию требует дальнейшего изучения.
Список литературы Влияние N-адамантоил-α-аминокислот и N-(пиридин- 4-ил)- 3-(1-адамантанкарбоксамидо-этил)индола на индуцированную агрегацию тромбоцитов
- Ковтун, В.Ю. Использование адамантанкарбоновых кислот для модификации лекарственных средств и биологически активных соединений/В.Ю. Ковтун, В.М. Плахотник//Хим.-фарм. журн. 1987. Т. 28, № 8. С. 931-940.
- Dok, Q. Synthesis and biological properties of en-hephalin-life peptides containing adamantylalanine in position 4 and 5/Q. Dok, R. Schwyzer//Helv chim Acta. 1981. V. 64, №7. P. 2084-2089.
- Pfeipfe, F.R. N-Acylation of thyrosine during pep-tide sinthesis/F.R. Pfeipfe, P.A. Chambers, E.E. Helbert et al.//J. Med. Chem. 1984. V. 27. P.325-341.
- Данилин, А.А. Реакции C, N, O-алкилирования α-бромкетонами адамантанового ряда./Дисс. канд. хим. наук. Самара. 2000. С. 89-93.
- Fujio, M. N-[1-(2-Phenylethyl)pyrrolidin-3-yl]-1-adamantanecarboxamides as novel 5-HT2 receptor antagonists/M. Fujio, T. Kuroita, Y. Sakai et al.//J. Bioorganic & Medicinal Chemistry Letters. 2000. V. 10. P. 2457-2461.
- Bojarski, A.J. The influence of substitution at aro-matic part of 1,2,3,4-tetrahydroisoquinoline on in vi-tro and in vivo 5-HT1A/5-HT2A receptor activities of its 1-adamantoyloaminoalkyl derivatives/A.J. Bo-jarski, M.J. Mokrosz et al.//J. Bioorg. Med. Chem. 2002. V. 10. P. 87-95.
- Михалкин, А.П. Получение, свойства, применение N-ацил-α-аминокислот/А.П. Михалкин//Успехи химии. 1995. Т. 64, вып. 3. С. 275-280.
- Акимова, А.А. Ациламинокислоты синтез и свойства/А.А. Акимова, О.И. Галахов//Изв. Вузов. Химия и химическая технология. 1987. Т. 30, № 6. С. 114-117.


