Влияние нарушений околосуточных ритмов на клиническую картину заболевания у пациентов с метаболическим синдромом
Автор: Грибанов И. А., Зарубина Е. Г.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 т.13, 2023 года.
Бесплатный доступ
Целью данного исследования стало изучение влияния темновой депривации различной продолжительности на течение метаболического синдрома (МС).Материал и методы исследования. Для реализации поставленной цели нами на основе критериев ВОЗ были отобраны пациенты с метаболическим синдромом и нарушенными циркадными ритмами - всего 102 человека (все мужчины) из числа лиц, постоянно работающих в ночное время, у которых на предварительном этапе было зафиксировано снижение уровня мелатонина. В соответствии с поставленными задачами, 102 пациента работоспособного (молодого возраста по критериям ВОЗ) разделили на три группы по 33, 37 и 32 человека соответственно по критерию «длительность работы в ночное время и длительности анамнеза МС»: 0-5, 5-10 и свыше 10 лет. В первой группе средний возраст составил 30,1 ± 1,4 года, во второй - 36,5 ± 1,5 года, в третьей группе средний возраст не превышал 40,3 ± 0,9 года. В качестве контрольной группы было обследовано 45 пациентов с метаболическим синдромом. Данная группа была сопоставимая с основными группами по фоновой патологии и возрасту и различной длительностью анамнеза метаболического синдрома.Результаты. Было установлено, что основной признак метаболического синдрома - абдоминальный тип ожирения (объём талии более 80 см для мужчин) выявлен у 100 % пациентов основных и контрольной групп наблюдения. При этом было установлено, что выраженность абдоминального ожирения сочетается с увеличением индекса массы тела и имеет тенденцию к увеличению у пациентов в основных группах, по сравнению с обследованными из контрольной группы. В контрольной группе у 35,5 % обследованных отмечалась артериальная гипертензия 1-2 степени, и еще у 15,6 % было выявлено повышенное нормальное давление.Выводы. У пациентов с метаболическим синдромом на фоне нарушения регуляторных механизмов заболевание протекает тяжелее, чем у пациентов с аналогичной длительностью анамнеза метаболического синдрома, но не имеющих нарушений околосуточных ритмов. Тяжесть течения метаболического синдрома на фоне снижения уровня мелатонина увеличивается по мере длительности нарушения регуляторных механизмов.
Метаболический синдром, мелатонин, артериальное давление
Короткий адрес: https://sciup.org/143179930
IDR: 143179930 | УДК: 616.127-005.8 | DOI: 10.20340/vmi-rvz.2023.1.CLIN.1
Текст научной статьи Влияние нарушений околосуточных ритмов на клиническую картину заболевания у пациентов с метаболическим синдромом
УДК 616.127-005.8
В 1988 г. Gerald M. Reaven на основании собственных наблюдений и обобщения исследований других авторов предложил концепцию метаболического синдрома (МС), в которую включил сочетание нарушения толерантности к глюкозе (НТГ) и компенсаторной гиперинсулинемии, повышения уровня триглицеридов (ТГ) и снижения уровня холестерина липопротеинов высокой плотности (ЛПВП) и артериальную гипертензию (АГ) [1]. В 2000 г. Американская Ассоциация клинических эндокринологов предложила ввести для МС свой шифр – 277.7 по МКБ-9, который получил название «дисметаболический синдром Х», однако при формировании десятого пересмотра МКБ диагноз «метаболический синдром» (ВОЗ, 1998) был утрачен [2]. В настоящее время имеющиеся коды в МКБ-10 маскируют причинные факторы болезни и регистрируют только последствия этого заболевания.
Тем не менее МС продолжает рассматриваться медиками всего мира как грозное состояние, которое даже получило наименование «смертельного квартета», распространённость которого в мире неуклонно возрастает и приводит к росту смертей от сердечно-сосудистой патологии [3–6]. Эксперты ВОЗ охарактеризовали метаболический синдром как «пандемию XXI века» [7]. Распространенность МС в человеческой популяции составляет в наши дни 20–40 % [8]. По результатам исследования INTERHEART, в среднем 26 % взрослого населения планеты имеют МС (по критериям NCEP АТР III). В Российской Федерации, по результатам исследований, 40 % населения уже имеют два компонента МС, 11 % – три и более его составляющих [9].
Несмотря на то, что МС чаще встречается у лиц среднего и старшего возраста (30–40 % от общего числа пациентов), за последние два десятилетия частота изучаемого синдрома демонстрирует устойчивый рост среди молодежи [10]. На сегодняшний день число больных с МС в 2 раза превышает количество пациентов с сахарным диабетом (СД) 2 типа, и в ближайшие 20 лет ожидается увеличение частоты МС на 50 % [11]. Необходимо подчеркнуть, что большинство пациентов с МС – это популяция людей активного трудоспособного возраста, наиболее продуктивная и значимая для общества. Эксперты ВОЗ следую- щим образом оценили ситуацию: «Мы сталкиваемся с новой пандемией XXI века, охватывающей индустриально развитые страны». В этой оценке эксперты подчеркивают влияние на развитие МС факторов внешней среды, связанные с развитием общества [12].
В последнее столетие из-за бурного развития промышленности, появления новых технологий, требующих круглосуточных производственных процессов, освоения ранее неиспользованных земель на Крайнем Севере, в Заполярных областях, появилась достаточно значимая часть населения, которая работает в условиях нарушения естественных биоритмов: в условиях круглосуточной искусственной освещённости, в районах полярных дней и ночей, когда возможно формирование регуляторных и адаптационных расстройств, связанных с внешними воздействиями [13–15]. В этих условиях всё чаще речь идет о формировании новых форм заболеваний, которые многие учёные относят к условной группе болезней цивилизации [16]. Не последней из них в настоящее время является проблема, связанная с увеличением веса и развитием метаболического синдрома [17].
Целью данного исследование стало изучение влияния темновой депривации различной продолжительности на течение МС.
Материал и методы исследования
Для реализации поставленной цели нами на основе критериев ВОЗ были отобраны пациенты с МС и нарушенными циркадными ритмами – всего 102 человека (все мужчины) из числа лиц, постоянно работающих в ночное время, у которых на предварительном этапе было зафиксировано снижение уровня мелатонина. Пациенты отбирались по амбулаторным картам в поликлиниках города Самары с последующим дообследованием в клинике медицинского университета «Реавиз». Так как единых общепризнанных критериев диагностики расстройств регуляции в настоящее время нет, на первом этапе ориентировались на маркер нарушений циркадианных ритмов – уровень мелатонина в сыворотке крови.
В соответствии с поставленными задачами, 102 пациентов работоспособного (молодого /возраста по критериям ВОЗ) разделили на три группы – 33, 37 и 32 человека соответственно по критерию «длительность работы в ночное время и длительности анамнеза МС»: 0–5, 5–10 и более 10 лет. В первой группе средний возраст составил 30,1 ± 1,4 года, во второй группе – 36,5 ± 1,5 года, в третьей группе средний возраст не превышал 40,3 ± 0,9 года.
В качестве контрольной группы было обследовано 45 пациентов с МС, сопоставимыми с пациентами групп по фоновой патологии и возрасту и различной длительностью анамнеза МС. В подгруппу А контрольной группы вошли 15 пациентов, средний возраст которых составлял 29,8 ± 1,2 года при длительности анамнеза заболевания до 5 лет. В подгруппу Б контрольной группы были отнесены 15 человек, средний возраст – 34,2 ± 1,3 года, с длительностью анамнеза МС от 5 до 10 лет. Подгруппу В контрольной группы составили 15 обследованных в возрасте 41,1 ± 1,3 года, у которых МС был диагностирован более 10 лет назад. Все пациенты группы контроля не имели признаков расстройств регуляции по результатам предварительного обследования.
Основным методом в ходе проведенного исследования послужил метод клинического анализа. Изучение уровня мелатонина в сыворотке крови, как подтверждение нарушения околосуточных ритмов, проводилось у всех участников исследования с применением метода иммуноферментного анализа набора Melatonin ELISA (IBL, Германия). Измерение показателей проводилось с использованием фотометра для проведения иммунофер-ментного анализа PR–2100 (Sanofi Diagnostics Pasteur, Франция). В норме оптимальная концентрация мелатонина в сыворотке крови человека отличается широкой вариабельностью от 8 до 20 пг/мл, а во время определения в ночной период уровень мелатонина не должен превышать 150 пг/мл. Все исследования проводились на протяжении одного климатического периода в стандартизированных условиях.
Для диагностики метаболического синдрома нами использовались критерии, указанные в Методических рекомендациях по ведению пациентов с метаболическим синдромом (2013, РФ), включая биохимические и антропометрические показатели. Круглосуточное определение показателей артериального давления (АД) проводилось с использованием аппарата Холтер-ДМС (Передовые техноло- гии, Россия). Помимо регистрации уровня АД, определялось также соотношение между различными профилями АД в группах пациентов, включённых в исследование: Dippers – 10 % ≤ степень снижения ночного давления < 20 %; Non-dippers – 0 % ≤ степень снижения ночного давления < 10 %; Night-peakers – повышение АД в ночное время.
Полученные результаты и их обсуждение
Было установлено, что основной признак МС – абдоминальный тип ожирения (объём талии более 80 см для мужчин) выявлен у 100 % пациентов основных и контрольной групп наблюдения. При этом было установлено, что выраженность абдоминального ожирения сочетается с увеличением индекса массы тела (ИМТ) и имеет тенденцию к увеличению у пациентов в основных группах, по сравнению с контрольной группой (табл. 1). При этом оба показателя находятся во взаимо-обратной связи с уровнем мелатонина.
В контрольной группе было отмечено увеличение у пациентов объёма талии и ИМТ с увеличением возраста пациентов – все пациенты с ожирением I степени были старше 40 лет.
Сравнение показателей основных групп со средними показателями пациентов контрольной группы показало, что при наличии десинхроноза абдоминальное ожирение выражено более значительно, особенно у пациентов второй и третьей групп. Так, если средние показатели по группе контроля взять за 100,0 %, то, например, объём талии у пациентов третьей группы составляет 117,4 %, при этом количество пациентов с ожирением I степени. Увеличивается в 3,5 раза, и появляются люди с ожирением II и III степени, чего не наблюдалось в группе контроля.
Подобные изменения антропометрических данных (появление прибавки в весе, более быстрый набор абдоминального жира) могут быть связаны с изменением уровня мелатонина, поскольку мелатонин тесно связан с жировым обменом и обменом лептина. В эксперименте на животных было показано, что введение мелатонина приводит к увеличению липолиза в белой жировой ткани, снижению потребления пищи и уменьшению ожирения. Такое действие мелатонина может быть опосредовано прямой стимуляцией дифференциации преадипоцитов и трансдифференцировкой белых адипоцитов в бурые, что может способствовать контролю за массой тела. Кроме того, как считается в настоящее время, мелатонин влияет на синтез и секрецию двух основных ади-покинов, участвующих в энергетическом обмене, – лептина и адипонектина, что также может негативно отражаться на жировом обмене при дефиците мелатонина.
Результаты обследования пациентов основных и контрольной групп, направленных на выявление дополнительных критериев МС (в соответствии с рекомендациями 2013, РФ), представлены в таблице 2.
На основании полученных данных было установлено, что в основных группах, по сравнению с группой контроля, отмечались более разнообразные и выраженные симптомы МС, что подтверждалось количеством случаев с выявлением более двух дополнительных симптомов МС у одного пациента. Доля таких пациентов в основных группах возрастала от 54,6 % в первой группе до 100 % в третьей, в то время как в группе контроля таких пациентов было не более 17,8 % (р < 0,001).
Таблица 1. Взаимосвязь абдоминального ожирения, общей массы тела у пациентов с метаболическим синдромом и уровня мелатонина
Table 1. Relationship between abdominal obesity, total body weight in patients with metabolic syndrome and melatonin levels
|
Группы |
Уровень мелатонина в 2:00 ч, пг/мл |
Объём талии, см |
ИМТ |
||||
|
Норма, % |
Предожи-рение, % |
Ожирение I ст., % |
Ожирение II ст., % |
Ожирение III ст., % |
|||
|
Группа I, n = 33 |
122,8 ± 1,9 |
96,7 ± 1,5 |
51,5 |
49,5 |
|||
|
Группа II, n = 37 |
118,1 ± 2,3 |
104,8 ± 1,3 |
43,3 |
16,2 |
21,6 |
16,2 |
2,7 |
|
Группа III, n = 32 |
96,7 ± 0,72 |
115,3 ± 1,1 |
12,5 |
12,5 |
28,1 |
43,8 |
15,6 |
|
Группа контроля, n = 45 |
136,7 ± 1,1 |
98,2 ± 1,1 |
82,2 |
11,1 |
6,7 |
||
Таблица 2. Распространенность дополнительных критериев МС у пациентов различных групп с абдоминальным ожирением и в группе контроля
Table 2. Prevalence of additional MS criteria in patients of various groups with abdominal obesity and in the control group
|
Дополнительные критерии МС |
Группа I, n = 33 |
Группа II, n = 37 |
Группа III, n = 32 |
Группа контроля, n = 45 |
|
% (абс.) |
% (абс.) |
% (абс.) |
% (абс.) |
|
|
Уровень АД > 140 и 90 мм рт. ст. или лечение АГ препаратами |
45,4 (15) |
56,7 (21) |
62,5 (22) |
35,6 (16) |
|
Повышение уровня триглицеридов (≥ 1,7 ммоль/л) |
75,6 (25) |
86,5 (32) |
100,0 (32) |
42,2 (19) |
|
Снижение уровня ХС ЛПВП (< 1,0 ммоль/л у мужчин; < 1,2 ммоль/л у женщин) |
45,5 (15) |
28 |
29 |
19 |
|
Нарушенная толерантность к глюкозе (НТГ) – повышенный уровень глюкозы плазмы через 2 ч после нагрузки 75 г безводной глюкозы при ПГТТ ≥ 7,8 ммоль/л и < 11,1 ммоль/л, при условии, что уровень глюкозы плазмы натощак составляет менее 7,0 ммоль/л |
19 |
17 |
10 |
24 |
|
Нарушенная гликемия натощак (НГН) – повышенный уровень глюкозы плазмы натощак ≥ 6,1 ммоль/л и < 7,0 ммоль/л при условии, что глюкоза плазмы через 2 ч при ПГТТ составляет менее 7,8 ммоль/л |
13 |
15 |
13 |
18 |
|
Комбинированное нарушение НГН/НТГ – повышенный уровень глюкозы плазмы натощак ≥ 6,1 ммоль/л и < 7,0 ммоль/л в сочетании с глюкозой плазмы через 2 ч при ПГТТ ≥ 7,8 и < 11,1 ммоль/л |
– |
– |
9 |
2 |
|
Итого, имеют более двух дополнительных критерия МС |
18 (54,6 %) |
28 (75,7 %) |
32 (100,0 %) |
8 (17,8 %) |
Как видно из представленных в таблице данных, у пациентов с МС отмечается не только более выраженные нарушения жирового обмена (из дополнительных критериев рост триглицеридэмии и снижение уровня ЛПВП), но и распространённость симптомов МС в основных группах выше, чем в соответствующей группе контроля.
Наличие нарушения процессов регуляции негативно влияет и на состояние сердечнососудистой системы пациентов с МС, что выражалось в более частом выявлении в основных группах артериальной гипертензии.
По-видимому, именно снижение уровня мелатонина приводило к постепенному повышению тонуса симпато-адреналовой системы, что объясняло более частое повышение уровня АД у пациентов с МС, работающих в ночное время (табл. 3).
Как видно из приведенных данных, в контрольной группе у 35,5 % обследованных отмечалась АГ 1–2 степени, и ещё у 15,6 % было выявлено повышенное нормальное давление. При наличии нарушения околосуточных ритмов длительностью до 5 лет у пациентов с МС количество пациентов с АГ 1–2 степени возрастало до 45,4 % (р ≤ 0,001) при сохранении числа лиц с повышен- ным нормальным АД на уровне 15,2 %. При увеличении длительности нарушения регуляторных механизмов до 10 лет этот показатель возрастал до 56,7 % (р ≤ 0,001), а в третьей группе – до 62,5 % (р ≤ 0,001), при этом появлялась группа лиц с АГ 3 степени – 6,3 % от общего количества обследованных в группе. Отмечалось и увеличение количества пациентов с АГ 2 степени в ряду I группа – II группа – III группа с 12,1 % до 16,2 % и 46,9 % соответственно, при этом в контрольной группе АГ 2 степени была зарегистрирована лишь у 11,1 % обследованных с МС.
У всех пациентов с артериальной гипертензией были достигнуты целевые уровни АД на фоне корректирующей медикаментозной терапии.
Помимо отрицательной динамики АД у обследованной группы лиц с метаболическим синдромом было выявлено изменение суточного профиля АД на фоне длительного периода работы в ночное время. Выявленные особенности суточных профилей артериального давления характеризуют скомпенсиро-ванность сосудистого тонуса на фоне изменения ритмов сна и бодрствования, а также в сравнении с пациентами контрольной группы, страдающих МС, но работающих в дневное время, (рис. 1).
Таблица 3. Распространённость артериальной гипертонии среди пациентов разных групп
Table 3. The prevalence of arterial hypertension among patients of different groups
|
Уровни АД (согласно классификации АГ в клинических рекомендациях 2017 ACC/AHA Hypertension Guidelines) |
Группа I, n = 33 |
Группа II, n = 37 |
Группа III, n = 32 |
Группа контроля, n = 45 |
||||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
Абс. |
% |
|
|
Нормальное АД |
13 |
39,4 |
6 |
16,2 |
1 |
3,1 |
22 |
48,9 |
|
Повышенное АД |
5 |
15,2 |
10 |
27,1 |
9 |
28,1 |
7 |
15,6 |
|
АГ 1 степени |
11 |
33,3 |
15 |
40,5 |
5 |
15,6 |
11 |
24,4 |
|
АГ 2 степени |
4 |
12,1 |
6 |
16,2 |
15 |
46,9 |
5 |
11,1 |
|
АГ 3 степени |
– |
– |
– |
– |
2 |
6,3 |
||
|
Итого |
33 |
100,0 |
37 |
100,0 |
35 |
100,0 |
45 |
100,0 |
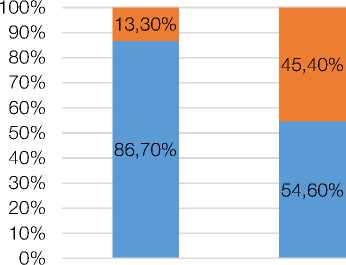
I группа
Группа контроля для I группы
6,70%
20,00%
73,30%
Группа контроля для II группы
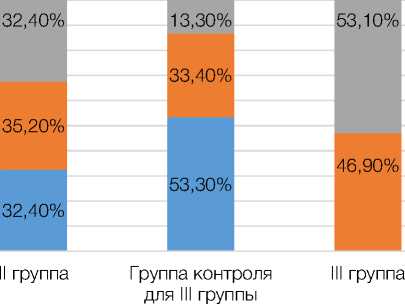
■ Dippers ■ Non-dippers
■ Night-peakers
Рисунок 1. Характер распределения суточных профилей у обследованных пациентов с метаболическим синдромом и лиц групп контроля
Figure 1. The nature of the distribution of daily profiles in the examined patients with metabolic syndrome and persons of control groups
В ходе изучения результатов мониторирования АД, включённых в исследование лиц, было установлено, что по мере увеличения стажа работы в ночное время у пациентов с МС происходит значительное изменение тонуса сосудистой системы, коррелирующее с уровнем мелатонина (r = –0,96), что находит отражение в увеличении в структуре суточной динамики АД таких неблагоприятных профилей как Non-dippers и Nightpeakers, особенно среди лиц третьей группы, где количество пациентов с профилем Night-peakers доходит до 46,9 % (р < 0,001 по сравнению с группой контроля), при этом, среди лиц из группы контроля количество пациентов с профилем Night-peakers не превышало 13,3 %.
Выводы
У пациентов с МС на фоне нарушения регуляторных механизмов заболевание протекает тяжелее, чем у пациентов с аналогичной длительностью анамнеза МС, но не имеющих нарушений околосуточных ритмов. Тяжесть течения МС на фоне снижения уровня мелатонина увеличивается по мере длительности нарушения регуляторных механизмов. Изменения в течении заболевания касаются, в первую очередь, сердечно-сосудистой системы (повышение сосудистого тонуса и формирование неблагоприятных профилей АД), а также обменных процессов (нарушение жирового и углеводного обменов), что выражается в появлении трёх и более симптомов МС у одного пациента.
Список литературы Влияние нарушений околосуточных ритмов на клиническую картину заболевания у пациентов с метаболическим синдромом
- Reaven GM. Role of insulin resistance in human disease. Diabetes. 1988;37:1595-1607.
- Jellinger PS, Dickey RA, Ganda OP, Mehta AE, Nguyen TT, Rodbard HW, Seibel JA, Shepherd MD, Smith DA; AACE Lipid Guidelines Committee. The American Association of Clinical Endocrinologists. AACE medical guidelines for clinical practice for the diagnosis and treatment of dyslipidemia and prevention of atherogenesis. EndocrPract. 2000 Mar-Apr;6(2):162-213.
- Gami AS, Witt BJ, Howard DE, Erwin PJ, Gami LA, Somers VK, Montori VM. Metabolic syndrome and risk of incident cardiovascular events and death: a systematic review and meta-analysis of longitudinal studies. J Am Coll Cardiol. 2007 Jan 30;49(4):403-14. https://doi.org/10.1016/jjacc.2006.09.032. Epub 2007 Jan 12. PMID: 17258085.
- Boehm BO, Claudi-Boehm S. The metabolic syndrome. Scand J Clin Lab Invest Suppl. 2005;240:3-13. https://doi.org/10.1080/00365510500236044. PMID: 16112954.
- Tune JD, Goodwill AG, Sassoon DJ, Mather KJ. Cardiovascular consequences of metabolic syndrome. Transl Res. 2017 May;183:57-70. https://doi.org/10.1016Zj.trsl.2017.01.001. Epub 2017 Jan 9. PMID: 28130064; PMCID: PMC5393930.
- Park SK, Jung JY, Oh CM, Choi JM, Kim MH, Ha E, Kim Y, Ryoo JH. Components of metabolic syndrome and their relation to the risk of incident cerebral infarction. Endocr J. 2021 Mar 28;68(3):253-259. https://doi.org/10.1507/endocrj.EJ20-0486. Epub 2020 Oct 10. PMID: 33041272.
- Grundy SM. Metabolic syndrome pandemic. Arterioscler Thromb Vasc Biol. 2008 Apr;28(4):629-36. https://doi.org/ 10.1161/ATVBAHA.107.151092. Epub 2008 Jan 3. PMID: 18174459.
- Saklayen MG. The Global Epidemic of the Metabolic Syndrome. Curr Hypertens Rep. 2018 Feb 26;20(2):12. https://doi.org/10.1007/s11906-018-0812-z. PMID: 29480368; PMCID: PMC5866840.
- Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, McQueen M, Budaj A, Pais P, Varigos J, Lisheng L; INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 2004 Sep 11-17;364(9438):937-52. https://doi.org/10.1016/S0140-6736(04)17018-9. PMID: 15364185.
- Poyrazoglu S, Bas F, Darendeliler F. Metabolic syndrome in young people. Curr Opin Endocrinol Diabetes Obes. 2014 Feb;21 (1):56-63. https://doi.org/10.1097/01.med.0000436414.90240.2c. PMID: 24247648.
- Lemieux I, Després JP. Metabolic Syndrome: Past, Present and Future. Nutrients. 2020 Nov 14; 12(11 ):3501. https://doi.org/ 10.3390/nu12113501. PMID: 33202550; PMCID: PMC7696383.
- Saklayen MG. The Global Epidemic of the Metabolic Syndrome. Curr Hypertens Rep. 2018 Feb 26;20(2):12. https://doi.org/10.1007/s11906-018-0812-z. PMID: 29480368; PMCID: PMC5866840.
- Rosenberg K. Shift Work Adversely Affects Mental Health. Am J Nurs. 2020 Mar; 120(3): 67. https://doi.org/10.1097/01.NAJ.0000656368.67026.9f. PMID: 32079804.
- Folkard S. Shift work, safety, and aging. Chronobiol Int. 2008 Apr;25(2): 183-98. https://doi.org/10.1080/07420520802106694. PMID: 18484360.
- Arlinghaus A, Bohle P, Iskra-Golec I, Jansen N, Jay S, Rotenberg L. Working Time Society consensus statements: Evidence-based effects of shift work and non-standard working hours on workers, family and community. Ind Health. 2019 Apr 1 ;57(2):184-200. https://doi.org/10.2486/indhealth.SW-4. Epub 2019 Jan 31. PMID: 30700670; PMCID: PMC6449634.
- Isbit J. Preventing diseases of civilization. J Pediatr Surg. 2018 Jun;53(6):1261. https://doi.org/10.1016/jjpedsurg.2018.02.099. Epub 2018 Apr 9. PMID: 29729822.
- Kopp W. How Western Diet And Lifestyle Drive The Pandemic Of Obesity And Civilization Diseases. Diabetes Metab Syndr Obes. 2019 Oct 24;12:2221-2236. https://doi.org/10.2147/DMSO.S216791. PMID: 31695465; PMCID: PMC6817492.


