Влияние натриевых солей пирроло[3,4-с]-пиразол-3-онов и 1-фенилпиразол-3-карбоксамида на функциональную активность клеток врожденного иммунитета в экспериментальных моделях патологических состояний у мышей
Автор: Гейн О.Н., Бобровская О.В., Ибатуллин М.В., Гейн В.Л., Гейн С.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
Основная функция клеток-эффекторов врожденного иммунитета – элиминация экзогенных и эндогенных патогенов. Однако в ряде случаев поглотительная и микробицидная активность фагоцитов может быть нарушена, что ведет к развитию патологических состояний. В связи с этим создание иммунотропных препаратов с мягкой модулирующей активностью в отношении фагоцитарной функции лейкоцитов актуально. В этом плане перспективными являются натриевые соли пирроло[3,4-с]-пиразол-3-онов (1а-б) и 1-фенилпиразол-3-карбоксамида (2а), которые в ранее проводимых исследованиях проявили модулирующее влияние на функции фагоцитирующих клеток. В данном исследовании нами было изучено влияние натриевых солей пирроло[3,4-с]-пиразол-3-онов (1а-б) и 1-фенилпиразол-3-карбоксамида (2а) на изменение поглотительной активности перитонеальных лейкоцитов и их микробицидный потенциал в условиях двух- и шестичасового иммобилизационного стресса и острого воспаления. В ходе исследования были получены следующие результаты: натриевые соли пирроло[3,4-с]-пиразол-3-онов (1а-б) и 1-фенилпиразол-3-карбоксамида (2а) нивелировали вызванное шестичасовой иммобилизацией угнетение поглотительной активности лейкоцитов, а также угнетение продукции активных кислородных радикалов, вызванное двух- и шестичасовым иммобилизационным стрессом. Исследуемые соединения (1а-б, 2а), введенные на фоне зимозана, отменяли стимулирующее влияние последнего на поглотительную активность лейкоцитов, однако не вызывали модуляции продукции активных радикалов лейкоцитами в стимулированных зимозаном культурах.
Фагоцитоз, микробицидный потенциал, стресс, зимозановый перитонит, натриевые соли пирроло[3, 4-с]-пиразол-3-онов, натриевые соли 1-фенилпиразол-3-карбоксамида
Короткий адрес: https://sciup.org/147252652
IDR: 147252652 | УДК: 612.017 | DOI: 10.17072/1994-9952-2025-4-445-453
Текст научной статьи Влияние натриевых солей пирроло[3,4-с]-пиразол-3-онов и 1-фенилпиразол-3-карбоксамида на функциональную активность клеток врожденного иммунитета в экспериментальных моделях патологических состояний у мышей
Как известно, нейтрофильные гранулоциты, а также моноциты, макрофаги являются основными эффекторами врожденного иммунитета, участвующими в элиминации экзогенных и эндогенных патогенов. Нейтрофилы, моноциты, макрофаги являются основными участниками и модуляторами воспалительной реакции. Привлекаемые хемоаттрактантами, они мигрируют в очаг воспаления, участвуют в фагоцитозе разрушенных клеток организма, а также проникших в организм патогенов, выделяя в окружающие ткани провоспалительные медиаторы, активные радикалы. Результатом чрезмерной активации провоспали-тельных механизмов может явиться генерализация воспалительного процесса. Однако снижение функциональной активности эффекторов воспаления может приводить к хронизации течения воспалительной реакции [Черешнев, Гусев, 2012].
Функциональная активность эффекторов врожденного иммунитета может быть детерминирована как генетически, так и изменяться под воздействием ряда экзогенных и эндогенных факторов. Известно, что различные стрессорные воздействия оказывают значимое влияние на функциональную активность лейкоцитов, как на поглотительную активность, так и на микробицидный потенциал, что обусловлено присутствием на мембране лейкоцитов рецепторов для основных гормонов стресса – катехоламинов и глюкокортикоидов [Szefler, 1987; Stern, Kunos, 1988; Шилов, Орлова, 2001].
Снижение функциональной активности фагоцитирующих клеток несет в себе риск развития вторичных иммунодефицитных состояний, сопровождающихся хроническими инфекционными осложнениями. Снижение функциональной активности фагоцитирующих клеток и, прежде всего, механизмов микроби-цидности наблюдается при хронической гранулематозной болезни, при которой вследствие дефекта фермента НАДН-оксидазы лейкоциты не способны образовывать активные формы кислорода [Шарапова и др., 2011]. Также установлено, что при туберкулезе значительно снижаются такие показатели, как процент активных нейтрофилов и завершенность фагоцитоза [Филинюк и др., 2005].
В связи с этим присутствует необходимость в создании иммунотропных препаратов, обладающих мягкой корригирующей направленностью в отношении поглотительной способности лейкоцитов и их микробицидного потенциала. Также важно, чтобы, помимо фармакологической эффективности, препараты не являлись бы токсичными, и получение их активных субстанций было бы возможно с помощью простых методов. В этом плане перспективными являются натриевые соли пирроло[3,4- с ]-пиразол-3-онов и 1-фенилпиразол-3-карбоксамида, которые в ранее проводимых исследованиях проявили иммуно-тропную активность в отношении функций фагоцитирующих клеток [Гейн и др., 2022; Гейн и др., 2025].
Цель работы – исследование влияния натриевых солей пирроло[3,4- с ]-пиразол-3-онов и 1-фенилпиразол-3-карбоксамида на функциональную активность клеток врожденного иммунитета в экспериментальных моделях патологических состояний у мышей.
Материалы и методы исследования
Для оценки влияния натриевых солей пирроло[3,4- с ]-пиразол-3-онов и 1-фенилпиразол-3-карбоксамида на функциональную активность клеток врожденного иммунитета при иммобилизационном стрессе были взяты 3 соединения (рис. 1), которые по ранее проведенным исследованиям оказывали влияние на поглотительную активность лейкоцитов и их микробицидный потенциал [Гейн и др., 2022].
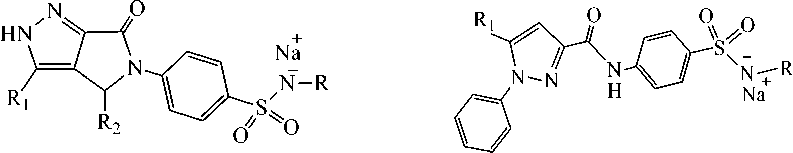
1а-б 2а
Рис. 1. Структурные формулы изучаемых соединений.
Натриевые соли пирроло[3,4- с ]-пиразол-3-онов: R1=4-BrC 6 H 4 , R2=3-CH 3 OC 6 H 4 , R= MeCO ( 1а) ;
R1 = 4-BrC 6 H 4 , R2 = 2-NO 2 C 6 H 4, R= MeCO ( 1б ); натриевая соль 1-фенилпиразол-3-карбоксамида:
R1 = 4-CH 3 OС 6 H 4 , R=С 3 H 2 NS ( 2а)
[Structural formulas of the compounds studied]
Эксперименты в системе in vivo проведены на белых нелинейных половозрелых мышах массой 21–26 г. Все исследовательские работы с лабораторными животными выполнялись в соответствии с общепринятыми этическими нормами обращения с животными, принятыми Европейской конвенцией по защите позвоночных животных, используемых для исследовательских и иных научных целей [Европейская …, 1986].
В качестве моделей патологических состояний использовали двух- и шестичасовой иммобилизацион-ный стресс и острое воспаление. Иммобилизацию животных проводили на спине, за 30 мин до начала иммобилизации вводили внутрибрюшинно соединения натриевых солей пирроло[3,4- с ]-пиразол-3-онов (1а-б) и 1-фенилпиразол-3-карбоксамида (2а) в дозе 100 мг/кг. Острую воспалительную реакцию индуцировали внутрибрюшинным введением мышам стерильной суспензии опсонизированного зимозана А (нерастворимый полисахарид клеточной стенки грибов Saccharomyces cerevisiae ) в дозе 50 мг/кг. Исследуемые соединения вводились внутрибрюшинно за 1 ч до введения зимозана.
Для оценки поглотительной активности перитонеальных лейкоцитов мышей к 80 мкл клеток добавляли 10 мкл суспензии FITC-меченого St. cohnii в конечной концентрации 108 кл/мл, пробы инкубировали 30 мин при температуре 37°C. Затем к клеткам добавляли лизирующий раствор (0.15М NH 4 Cl; 0.01М NaHCO 3 ; 0.0001М ЭДТА (этилендиаминтетрауксусная кислота)) и после 5 мин инкубации центрифугировали 5 мин при 250 g с охлаждением при температуре 4°C. После снимали супернатант, добавляли 0.02% ЭДТА в PBS (phosphate buffered saline – фосфатно-буферный солевой раствор) и снова центрифугировали 5 мин при 250 g с охлаждением при температуре 4°C. Далее вновь снимали супернатант, добавляли 100 мкл 0.02% ЭДТА в PBS. После этого пробы анализировали на проточно-лазерном цитометре («Bio Sino», Китай) [Nielsen et al., 1995].
Микробицидный потенциал перитонеальных лейкоцитов оценивался на основании продукции ими активных кислородных радикалов, оценку которых производили с помощью реакции люминолзависимой хемилюминесценции (ЛЗХЛ). Реакцию проводили в 96-луночных плоскодонных планшетах («Greiner», Германия), каждая лунка содержала клетки в концентрации 2 x 10 5 клеток/0.2 мл р-ра Хенкса. Индуктором ЛЗХЛ был выбран опсонизированный зимозан в концентрации 150 мкг/мл. В качестве маркера выраженности реакции ЛХЗЛ использовался люминол 10–5М. Регистрация результатов велась в течение 1 часа с интервалом в 5 мин с помощью люминометра («Tecan Trading AG», Швейцария) [Фримель, 1987].
Статистическую обработку данных проводили методами вариационной статистики с помощью t -критерия Стьюдента. Эффект считали достоверным при p < 0.05 по сравнению с контролем. Результаты представляли в виде средней и ее стандартной ошибки (М±m).
Результаты и их обсуждение
В ходе исследований было установлено, что двухчасовая иммоблизация приводила к угнетению поглотительной активности лейкоцитов. Исследуемые соединения 1а , 1б и 2а не отменяли угнетающего влияния двухчасового иммобилизационного воздействия на поглотительрную активность лейкоцитов (рис. 2А). Угнетение поглотительной активности лейкоцитов было выявлено и на фоне шестичасовой иммобилизации, и это угнетение носило более выраженный характер по сравнению с двухчасовым стрессом. Снижение поглотительной активности лейкоцитов относительно контроля при двухчасовом стрессорном воздействии составило 31%, а при шестичасовом – около 48%. Соединения 1а и 1б , являющиеся натриевыми солями пирроло[3,4- с ]-пиразол-3-онов, нивелировали выраженное угнетение поглотительной активности лейкоцитов, вызванное шестичасовым стрессорным воздействием (рис.2Б). В ранее проведенных исследованиях было показано что при самостоятельном введении натриевые соли пирроло[3,4-с]-пиразол-3-онов (la-б) и 1-фенилпиразол-З-карбоксамида (2а) стимулировали поглотительную активность лейкоцитов и прежде всего нейтрофильных гранулоцитов, увеличивая количество активных нейтрофилов в среднем более чем на 50%, а количество поглощенных ими объектов - на 8.6% и более [Гейн и др., 2022].
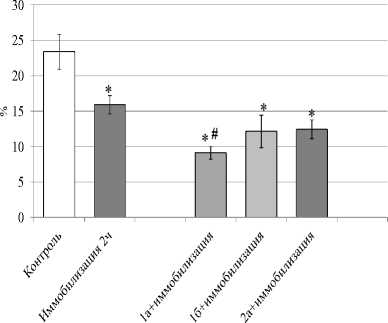
А
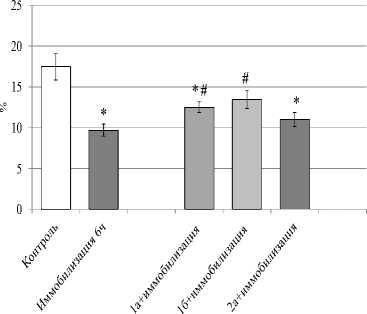
Б
Рис. 2. Влияние соединений 1а, 1б, 2а на фагоцитарную активность лейкоцитов (процент фагоцитоза) в условиях двухчасовой (А) и шестичасовой (Б) иммобилизации.
* - р <0.05 по сравнению с контролем, # - р <0.05 по сравнению иммобилизацией, количество животных в группах: n=7 (для 2-часовой иммобилизации) и n=8 (для 6-часовой иммобилизации)
[The effect of compounds 1a, 1b, 2a on the phagocytic activity of leukocytes (percentage of phagocytosis) under conditions of two-hour (A) and six-hour (B) immobilization]
Оценивая стимулированную продукцию активных форм кислорода (АФК), было выявлено угнетение микробицидного потенциала лейкоцитов в условиях двухчасовой иммобилизации, начиная с 20-й мин и до 40-й мин включительно, а также на 55-й мин наблюдения. Соединение 1б на фоне 2-часового стрес-сорного воздействия ингибировало продукцию АФК лейкоцитами только в первые 10 мин, отменяя в последующем угнетающий эффект стресса на продукцию активных радикалов. Соединение 1а на фоне 2-часовой иммобилизации приводило к более ранней и продолжительной депрессии микробицидного потенциала лейкоцитов – с 5-й по 30-ю мин наблюдения по сравнению со стрессом. Введение 2а на фоне 2-часовой иммобилизации оказывало стимулирующее влияние на выраженность и пролонгированность продукции активных форм кислорода лейкоцитами как по сравнению с контролем, так и по сравнению со стрессорным воздействием (рис. 3А).
Шестичасовой иммобилизационный стресс, как и 2-часовой стресс, приводил к угнетению стимулированной зимозаном продукции АФК лейкоцитами. Угнетение продукции активных радикалов было более продолжительным и регистрировалось с 25 мин по 60 мин наблюдения. Исследуемые соединения ( 1а , 1б , 2а ), введенные на фоне шестичасовой иммобилизации, значительно увеличивали интенсивность продукции активных радикалов, начиная с 5-й мин и до конца наблюдения. Интенсивность продукции активных радикалов возрастала как по сравнению с животными, которые подвергались только стрессор-ному воздействию, так и по сравнению с контролем. Пик продукции АФК при введении на фоне стресса соединений 1а , 1б приходился на период с 15 по 25 мин эксперимента, в то время как у соединения 2а он был несколько смещен и регистрировался с 25 по 35 мин эксперимента (рис. 3Б).
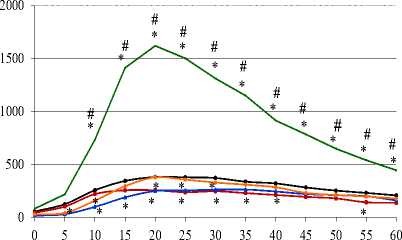
Контроль Иммобилизация 2ч 1а+иммобили
1б+иммобилизация 2а+иммобилизацияС
* # * #
* #
# *
# *
## #
#
#
* #
# *
* #
#
*
*
#
##
# **
*
* #
# # * #
* * # * #
#
#
* # #
* # *
# # *
*
0 5 10
#
*
**** ****
15 20 25 30 35 40 45 50 55 60
Контроль
Иммобилизация 6ч 1а+иммобилизация
1б+иммобилизация 2а+иммобилизация
А
Б
Рис. 3. Влияние соединений 1а, 1б, 2а на стимулированную продукцию активных форм кислорода лейкоцитами в условиях двухчасовой (А) и шестичасовой (Б) иммобилизации.
* - p <0.05 к контролю, # - p <0.05 к стрессу, количество животных: в контрольной при двухчасовой иммобилизации n=8, в остальных группах n=9. По оси y – относительные единицы люминисценции, по оси x – время
[The effect of compounds 1a, 1b, 2a on the stimulated production of reactive oxygen species by leukocytes under conditions of two-hour (A) and six-hour (B) immobilization]
Таким образом, введение натриевых солей пирроло[3,4- с ]-пиразол-3-онов ( 1а-б ) и 1-фенилпиразол-3-карбоксамида ( 2а ) нивелировало вызванное шестичасовой иммобилизацией угнетение поглотительной активности лейкоцитов и отменяло угнетение продукции АФК, вызванное двух- и шестичасовым иммо-билизационным воздействием.
Через 15 б а количество активных фагоцитов увеличивалось по сравнению с контролем. Исследуемые соединения (1а-б , 2а ), введенные на ф ю активность лейкоцитов ис. 4).
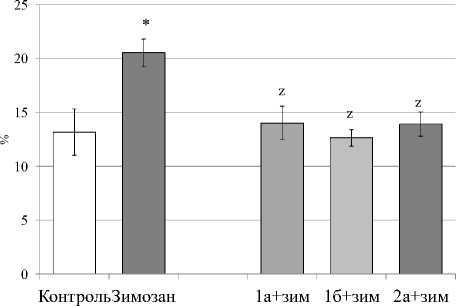
Рис. 4. Влияние соединений 1а, 1б, 2а на поглотительную активность перитонеальных лейкоцитов в модели острого воспаления.
По оси ординат – процент лейкоцитарного фагоцитоза, * - p <0.05 к контролю, z - p <0.05 к группе «зимозан», a - p <0.05 к группе «1б+зимозан», количество животных в каждой группе n=10
[Effect of compounds 1a, 1b, 2a on the absorptive activity of peritoneal leukocytes in an acute inflammation model]
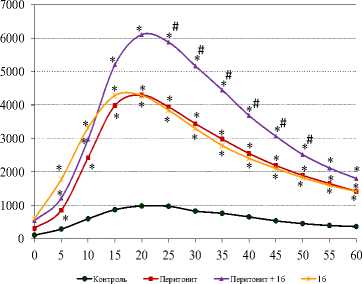
На фоне зимозанового перитонита продукция активных форм кислорода повышалась, что вполне объяснимо и связано со стимулирующим влиянием введенного зимозана на функциональную активность фагоцитирующих клеток [Шилов и др., 2021]. Соединение 1б , введенное на фоне зимозанового перитонита, не отменяло стимулирующего эффекта последнего и, начиная с 25 мин наблюдения, усиливало активирующее влияние зимозана на продукцию АФК. На фоне самостоятельного введения 1б продукция активных кислородных радикалов была выше значений контроля (рис. 5А). Натриевая соль пирроло[3,4- с ]-пиразол-3-она 1а как при самостоятельном введении, так и при введении на фоне зимозанового перитонита стимулировала продукцию активных радикалов по сравнению с контролем (рис. 5Б). Соединение
2а проявляло сходную с 1а и 1б направ кислородных радикалов лейкоцитами (ри
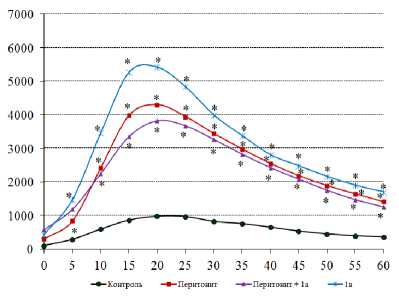
A
Б
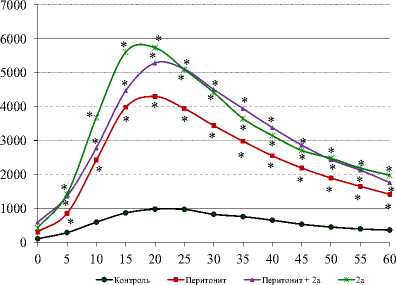
В
Рис. 5. Влияние соединений 1а (А), 1б (Б), 2а (В) на стимулированную продукцию активных форм кислорода лейкоцитами в модели острого воспаления.
* - p < 0,05 к контролю, # - р < 0,05 к стрессу; количество животных в группах: контрольной - 8, с зимозановым перитонитом – 10, в опытных для 1а, 1б – 10, в опытных для 2а – 7. По оси y – относительные единицы люминисценции, по оси x – время
[The effect of compounds 1a (A), 1b (B), 2a (C) on the stimulated production of reactive oxygen species by leukocytes in a model of acute inflammation]
Таким образом, в модели острого воспаления натриевые соли пирроло[3,4- с ]-пиразол-3-онов ( 1а-б ) и 1-фенилпиразол-3-карбоксамида ( 2а ) отменяли стимулирующий эффект зимозана на поглотительную активность лейкоцитов и не приводили к изменению повышенной продукции активных радикалов.

![Влияние натриевых солей пирроло[3,4-с]-пиразол-3-онов и 1-фенилпиразол-3-карбоксамида на функциональную активность клеток врожденного иммунитета в экспериментальных моделях патологических состояний у мышей Влияние натриевых солей пирроло[3,4-с]-пиразол-3-онов и 1-фенилпиразол-3-карбоксамида на функциональную активность клеток врожденного иммунитета в экспериментальных моделях патологических состояний у мышей](/file/cover/147252652/vlijanie-natrievyh-solej-pirrolo-34-spirazol-3-onov-i.png)
