Влияние нефракционированного гепарина и сулодексида на состояние системы гемостаза у больных, оперированных по поводу злокачественных новообразований желудочно-кишечного тракта
Автор: Садчиков Дмитрий Владимирович, Долматова Светлана Александровна, Вартанян Тигран Суренович
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Анестезиология и реаниматология
Статья в выпуске: 3 т.4, 2008 года.
Бесплатный доступ
Проведён сравнительный анализ влияния нефракционированного гепарина и сулодексида на состояние системы гемостаза у больных со злокачественными новообразованиями желудочно-кишечного тракта. Показано, что оба препарата оказывают антикоагулянтный эффект и в равной степени могут быть использованы в качестве средств противотромботической профилактики у онкологических больных.
Гепарин, сулодексид, система гемостаза, злокачественные новообразования желудочно-кишечного тракта
Короткий адрес: https://sciup.org/14916783
IDR: 14916783
Текст научной статьи Влияние нефракционированного гепарина и сулодексида на состояние системы гемостаза у больных, оперированных по поводу злокачественных новообразований желудочно-кишечного тракта
Повышение эффективности профилактики тромбоэмболических осложнений у больных онкологического профиля остаётся актуальной проблемой современной медицины. Известно, что в структуре смертности он^оло^ичес^ие заболевания занимают одно из первых мест, при этом на втором месте по причинам летальности онкологических больных стоит тромбоэмболия легочной артерии, что и определяет актуальность профилактики тромбоэмболических осложнений уданной категории больных. [1]. Это вполне объяснимо, так как среди заболеваний, осложнившихся развитием тромбоэмболии легочной артерии, на долю злокачественных новообразований приходится 30%, кардиальной и цереброваскулярной патологий - соответственно 28% и 26% [8, 9, 11]. Более того, по данным [6], тромбоэмболические осложнения у онкологических больных встречаются в 3 раза чаще, чем у больных другими заболеваниями. Ведущую роль в пато^енезе тромботичес^их осложнений ^ больных со злокачественными новообразованиями играют изменения гемостаза, вызываемые как самой опухолью, так и методами лечения - хирургическим, химиотерапевтическим, гормональным [6].
Высокий риск образования венозных и артериальных тромбозов у онкологических больных обусловлен претромботическим состоянием системы гемостаза (тромбофилией) и наличием опухолевой ткани, обладающей высокими тромбогенными свойствами. В системе гемостаза при злокачественных новообразованиях различных локализаций происходят изменения, связанные со снижением антитромбоген-ной активности стенки сосудов, повышенным освобождением из стенки сосудов в кровь фактора Виллебранда и ингибитора активатора плазминогена PAI-1, усилением функциональной активности тромбоцитов, увеличением концентрации в крови фибриногена, факторов VII и VIII, снижением антикоагулянтной активности крови (антитромбина III, протеинов С и S, тромбомодулина сосудистой стенки), угнетением фибринолитической активности крови. Особое значение в развитии тромбоза придают фактору «некроза опухоли», способствующему выбросу большого количества тромбопластина, что приводит к формированию предтромботичес^о^о состояния ^ больных [6,7,10].
Повреждение сосудистой стенки - одна из главных причин образования ^емостатичес^о^о тромба и внутрисосудистоготромбогенеза. [3,4]. Однако существующие методы профилактики тромбоэмболических осложнений основаны на применении в основном антикоагулянтов прямого и непрямого действия, антиагрегантов, корригирующих коагуляционный потенциал крови и функциональное состояние тромбо цитов, при этом состояние сосудистой стенки не учитывается.
Препаратом, способным, наряду с антикоагулянтным и фибринолитическим действиями, оказывать ангиопротективное влияние, является «Вессел Дуэ Ф» (производства «Alfa Wassermann S.p.A.», Италия), активное вещество которого - сулодексид представляет собой сочетание ^епариноподобной фра^ции и дерматан-сульфата. Сулодексид отличается высокой степенью тропизма к эндотелиальным клеткам, о чём свидетельствует тот факт, что в эндотелии сосудов обнаруживается 90% препарата и его концентрация в нём в 20-30 раз выше, чем в других органах. Таким образом, сулодексид представляет существенный интерес ^а^ средство профила^ти^и тромботичес^их осложнений у онкологических больных [2].
Цель исследования - сравнение влияний гепарина и сулодексида на коагуляционные, фибринолитические свойства плазмы крови и состояние сосудисто-тромбоцитарного звена системы гемостаза в динамике хирургического лечения больных со злокачественными опухолями желудочно-кишечного тракта.
Пациенты были разделены на 2 группы - сравнения и основную. В табл. 1 представлена характеристика этих групп. Обращает на себя внимание то, что в группе сравнения доля больных с III-IV стадиями рака составила 67,5%, а в основной группе - 48,6%. Вместе с тем в группе сравнения отсутствовали больные с венозными тромбозами в анамнезе, в то время как в основной группе их было 4 (11,5%).Отличия также касались предоперационной лучевой терапии: в основной группе было 4 (11,4%), а в группе сравнения они отсутствовали. Одним из механизмов активации системы гемостаза при лучевой терапии является повреждение сосудистых эндотелиальных клеток, прямая активация тромбоцитов, снижение фибринолитической активности, освобождение прокоагулянтов из опухолевых клеток [6].
Больные группы сравнения получали нефракци-онированный гепарин подкожно в дозе по 5000 МЕ за 12 часов до и через 12 часов после операции, а затем в течение
7-10 дней по 5000 МЕтри раза в сутки. Пациентам основной группы внутривенно вводили препарат Вессел Дуэ Ф в дозе по 600 ЛЕ (объём 1 ампулы), предварительно растворяя его в 200 мл 5%-го раствора глюкозы или 200 мл 0,9%-го раствора хлорида натрия за 12 часов до операции и в той же дозе через 6 часов после операции, последующие инъекции проводили в течение 7-10 суток послеоперационного периода, а затем переходили на назначение препарата внутрь по 250 ЛЕ два раза в день - утром и вечером.
Все больные обследованы по общепринятом^ протоколу. Кроме того, проводили развернутое исследование системы гемостаза, включавшее в себя определение числа тромбоцитов в периферичес^ой крови, резистентности капилляров, количества десквамированных эндотелиальных клеток (ДЭК) в крови по методу J.Hladovec (1978) [5] для оценки степени повреждения сосудистой стенки, активированного частичного тромбопластинового времени (АЧТВ), протромбинового отношения (ПО), протромбинового индекса (ПТИ), тромбинового времени (ТВ), уровня фибриногена, времени ХНа-зависимого фибринолиза, содержания Д-димеров и растворимых фибринмономерных комплексов (РФМК). Все эти параметры определяли до операции, а также на 2-е и 7-10-е сутки послеоперационного периода на фоне применения антикоагулянтной терапии. Методы исследования описаны [2]. Использовали тест-наборы фирмы «Ренам» (Москва). В качестве контрольных цифр параметров системы гемостаза использовали результаты, полученные при исследовании коагуляционных свойств крови 20 практически здоровых людей в возрасте от 40 до 50 лет.
Полученные цифровые данные подвергали статистической обработке методом вариационной ста-тисти^и с ^четом оцен^и распределения пол^ченных данных на соответствие нормальному закону распределения. Проводили подсчет средней арифметической (М), средней ошибки средней арифметической (m). Для определения достоверности отличий между группами использовали вычисление парного t- критерия Стьюдента с определением статистической значимости полученных результатов (Р). Нулевую гипотезу отрицали при P < 0,05.
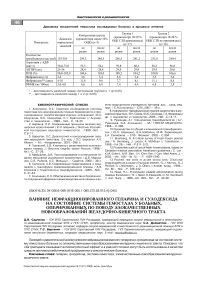
Результаты и их обсуждение. Сравнение показателей системы гемостаза в дооперационном пери- оде ^ больных ^р^пп сравнения и основной ^р^ппы с данными контрольной группы показало, что у всех пациентов угнетён фибринолиз, в крови циркулируют в повышенных количествах растворимые фибрин-мономерные комплексы и десквамированные эндотелиальные клетки (табл.2). У больных основной ^р^ппы ^ том^ же нес^оль^о снижена а^тивность факторов протромбинового комплекса. При сопоставлении коагулограмм больных обеих групп отличия касаются только более низкой активности факторов протромбиново^о ^омпле^са и более высо^о^о количества десквамированных эндотелиальных клеток у представителей основной группы по сравнению с группой сравнения. Вероятно, выявленные отличия в количестве десквамированных эндотелиальных клеток связаны с тем, что среди больных основной группы было больше лиц, имевших сопутствующую патологию, - сахарный диабет и ишемическую болезнь сердца в различных вариантах, - заболевания, системно влияющие на сосудистый эндотелий и сопровождающиеся повреждением эндотелиальной выстилки, маркером которого является изменение содержания циркулирующих, десквамированных эн-дотелиоцитов в крови [5]. Однако по большинству показателей коагулограммы, отражающих состояние системы гемостаза, наблюдаемые группы больных полностью сопоставимы, что явилось основанием для проведения сравнительной оцен^и анти^оа^^лянтной эффе^тивности нефра^ционированно^о ^епарина (группа сравнения) и сулодексида (основная группа), используемых в качестве средств противотромботи-ческой профилактики у онкологических больных.
Под влиянием нефра^ционированно^о ^епарина (табл.3) у больных группы сравнения, начиная со 2-х суток наблюдения и в течение последующих 7-10, снизилась активность факторов внешнего механизма образования протромбиназы (увеличение про-тромбиново^о отношения и ^меньшение величины протромбинового индекса). К 7-10 суткам, несмотря на противотромботическую профилактику, наблюдалось повышение уровня фибриногена в крови, кэто-м^ сро^^ ^силивались антитромбиновая а^тивность крови (увеличение тромбинового времени) и фибринолиз. Следует отметить, что в послеоперационном периоде даже на фоне ^епаринопрофила^ти^и наблюдался количественный рост содержания растворимых фибрин-мономерных комплексов и Д-диме-ров в крови, свидетельствующий о деградации фибриногена и фибрина в процессе их усиленного протеолиза тромбином и плазмином. Хирургическая агрессия привела к повышению количества циркули-р^ющих дес^вамированных эндотелиальных ^лето^ и к снижению резистентности капилляров. Полученные результаты свидетельствуют о том, что противо-тромботический эффект гепарина оказался опосредован через угнетение внешнего механизма образования протромбиназы,усиление антитромбиновой и фибринолитической активности крови. Вместе с тем ^епарин не смо^ защитить эндотелиальные ^лет^и от дальнейшего их повреждения.
В отличие от гепарина сулодексид у больных основной группы, наряду с внешним механизмом образования протромбиназы, вызвал угнетение и внутреннего (удлинение АЧТВ), при этом практически не изменился ^ровень фибрино^ена в ^рови в течение всего наблюдения. Сулодексид не оказал влияния на антитромбиновую активность плазмы крови, однако уже со 2-х суток прогрессивно активизировал её фибринолитическую активность. Как и гепарин, Весел Дуэ Ф не оказался способным противостоять снижению резистентности ^апилляров и сдержать рост растворимых фибрин-мономерных комплексов в крови, однако достоверно снизил количество в ней десквамированных эндотелиальных клеток. Таким образом, сулодексид своё противотромботическое действие реализует преимущественно через механизмы подавления активности внутреннего и внешнего пути образования протромбиназы, активацию фибринолиза и защиту эндотелиальных клеток.
Сравнение действия ^епарина и с^лоде^сида на показатели системы гемостаза у онкологических больных с высоким риском послеоперационного венозного тромбоза дало основание подчеркнуть наиболее значимые механизмы противотромботичес^ой эффективности этих препаратов. Оказалось, что сулодексид более эффективно, чем гепарин, подавляет а^тивность фа^торов вн^тренне^о и внешне^о механизмов образования протромбиназы, что, по всей видимости, сдерживает образование белка острой фазы фибрино^ена ^ больных в ближайшем послеоперационном периоде. Кроме того, сулодексид отчётливо активизирует XIIa-зависимый фибринолиз, что является одним из факторов угнетения превращения фибриногена в фибрин. И, наконец, сулодексид в отличие от гепарина проявляет ангиоп-ротективное действие, защищая эндотелиальные клетки от повреждения. Возможно, в силу указанных свойств с^лоде^сида ^ больных основной ^р^ппы мы не наблюдали эпизодов послеоперационного венозного тромбоза, в то время как в группе сравнения у одного больного, получавшего с профилактической целью нефракционированный гепарин, развилась тромбоэмболия легочной артерии.
Наш опыт показал, что при использовании суло-дексида не было выявлено никаких послеоперационных гемокоагуляционных осложнений (больших и малых кровотечений, ДВС-синдрома). Препарат, сохраняя коагуляционный механизм, обеспечивает профилактику венозного тромбоза, что особенно важно у больных с предполагаемой и действительной интраоперационной кровопотерей, у больных с высоким анестезиологическим риском, исходной тромбоцитопенией на фоне лучевой терапии и её повреждающим действием на эндотелиальные клетки сосудов. Применение гепарина ограничено в предоперационном периоде, поскольку увеличивает риск послеоперационных кровотечений, провоцируя тромбоцитопению и гипокоагуляцию.
Таким образом, коррекция только коагуляционного звена плазменного гемостаза недостаточна для профилактики тромбоэмболических осложнений у онкологических больных. Необходимо учитывать состояние сос^дистой стен^и на момент оперативно^о вмешательства. Ретроспективный анализ функционально-биохимических данных у больных с развившейся в послеоперационном периоде тромбоэмболией ле^очной артерии выявил прям^ю линейн^ю зависимость развития тромбоэмболии легочной артерии от объема оперативно^о вмешательства (r=+0,0584613), продолжительности операции (r=+0,440225), продолжительности наркоза (r=+0,430106) и интраоперационной кровопотери (r=+0,600925). При выявлении повреждения сосудистой стенки в предоперационном периоде необходимо включение в профилактику послеоперационного венозного тромбоза и тромбоэмболии легочной артерии препарата ^омпле^сно^о воздействия на стенку сосудов и коагуляционный гемостаз.
Выводы:
-
1. Сулодексид, также как и гепарин, оказывает антикоагуляционный эффект. В отличие от гепарина с^лоде^сид обладает противотромботичес^им действием, которое он реализует преимущественно через механизмы подавления активности внутреннего и внешнего пути образования протромбиназы. Сулодексид существенно, в отличие от гепарина, активирует фибринолиз, тем самым снижает риск развития различного рода тромботических состояний, проявляя свое профибринолитическое действие. И, наконец, он восстанавливает структуру и функциональную целостность эндотелия, снижая количество десквамированных эндотелиальных клеток в периферической крови, тем самым повышая её антитромбогенность и тромборезистентность, чего нет у гепарина.
-
2. Состояние сосудистой стенки до операции у больных онкологического профиля должно учитываться при назначении ^омпле^сной профила^ти^и тромбоэмболических осложнений. Критерием состояния сосудистой стенки является определение количества десквамированных (циркулирующих) эндотелиальных клеток в крови.
-
3. У большинства больных онкологического профиля в предоперационном периоде имеется повреждение сосудистой стенки. Значительно чаще повреждение эндотелия встречается в сочетании с сопутствующей сосудистой патологией, сахарным диабетом, сопровождающихся системным повреждением эндотелия.
Таблица 1
Исходная характеристика онкологических больных в группе наблюдения
|
Характеристика |
Группа сравнения абс., % |
Основная группа абс., % |
|
Число больных |
40 (100,0%) |
35 (100,0%) |
|
Средний возраст, лет |
62,0±1,6 |
64,0±1,7 |
|
Пол: муж. жен. |
19 (47,5%) 21 (52,5%) |
14 (40,0%) 21 (60,0%) |
|
Рост |
168,0±1,3 |
166,0±1,5 |
|
Вес |
72,0±2,3 |
73,4±2,6 |
|
Индекс массы Кетле |
25,4±0,71 |
27,0±0,9 |
О^ончание табл. 1
Таблица 2
Исходные параметры системы гемостаза в контрольной, сравнения и основной группах
|
Показатели системы гемостаза |
Контрольная группа (n=20) |
Группа сравнения (n=40) |
Основная группа (n=35) |
|||
|
M ± m |
P 1 |
M ± m |
P 1 |
P 2 |
||
|
АЧТВ, с |
29,2±0,7 |
31±0,5 |
>0,05 |
30±0,6 |
>0,05 |
>0,05 |
|
ПО, усл.ед. |
1,0±0,01 |
1,0±0,01 |
>0,05 |
1,03±0,01 |
<0,001 |
<0,01 |
|
ПТИ, % |
102,2±1,2 |
103±1,3 |
>0,05 |
98,0 ±1,4 |
<0,05 |
<0,01 |
|
Фибриноген, г/л |
3,2±0,4 |
4,0±0,2 |
>0,05 |
4,0±0,2 |
>0,05 |
>0,05 |
|
ТВ, с |
15,3±0,3 |
16,0±0,2 |
>0,05 |
16,5±0,4 |
>0,05 |
>0,05 |
|
XIIa-зависимый фибринолиз, мин |
7,2±0,3 |
15,0±0,2 |
<0,001 |
14,3±0,3 |
<0,001 |
>0,05 |
|
РФМК, г/л 10-2 |
4±0,01 |
6,7±0,4 |
<0,001 |
6,9±0,5 |
<0,001 |
>0,05 |
|
Д-димеры, мкг/мл |
0,3±0,02 |
0,5±0,2 |
>0,05 |
0,6±0,3 |
>0,05 |
>0,05 |
|
ДЭК, кл./100мкл |
2,3±0,2 |
4,0±0,3 |
<0,05 |
8,3±1,5 |
<0,05 |
<0,01 |
|
Резистентность капилляров, абс.ч. |
2,0±1,0 |
5,0±0,4 |
>0,05 |
4,4±0,6 |
>0,05 |
>0,05 |
|
Тромбоциты, ^ х 10 9 /л |
232,1±4,0 |
247±12 |
>0,05 |
257±13 |
>0,05 |
>0,05 |
Примечание: P 1 - достоверность по отношению к данным контрольной группы; Р2- достоверность по отношению к данным группы сравнения.
Таблица 3
По^азатели системы ^емостаза ^ больных ^р^ппы сравнения и основной ^р^ппы в процессе проведения специфичес^ой противотромботичес^ой профила^ти^и ^епарином и с^лоде^сидом
|
Показатели системы гемостаза |
Сроки исследования до и в процессе проведения противотромботической профилактики |
Группа сравнения (n=40) |
Основная группа (n=35) |
P (между группами) |
|
АЧТВ, с |
До |
31±0,5 |
30±0,6 |
p>0,05 |
|
2-е сутки |
31,02±1,0 |
33±1,1* |
p>0,05 |
|
|
7-10-е сутки |
32±0,6 |
34±1*** |
p<0,05 |
|
|
ПО, усл.ед. |
До |
1,0±0,01 |
1,03±0,01 |
p<0,05 |
|
2-е сутки |
1,12±0,03* |
1,14±0,03*** |
p>0,05 |
|
|
7-10-е сутки |
1,1±0,01* |
1,2±0,03*** |
p<0,01 |
|
|
ПТИ, % |
До |
103±1,3 |
98±1,4 |
p<0,05 |
|
2-е сутки |
89±1,7*** |
89±1,7*** |
p>0,05 |
|
|
7-10-е сутки |
92,2±1,03*** |
89±2*** |
p>0,05 |
|
|
Фибриноген, г/л |
До |
3,8±0,2 |
3,9±0,2 |
p>0,05 |
|
2-е сутки |
4,02±0,2 |
4±0,2 |
p>0,05 |
|
|
7-10-е сутки |
4,2±0,2* |
3,6±0,2 |
p<0,05 |
|
|
ТВ, с |
До |
16±0,2 |
16,5±0,4 |
p>0,05 |
|
2-е сутки |
16,2±0,3 |
16,4±0,4 |
p>0,05 |
|
|
7-10-е сутки |
17±0,3* |
17,2±0,4 |
p>0,05 |
|
|
XIIa-зависимый фибринолиз, мин. |
До |
15±0,2 |
14,3±0,3 |
p>0,05 |
|
2-е сутки |
14,6±0,3 |
10,4±0,4*** |
р<0,001 |
|
|
7-10-е сутки |
13,4±0,4*** |
9±0,3*** |
р<0,001 |
|
|
РФМК, г/л • 10 2 |
До |
7±0,4 |
7±0,5 |
p>0,05 |
|
2-е сутки |
11,3±0,7*** |
13±0,9*** |
p>0,05 |
|
|
7-10-е сутки |
12±0,7*** |
14±1,01*** |
p>0,05 |
|
|
Д-димеры, мкг/мл |
До |
0,5±0,02 |
0,6±0,1 |
p>0,05 |
|
2-е сутки |
0,8±0,1*** |
0,9±0,1** |
p>0,05 |
|
|
7-10-е сутки |
0,7±0,1*** |
0,8±0,1* |
p>0,05 |
|
|
ДЭК, кл/100 мкл |
До |
4±0,3 |
8,3±1,5 |
p<0,01 |
|
2-е сутки |
5,5±0,4*** |
5,4±0,5* |
p>0,05 |
|
|
7-10-е сутки |
6±0,4*** |
4,2±0,2** |
p<0,001 |
|
|
Резистентность капилляров, абс.ч. |
До |
5±0,4 |
4,4±0,6 |
p>0,05 |
|
2-е сутки |
9,4±0,4*** |
9±0,8*** |
p>0,05 |
|
|
7-10-е сутки |
9±0,6*** |
9±0,8*** |
p>0,05 |
|
|
Тромбоциты, • хЮ^ /л |
До |
247±12 |
257±13 |
p>0,05 |
|
2-е сутки |
231±10,4 |
236,2±12 |
p>0,05 |
|
|
7-10-е сутки |
258,2±15 |
246±16 |
p>0,05 |
Примечание: * достоверность по отношению к дооперационным данным накануне проведения специфической про-тивотромботичес^ой профила^ти^и (*p<0,05; ** p<0,01; ***p<0,001).
Список литературы Влияние нефракционированного гепарина и сулодексида на состояние системы гемостаза у больных, оперированных по поводу злокачественных новообразований желудочно-кишечного тракта
- Балуда, М.В. Профилактика тромбоза гепарином у больных раком/М.В. Балуда//Российский онкологический журнал. -2001. -№ 5. -С. 53-55.
- Баркаган, З.С. Диагностика и контролируемая терапия нарушений гемостаза/З.С. Баркаган, А.П. Момот. -М.: Ньюдиамед, 2001. -325 с.
- Затейщикова, А.А. Эндотелиальная регуляция сосудистого тонуса: методы исследования и клиническое значение/А.А.Затейщикова, Д.А.Затейщиков//Кардиология. -1998. -№ 9. -С. 68-80.
- Кудряшова, О.Ю. Эндотелиальный гемостаз: система тромбомодулина и ее роль в развитии атеросклероза и его осложнений/О.Ю. Кудряшова, Д.А. Затейщиков, Б.А.Сидоренко//Кардиология. -2000. -№ 8. -С. 65-74.
- Петрищев, Н.Н. Диагностическая ценность определения десквамированных эндотелиальных клеток в крови/Н.Н. Петрищев, О.А. Беркович, Т.Д. Власов и др.//Клиническая лабораторная диагностика. -2001.-№ 1.-С. 50-52.
- Сомонова, О.В. Тромботические осложнения и их профилактика низкомолекулярными гепаринами у онкологических больных/О.В.Сомонова, А.В. Маджуга, А.Л. Елизарова и др.//Сопроводительная терапия в онкологии. -2005. -№ 1. -С. 42-45.
- Шилова, А.Н. Сравнительное изучение эффективности профилактического применения нефракционированного и низкомолекулярного гепаринов при хирургическом лечении онкологических больных/А.Н. Шилова, С.А. Ходоренко, П.А. Воробьев и др.//Клиническая геронтология. -2002.-№ 4.-С 11-17.
- Яковлев, В.Б. Тромбоэмболия легочной артерии/В.Б. Яковлев, М.В.Яковлева//Кардиология. -2000. -№ 1. -С. 75-82.
- Яковлев, В.Б. Диагностика и лечебная тактика при тромбоэмболии легочной артерии/В.Б.Яковлев//Клиническая медицина. -1997. -№ 11. -С. 64-69.
- Arcasoy, S.M. Local and systemic thrombolitic therapy for acute venous thromboembolism/S.M. Arcasoy, A. Vachani//Clin. Chest. Med. -2003. -Vol. 24. -№ 1. -P. 73-91.
- Hillen, H.F.P. Thrombosis in cancer patients/H.F.P. Hillen//Ann.Oncol. -2000. -Vol. VII (suppl. 3): ESMO.