Влияние некоторых технологических аспектов in vitro на дедифференциацию неоплодотворенных семязачатков ярового рапса (Brassica napus L.)
Автор: Екатерина Викторовна Чеснокова, Анатолий Анатольевич Муравлев
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 7, 2021 года.
Бесплатный доступ
Цель исследования – изучение влияния стадии развития (размеров), времени обработки бутонов пониженными положительными температурами и генотипа донорного образца на дедифференциацию каллуса из неопыленных семязачатков ярового рапса. Задачи исследования: ввести в культуру in vitro изолированные семязачатки и определить частоту дедифференциации эксплантов на агаризованной питательной среде Мурасиге-Скуга (MS) с добавлением регуляторов роста 2,4-Д (2-4 дихлорфеноксиуксусная кислота) и кинетина по 5,0 мг/л. В качестве объектов исследования использовали неопыленные семязачатки восьми гибридных образцов ярового рапса. Образцы 1 и 2 формировали каллусную ткань с частотой 2,6 и 2,5 % соответственно. Семязачатки, изолированные из бутонов изучаемых размеров (2,0; 4,0; 6,0 мм), отличались частотой дедифференциации каллуса от 11,59 до 16,95 %. Семязачатки, изолированные из бутонов размером 6,0 мм, были наиболее компетентны к каллусообразованию и формировали каллус с максимальной частотой 16,95 %. Обработка соцветий в течение 24, 36 и 60 ч пониженными температурами 4±1 оС не оказывает положительного влияния на формирование каллусной ткани из семязачатков. Частота дедифференциации снижается с 7,29 % без обработки бутонов до 1,24 % при 60-часовой обработке. Результаты культивирования семязачатков на инициальной питательной среде показали, что частота дедифференциации у изучаемых генотипов ярового рапса варьировала от 0,2 (обр. 188) до 2,6 % (обр. 1). Семязачатки, изолированные из донорных растений, полученных с использованием культуры тканей, индуцировали каллусную ткань с частотой 15,57 %. Вторичные структуры и проростки получили на среде МS с добавлением 6-БАП (6-бензиламинопурин) – 0,5 мг/л и кинетина – 3,0 мг/л. Полученные результаты свидетельствуют о влиянии предобработки, размера бутонов и генотипа донорного растения на частоту дедифференциации семязачатков ярового рапса.
Питательная среда, генотип, неопылённые семяпочки, семязачатки, каллусообразование.
Короткий адрес: https://sciup.org/140254558
IDR: 140254558 | УДК: 582.683.2:578.083 | DOI: 10.36718/1819-4036-2021-7-66-72
Текст научной статьи Влияние некоторых технологических аспектов in vitro на дедифференциацию неоплодотворенных семязачатков ярового рапса (Brassica napus L.)
Введение. Рапс яровой ( Brassica napus L.) – ценная масличная и кормовая культура, хорошо приспособленная для возделывания в умеренном климате. С точки зрения физиологии питания человека рапсовое масло имеет преимущество перед другими растительными маслами, так как содержит все физиологически важные кислоты в оптимальном соотношении [1].
Одним из важных элементов повышения продуктивности рапса является возделывание гетерозисных гибридов на стерильной основе. В гетерозисной селекции основным требованием, предъявляемым к родительским формам, является их гомозиготность по большинству генов. Одним из путей получения гомозиготных линий ярового рапса является гаплоидия. При использовании гаплоидии процесс формирования гомозиготных линий по сравнению с традиционными методами селекции сокращается на 5–7 лет [2].
У растений с мужской стерильностью гиногенез является единственным способом получения гаплоидов, так как признак ЦМС передается только с материнской цитоплазмой. Разработка нового регламента получения исходных форм в достаточном количестве и внедрение этих разработок в селекционный процесс будет способствовать получению конкурентоспособных гибридов с комплексом желаемых хозяйственно полезных признаков [3].
Цель исследования: изучение влияния стадии развития семязачатков (размера бутонов), времени обработки бутонов пониженными положительными температурами и генотипа донорного образца на дедифференциацию каллуса из неопыленных семязачатков ярового рапса.
Задачи исследования: ввести в культуру in vitro изолированные семязачатки и определить частоту дедифференциации эксплантов на ага-ризованной питательной среде Мурасиге-Скуга (MS) с добавлением регуляторов роста 2,4-Д
(2-4 дихлорфеноксиуксусная кислота) и кинетина по 5,0 мг/л.
Объекты и методы исследования. В качестве донорного материала использовались гибриды F 1 и образцы, полученные через культуру тканей in vitro . Бутоны собирали с центральной кисти, так как по сравнению с побегами первого и второго порядков они обладают лучшей способностью к каллусообразованию и регенерации растений [4]. Длина бутонов, взятых для исследования, составляла 2,0; 4,0; 6,0 мм.
Для повышения индуцирующей способности неоплодотворенных семязачатков проводили предобработку бутонов низкими положительными температурами. Собранные бутоны помещали в холодильник на 24; 36 и 60 ч при температуре 4+1 ºС. В качестве стерилизующего агента использовался 7 % раствор Domestos, экспозиция бутонов в растворе составляла 10 мин. Затем бутоны 3–4 раза промывались стерильной дистиллированной водой. Изолирование семязачатков проводили в стерильных условиях лами-нар-бокса под бинокулярной лупой (МБС-10). После извлечения из завязей семяпочки помещались на поверхность питательной среды по 16–22 шт. Культивирование неоплодотворенных семяпочек проводилось на поверхности пита- тельной среды Мурасиге и Скуга (МS) с добавлением 2,4-Д (2-4 дихлорфеноксиуксусная кислота) и кинетина по 5,0 мг/л [5]. Культивирование эксплантов проводили при 16-часовом фотопериоде и температуре 25+2 ºС. Наблюдение за культурой и анализ динамики развития проводили каждые 10 дней.
Результаты исследования. При введении в культуру in vitro семяпочки отличались размерами, плотностью оболочек и цветом. Семязачатки, изолированные из бутонов, длиной от 2,0 до 3,0 мм, отличались малыми размерами, имели светлый цвет и почти прозрачные покровы. Семязачатки, изолированные из более крупных бутонов, обладали не только большим размером, но и более плотными оболочками и имели светло-зеленый цвет.
Через неделю культивирования неоплодо-творенные семяпочки увеличились в размерах и благодаря накоплению хлорофилла приобрели темно-зеленый цвет. В этот же период наблюдали начало образования соматического каллуса из клеток фуникулуса, которые не были удалены при изолировании семязачатков (рис. 1). Образовавшийся шероховатый, зеленый, плотный каллус удаляли при пересадке на органогенную среду.

Рис. 1. Развитие неоплодотворенных семязачатков на инициальной питательной среде через 30 сут
Процессы формирования морфогенной кал-лусной ткани из семязачатков протекали медленно. Большая их часть останавливалась в развитии и погибала. Отзывчивые семяпочки на первичной среде формировали морфогенный каллус, а при пересадке на органогенную среду наблюдали формирование как морфогенного каллуса, так и зеленых вторичных новообразований (рис. 2).
Семяпочки, извлеченные из бутонов исследуемых размеров (2,0; 4,0; 6,0 мм), проявляли разную способность к каллусообразованию. Интер- вал отзывчивости составил от 11,59 до 16,95 % (табл. 1). Наиболее компетентными к регенерации оказались семязачатки, извлеченные из бутонов размером 6,0 мм (т. е. содержащие зрелый или почти зрелый зародышевый мешок).
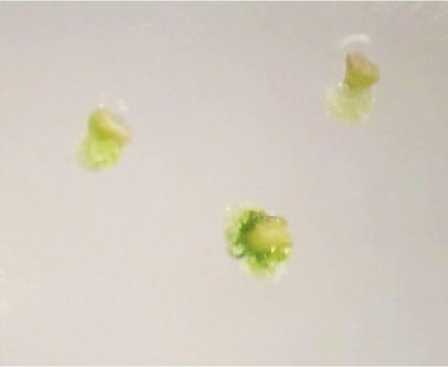
Рис. 2. Дедифференциация семязачатков: а – морфогенный каллус; b – вторичные структуры
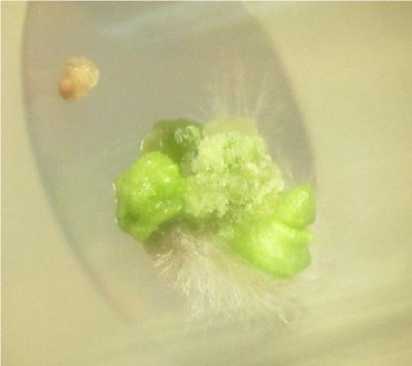
Таблица 1
|
Размер бутонов, мм |
Количество культивируемых семяпочек, шт. |
Частота каллусообразования, % |
|
2,0 |
69 |
11,59 |
|
4,0 |
194 |
12,89 |
|
6,0 |
596 |
16,95 |
|
НСР 0,05 |
0,05 |
|
Влияние размера бутонов на инициацию гиногенеза ярового рапса in vitro
Полученные данные согласуются с целым рядом отечественных научных работ, где показано, что разные виды покрытосеменных растений имеют различные оптимальные стадии развития зародышевого мешка для инициации гиногенеза и переключения программы развития с гаметофитного на спорофитный путь. Например, исследования, проводившиеся на огурце ( Cucumis sativus L . ) [6] и сахарной свекле ( Beta vulgaris L.), также показали, что изолированные неоплодотворенные семяпочки в условиях in vitro способны к новообразованиям на всех этапах развития [7]. Но наиболее предпочтительными являются семязачатки, имеющие зрелый или почти зрелый зародышевый мешок.
Эффект от обработки бутонов пониженными положительными температурами (4±1 ºС) имел обратную зависимость от длительности воздействия. Наибольшую отзывчивость проявляли семязачатки, которые не подвергались воздействию пониженных температур (табл. 2). Обработка соцветий свыше 24 ч приводила к снижению степени дедифференциации семяпочек in vitro .
Зависимость регенерационной способности семязачатков от температурного воздействия была отмечена и на других культурах. Так, в исследованиях, проводившихся на сахарной свекле, авторы отмечали некоторое увеличение регенерационной способности при предварительной обработке пониженной температурой [8].
Таблица 2
|
Время предобработки, ч |
Количество культивируемых семяпочек, шт. |
Частота каллусообразования, % |
|
Без обработки |
2319 |
7,29 |
|
24 |
2955 |
6,67 |
|
36 |
1871 |
1,76 |
|
60 |
1208 |
1,24 |
|
НСР 0,05 |
0,14 |
|
Влияние предобработок бутонов пониженными положительными температурами на дедифференциацию неоплодотворенных семяпочек ярового рапса
В таблице 3 представлены результаты культивирования семязачатков гибридных образцов ярового рапса, используемых в исследовании. Изучаемые генотипы обладают различной способностью к дедифференциации семяпочек в культуре in vitro. Частота дедифференциации у исследуемых образцов составила от 0,2 (обр. 188) до 2,6 % (обр. 1). Наибольшей отзывчивостью отличаются образцы 1 и 2, у которых наблюдалась дедифференциация семяпочек 2,6 и 2,5 % соответственно. Различия между этими образцами несущественны.
Таблица 3
|
Номер образца |
Количество культивируемых семяпочек, шт. |
Частота каллусообразования, % |
|
1 |
1138 |
2,6 |
|
2 |
827 |
2,5 |
|
185 |
639 |
0,5 |
|
186 |
1117 |
0,9 |
|
187 |
1741 |
1,0 |
|
188 |
927 |
0,2 |
|
189 |
788 |
1,0 |
|
190 |
1559 |
1,5 |
|
Всего |
8536 |
1,37 |
|
НСР 0,05 |
0,45 |
|
Отзывчивость гибридных образцов в культуре in vitro
Известно, что образцы, полученные с использованием культуры тканей in vitro, способны изменять статус генотипа донорного растения. Возникают генетические вариации – важная составляющая любой селекционной программы [9]. В таблице 4 показаны результаты культивирования неопыленных семяпочек из донорных растений, полученных через гиногенез (ГГ), ан-дроклинию (АЛ) и каллусогенез (R – из каллуса листового эксплантата). Средняя частота кал-лусообразования у образцов, прошедших через культуру тканей, существенно выше (15,57 %), чем у исходных образцов (1,37 %). Особенно это видно при дедифференциации каллуса у донорного образца № 190 – 1,5 % и биотехнологических линий ГГ 190 – 29,7 % и АЛ 190 – 10,2 % (табл. 3, 4).
Таблица 4
|
Номер образца |
Количество культивируемых семяпочек, шт. |
Частота каллусо-образования, % |
|
ГГ 404 |
53 |
7,54 |
|
ГГ 440 |
154 |
6,49 |
|
R 404 |
204 |
8,33 |
|
ГГ 190 |
306 |
29,7 |
|
АЛ 190 |
195 |
10,2 |
|
912 |
15,57 |
|
|
НСР 0,05 |
2,92 |
|
Отзывчивость образцов, полученных через культуру тканей in vitro
Морфогенные каллусы, полученные на инициальной среде, а также вторичные структуры культивировали на среде MS с добавлением 6-БАП – 0,5 мг/л и кинетина – 3,0 мг/л, формировали меристематические зоны и проростки.
Выводы . В ходе настоящего исследования было установлено, что лучшая частота дедиф-фенренциации семязачатков ярового рапса получена при изолировании их из бутонов размером 6 мм. Предобработка пониженными положительными температурами (4±1 ºС) ингибирует развитие образования каллуса с 7,29 до 1,24 %. Также на дедифференциацию семязачатков влияет генотип донорного образца и способ их получения.
Список литературы Влияние некоторых технологических аспектов in vitro на дедифференциацию неоплодотворенных семязачатков ярового рапса (Brassica napus L.)
- Ackman R.G. Canola fatty acids: an ideal mix-ture for health, nutrition and food use // F. Shahidi (ed.), Canola and Rapeseed: Produc-tion, Chemistry, Nutrition and Processing Technology. Van Nostrand Reinhold, New York. 1990. Р. 81–98.
- Ellialtioglu S., Sari N., Abak K. Production of haploid plants // In: Babaoglu M., Gazel E., Ozcan S. (eds) Plant biotechnology I, Selcuk Univ. Press. 2001. P. 137–189.
- Жужжалова Т.П., Колесникова Е.О., Черка-сова Н.Н. и др. Перспективные технологии изолированных тканей в селекционном процессе сахарной свеклы // Российская сельскохозяйственная наука. 2018. № 6. С. 13–18.
- Котлярова Е.Б. Аспекты применения мето-дов биотехнологии в селекции ярового рап-са (Brassica napus L.): автореф. дис. … канд. биол. наук: 06.01.05. Рамонь, 2007. 24 с.
- Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tis-sue cultures // Physiol plant. 1962. V. 15. P. 215–222.
- Шмыкова Н.А., Супрунова Т.П. Индукция гиногенеза в культуре in vitro неопыленных семяпочек Cucumis sativus L. // Гавриш. 2009. № 4. С. 40–44.
- Жужжалова Т.П. , Подвигина О.А., Знамен-ская В.В. и др. Гаплоидный партеногенез in vitro у сахарной свеклы (Beta vulgaris): фак-торы и диагностические признаки // Сель-скохозяйственная биология. 2016. Т 51, № 5. С. 636–644.
- Васильченко Е.Н., Колесникова Е.О., Жуж-жалова Т.П. Возможность создания гомози-готного материала сахарной свеклы в куль-туре in vitro // Наука и образование: отече-ственный и зарубежный опыт: сб. тр. Сем-надцатой междунар. науч.-практ. конф. Белгород, 2019. С. 259–262.
- Mohan J. Tissue culture-derived variation in crop improvement // Euphytica. 2001. 118. P. 153–166.


