Влияние низкоинтенсивного лазерного излучения с длиной волны 1265 нм на уровень активных форм кислорода и систему ПОЛ - АОЗ в культурах клеток CHO-K1 и A875
Автор: Хохлова А.В., Полуднякова Л.В., Федотова А.Ю., Столяров Д.А., Гильмутдинова А.К., Погодина Е.С., Саенко Ю.В., Антонеева И.И., Белобородов Е.А.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Ближнее инфракрасное лазерное излучение обладает значительно большей способностью проникать в живые ткани по сравнению с оптическим излучением видимого диапазона и нередко оказывает противоположное действие на нормальные и злокачественные клетки, являясь, таким образом, перспективным инструментом для терапии поверхностных новообразований. Однако механизмы, лежащие в основе взаимодействия лазера и биологических структур, могут иметь различную природу в силу выбранной длины волны, мощности и некоторых других параметров излучения. Цель работы - исследовать влияние лазерного излучения с длиной волны 1265 нм в дозах 9,45-18,9 Дж/см2 на генерацию активных форм кислорода (АФК), уровень ферментов системы антиоксидантной защиты (АОЗ) и перекисного окисления липидов (ПОЛ) в нормальных и раковых клетках на примере линий эпителия яичника китайского хомячка CHO-K1 и меланомы человека A875. Материалы и методы. Эксперимент выполнен на клеточных линиях CHO-K1 и A875, которые облучались источниками лазерного излучения с длиной волны 1265 нм, мощностью 4,2-100 мВт в течение 30-60 мин. Внутриклеточная концентрация АФК изучалась с помощью флуоресцентного окрашивания DCFH-DA, обработка изображений осуществлялась в программе Image]. Уровень продуктов ПОЛ и активность ферментов АОЗ определялись биохимическими методами. Статистическая обработка результатов проводилась с использованием U-критерия Манна-Уитни (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Культура клеток, рак, меланома, низкоинтенсивное лазерное излучение, инфракрасное лазерное излучение, окислительный стресс, митохондрии, активные формы кислорода, перекисное окисление липидов, антиоксидантная защита
Короткий адрес: https://sciup.org/14117589
IDR: 14117589 | УДК: 57.085.2 | DOI: 10.34014/2227-1848-2020-4-122-132
Текст научной статьи Влияние низкоинтенсивного лазерного излучения с длиной волны 1265 нм на уровень активных форм кислорода и систему ПОЛ - АОЗ в культурах клеток CHO-K1 и A875
Введение. Меланома является самым агрессивным типом рака кожи. Показатель заболеваемости в мире растет ежегодно на 2-7 % [1]. Распространенность заболевания в России в течение 2015–2019 гг. возросла с 56,9 до 66,9 на 100 тыс. населения [2].
Медиана выживаемости пациентов с меланомой составляет всего 6-9 мес., а 5-летняя выживаемость - менее 5 % [3].
Существующие на сегодняшний день способы лечения меланомы кожи требуют высо- котехнологичного подхода, а результаты лечения остаются сложно предсказуемыми. Это обстоятельство делает необходимым поиск новых методов системного и местного лечения. В настоящее время появляются экспериментальные исследования по использованию фотобиомодуляции в терапии меланомы [4, 5].
При поиске эффективных параметров лазерного излучения для терапии меланомы кожи важным аспектом является глубина воздействия, позволяющая максимально затронуть новообразование. Среди спектров оптического излучения инфракрасный обладает максимальной глубиной проникновения [6]. В свою очередь внутриклеточным процессом, ассоциированным с данным диапазоном, является развитие окислительного стресса через продукцию супероксида [7, 8]. Клеточные механизмы, лежащие в основе клеточного адаптивного и/или активирующего окислительного стресса, вызываемого низкоуровневой световой или фото-биомодуляционной терапией, все еще остаются неясными для ближнего инфракрасного спектра (NIR) (750–3000 Нм), особенно для диапазона 1265–1270 Нм (самое высокое поглощение молекулярным кислородом) [9, 10].
Цель исследования. Изучение влияния низкоинтенсивного лазерного излучения с длиной волны 1265 нм на уровень оксидатив-ного стресса и состояние системы перекисного окисления липидов и антиоксидантной защиты в клетках эпителия яичника китайского хомячка и меланомы человека.
Материалы и методы. Для работы были выбраны две культуры клеток эпителиального происхождения: нераковая линия эпителия яичника китайского хомячка CHO-K1 (ATCC® CCL-61™) и линия клеток меланомы человека A-875 (RRID:CVCL_4733).
Клетки культивировали в инкубаторе Sanyo MCO-18AIC (Япония) при влажности 100 %, температуре 37 °C и концентрации CO 2 5 %. До и во время проведения эксперимента клетки содержали в культуральной среде RPMI-1640 («ПанЭко», Россия) с добавлением 10 % эмбриональной бычьей сыворотки (Biosera, Франция) и гентамицина в концентрации 50 мг/л («ПанЭко», Россия).
За 24 ч до эксперимента клетки сеяли в 8-луночные слайд-флаконы (SPL Lifesciences, Южная Корея) в концентрации 105 на ячейку. После прикрепления подвергали воздействию инфракрасного лазерного излучения с длиной волны 1265 нм.
Использовали следующие источники и параметры излучения:
-
1. Перестраиваемый узкополосный лазер Yenista Optics Osics T100 (Франция): длина волны – 1265 нм, мощность – 4,2 мВт, время облучения 30/60 мин, плотность энергии 9,45/18,9 Дж/см2.
-
2. Лазерный диод LD-1265.5-FBG-350 (Innolume, Германия): длина волны 1265 нм, мощность 10/100 мВт, время облучения 30 мин, плотность энергии 22,5/225 Дж/см2. Плотность энергии (E, Дж/см2) лазерного излучения рассчитывали по формуле E=Pt/S, где P – средняя выходная мощность, Вт; t – время облучения, с; S – площадь облучения, см2.
Облучение проводили в камере настольного инкубатора UNO H501-T (Okolab, Италия) в условиях, идентичных условиям культивирования. В то время как одну из ячеек слайд-флакона подвергали облучению, другая (контрольная) была закрыта металлической фольгой для защиты от излучения. Все эксперименты проводили не менее чем в трех повторах.
С помощью флуоресцентной микроскопии определяли концентрацию активных форм кислорода, используя краситель 2’,7’-дихлор-офлуоресцеин-диацетат (DCFH-DA, Sigma-Aldrich, США), как описано ранее [11].
Результат окрашивания оценивали с использованием инвертированного микроскопа Nikon Ti-S, дополненного фотокамерой DS-Qi1MC, объективом Nikon S Plan Fluor ELWD 20×0.45 с соответствующими фильтрами и ПК с программой Nikon NIS-elements 4.0.
Обработку изображений проводили в компьютерной программе ImageJ (Национальный институт здоровья, США). Скорректированную интегральную флуоресценцию клетки (СИФК) рассчитывали по формуле СИФК = интегральная плотность – (площадь выделенной клетки × фоновое значение флуоресценции) [12].
Для определения состояния системы перекисного окисления липидов (ПОЛ) и антиоксидантной защиты (АОЗ) после облучения клетки снимали с использованием 0,25 % раствора трипсин-ЭДТА («ПанЭко», Россия), ре-суспендировали в натрий-фосфатном буфере (pH 7,4) и подсчитывали количество клеток в каждом образце в камере Горяева. Далее натрий-фосфатный буфер удаляли центрифугированием, а клетки замораживали при -20 °C. Анализ продуктов ПОЛ и активности ферментов-антиоксидантов проводили в лизате клеток.
В клетках меланомы определяли уровень продуктов ПОЛ: диеновых конъюгатов (ДК), кетодиенов (КД), оснований Шиффа (ОШ), малонового диальдегида (МДА), а также активность ферментативного звена антиоксидантной системы: супероксиддисмутазы (СОД), каталазы, глутатионпероксидазы (ГПО), глута-тионредуктазы (ГР) и восстановленного глутатиона (GSH). Уровень ДК, КД и ОШ определяли спектрофотометрически по методике И.А. Волчегорского [13]. Содержание этих продуктов рассчитывали по отношению оптических плотностей гептановой фазы Е232/220 (ДК), Е278/220 (КД), Е400/Е220 (ОШ). Уровень МДА (мкмоль/л) определяли в тесте с ти-обарбитуровой кислотой по методу Л.И. Андреевой и соавт. [14]; активность каталазы и уровень GSH – по методу А.И. Карпищенко [15]; активность ГР – по методу В.С. Асатиани [16]. Активность СОД оценивали по способности конкурировать с нитросиним тетразо-лием (НСТ) за супероксидный анион по методу M. Nishikimi [17].
Статистическую обработку полученных данных проводили с помощью программы Stata v. 6.0. Достоверность различий между количественными показателями вычисляли, используя непараметрический U-критерий Манна–Уитни (p<0,05).
Результаты
Оксидативный стресс. При облучении клеток CHO-K1 лазерным излучением с плотностью энергии 9,45 Дж/см2 достоверно увеличилась концентрация АФК по сравнению с контролем (в 1,47 раза). В клетках меланомы человека A875 изменений в концентрации АФК не произошло (рис. 1).
При увеличении плотности энергии облучения до 22,5 Дж/см2 в клетках линии CHO-K1 также наблюдалось достоверное повышение концентрации АФК (в 1,48 раза), при этом изменений в культуре клеток меланомы человека при плотностях энергии 22,5 и 225 Дж/см2 не отмечалось.
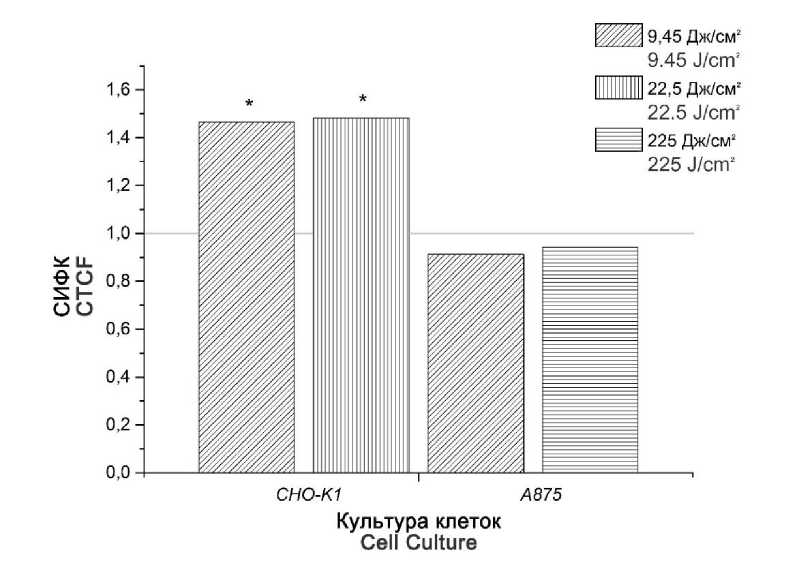
Рис. 1. Внутриклеточная концентрация активных форм кислорода в культурах клеток эпителия яичника китайского хомячка CHO-K1 и меланомы человека A875 при воздействии лазерного излучения с длиной волны 1265 нм и плотностью энергии 9,45, 22,5 и 225 Дж/см2, отношение значения скорректированной интегральной флуоресценции (СИФК) эксперимента к контролю.
* – достоверное отличие между экспериментом и контролем (p<0,05)
Fig. 1. Intracellular concentration of reactive oxygen species in the Chinese hamster ovary epithelial cell line CHO-K1 and human melanoma A875 under laser therapy (1265 nm, energy density 9.45, 22.5 and 225 J/cm2), corrected total cell fluorescence (CTCF) – fold change compared to control.
* – the difference between experimental and control groups is statistically significant (p<0.05)
Система ПОЛ – АОЗ. Нами установлено, что непрерывное лазерное облучение на длине волны 1265 нм, мощностью 4,2 мВт и плотностью энергии 9,45 Дж/см2 достоверно изменило (относительно контроля) содержание вторичного продукта ПОЛ – малонового диальдегида – в клетках меланомы и клетках эпителия яичника CHO-K1 (табл. 1). В клет-
ках меланомы произошел достоверный рост уровня МДА – в 1,9 раза, в клетках линии CHO-K1 уровень МДА снизился в 2 раза. Уровень продуктов перекисного окисления: диеновых конъюгатов, кетодиенов и оснований Шиффа – ни в одной из исследуемых клеточных линий достоверно не изменился.
Таблица 1
Table 1
Показатели системы ПОЛ – АОЗ в культурах клеток меланомы A875 (E=18,9 Дж/см2) и эпителия яичника китайского хомячка CHO-К1 (E=9,45 Дж/см2)
Indicators of AOD system and LPO products in A875 human melanoma cells (E=18.9 J/cm2) and Chinese hamster ovary epithelial cells CHO-K1 (E=9.45 J/cm2)
Анализ активности ферментов АОЗ в клеточных линиях показал, что уровень активности СОД в клетках CHO-K1 достоверно снизился более чем в 6 раз относительно контроля, а в клетках меланомы не изменился.
Активность каталазы под влиянием лазерного излучения достоверно возросла в клетках меланомы, однако в эпителиальных клетках
линии CHO-K1 произошло ее достоверное снижение.
Под влиянием лазерного излучения с плотностью энергии 9,45 Дж/см2 не произошло значимых изменений в системе глутатиона ни в одной из исследуемых клеточных линий. Уровень глутатиона и активность ферментов, осуществляющих обратимое превра-
|
Показатель Parameter |
Клеточная линия A875 A875 cell line |
Клеточная линия CHO-К1 CHO-K1 cell line |
||
|
Контроль Control |
Опыт Experiment |
Контроль Control |
Опыт Experiment |
|
|
МДА, мкмоль/л Malondialdehyde, µmol/L |
14,15±1,53 |
27,32±1,7* |
11,81±1,4 |
5,86±0,3* |
|
ДК, ед. опт. пл./мл Diene conjugates, opt. density units/ml |
1,74±0,18 |
1,61±0,11 |
0,49±0,01 |
0,52±0,1 |
|
КД, ед. опт. пл./мл Ketodienes, opt. density units/ml |
0,18±0,005 |
0,19±0,002 |
0,04±0,01 |
0,05±0,01 |
|
ОШ, ед. опт. пл./мл Schiff base, opt. density units/ml |
0,019±0,02 |
0,018±0,1 |
0,002±0,0005 |
0,003±0,001 |
|
СОД, усл. ед./л Superoxide dismutase, standard units/L |
1,405±0,41 |
1,804±0,86 |
2,94±0,32 |
0,46±0,15* |
|
Каталаза, ммоль/мин/л Catalase, mmol/min/L |
66,97±9,94 |
151,68±15,78* |
15,61±5,22 |
7,11±1,77* |
|
ГПО, ммоль/мин/л Glutathione peroxidase, mmol/min/L |
116±28,97 |
135,10±20,48 |
35,76±5,78 |
30,79±2,86 |
|
Глутатион, мкмоль/л Glutathione, µmol/L |
0,644±0,077 |
0,687±0,057 |
0,149±0,03 |
0,184±0,023 |
Примечание. * – достоверные различия по сравнению с контролем (р<0,05).
Note. * – the differences are significant compared with the control group (p<0.05).
щение восстановленного глутатиона в окисленный, – глутатионпероксидазы и глутатион-редуктазы – не изменились.
Обсуждение. Увеличение концентрации активных форм кислорода и развитие окислительного стресса в ответ на воздействие лазерного излучения в диапазоне 1265–1270 нм было показано для фотобиомодуляции в разных дозах как на нормальных, так и на раковых клетках [9, 11, 18–20]. При этом наблюдались изменение мембранного потенциала митохондрий, окисление белков и ДНК, клеточная гибель и некоторые другие клеточные события. Подобная реакция клеток на облучение предположительно обусловлена вмешательством в работу митохондрий, считающихся основными акцепторами лазерного излучения в силу своей структуры и функции [21–25].
Облучение культуры меланомы человека A875 показало специфическую стойкость клеток к лазерному излучению в дозе от 9,45 до 225 Дж/см2, что выражалось в отсутствии развития оксидативного стресса (рис. 1). Данный диапазон плотностей энергии излучения относится к низким и средневысоким, при которых показано разнонаправленное воздействие на пролиферацию меланомы в зависимости от дозы, интенсивности и кратности воздействия [26, 27]. Стоит отметить, что концентрация активных форм кислорода при воздействии лазерного излучения 1265 нм увеличивалась в нормальных и раковых клетках как в данной работе, так и в предыдущих исследованиях [11, 19].
В связи с этим возникает вопрос, является ли подобный эффект особенностью изученной клеточной линии, особенностями меланом в целом или обусловливается намного раньше и является отличительной особенностью клеток, контактировавших в своем онтогенезе с внешней средой и различными видами оптических излучений.
В целом можно говорить о том, что в нераковых клетках CHO-К1 свободнорадикальные процессы были репрессированы. Это подтверждалось снижением содержания МДА, происходящим на фоне нарушения в работе каскада антиокислительных ферментов [28].
Наши результаты согласуются с данными, полученными К. Khorsandi et al. [29], которые наблюдали повышение уровня МДА в клетках меланомы линии А375 под влиянием низкоуровневого лазерного облучения с энергией 3 Дж/см2. Исследователи также отметили снижение активности глутатионпероксидазы в клетках A375 при облучении низкоуровневым лазерным излучением. В нашем эксперименте уровень активности данного фермента не изменился.
Заключение. Лазерное излучение с длиной волны 1265 нм и плотностью энергии 9,45–225 Дж/см2 вызывает увеличение внутриклеточной концентрации активных форм кислорода в клетках CHO-K1 и не оказывает влияния на клетки меланомы человека A875. При оценке состояния системы ПОЛ – АОЗ установлено снижение активности суперок-сиддисмутазы и каталазы, а также снижение концентрации малонового диальдегида в клетках CHO-K1 под влиянием лазерного излучения 1265 нм с плотностью энергии 9,45 Дж/см2. В клетках A875 наблюдалось повышение активности каталазы и уровня малонового диальдегида при облучении с плотностью энергии 18,9 Дж/см2 по сравнению с необлученным контролем. Прочие компоненты системы антиоксидантной защиты (глутатионредуктаза, глутатионпероксидаза, глутатион) и уровень продуктов ПОЛ (кетодиены, диеновые конъюгаты, основания Шиффа) в исследованных клеточных линиях воздействием лазерного излучения затронуты не были.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 19-415-730003 р_а).
Список литературы Влияние низкоинтенсивного лазерного излучения с длиной волны 1265 нм на уровень активных форм кислорода и систему ПОЛ - АОЗ в культурах клеток CHO-K1 и A875
- Gladfelter P., Darwish N.E., Mousa S.A. Current status and future direction in the management of malignant melanoma. Melanoma Res. 2017; 27 (5): 403-410.
- Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2019 году. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России; 2020. 239.
- Гафтон Г.И., Анисимов В.В., Гельфонд М.Л., Семилетова Ю.В., Балдуева И.А., Нехаева Т.Л., Новик А.В., Мяснянкин М.Ю. Клинико-иммунологическая оценка эффективности неоадъювантной фотодинамической терапии в хирургическом лечении первичной меланомы кожи. Сибирский онкологический журнал. 2015; 2: 31-38.
- Peidaee P., Almansour N.M., Pirogova E. In vitro evaluation of low-intensity light radiation on murine melanoma (B16F10) cells. Med. Biol. Eng. Comput. 2016; 54 (2-3): 325-332.
- Chen Z., Li W., Hu X., Liu M. Irradiance plays a significant role in photobiomodulation of B16F10 melanoma cells by increasing reactive oxygen species and inhibiting mitochondrial function. Biomed. Opt. Express. 2019; 11 (1): 27-39.
- Ash C., Dubec M., Donne K., Bashford T. Effect of wavelength and beam width on penetration in light-tissue interaction using computational methods. Lasers Med. Sci. 2017; 32 (8): 1909-1918.
- Costa Carvalho J.L., de Brito A.A., de Oliveira A.P., de Castro Faria Neto H.C., Pereira T.M., de Carvalho R.A., Anatriello E., Aimbire F. The chemokines secretion and the oxidative stress are targets of low-level laser therapy in allergic lung inflammation. J. Biophotonics. 2016; 9 (11-12): 1208-1221.
- Firat E.T., Dag A., Gunay A., Kaya B., Karadede M.I., Kanay B.E., Ketani A., Evliyaoglu O., Uysal E. The effects of low-level laser therapy on palatal mucoperiosteal wound healing and oxidative stress status in experimental diabetic rats. Photomed. Laser Surg. 2013; 31 (7): 315-321.
- Sokolovski S.G., Zolotovskaya S.A., Goltsov A., Pourreyron C., South A.P., Rafailov E.U. Infrared laser pulse triggers increased singlet oxygen production in tumour cells. Sci Rep. 2013; 3: 3484.
- Oliveira C.S., Turchiello R., Kowaltowski A.J., Indig G.L., Baptista M.S. Major determinants of photoinduced cell death: Subcellular localization versus photosensitization efficiency. Free Radic. Biol. Med. 2011; 51 (4): 824-833.
- Khokhlova A., Zolotovskii I., Stoliarov D., Vorsina S., Liamina D., Pogodina E., Fotiadi A., Saenko Y., Sokolovski S., Rafailov E. The Photobiomodulation of Vital Parameters of the Cancer Cell Culture by Low Dose of Near-IR Laser Irradiation. IEEE Journal of Selected Topics in Quantum Electronics. 2019; 25 (1): 1-10.
- McCloy R.A., Rogers S., Caldon C.E., Lorca T., Castro A., Burgess A. Partial inhibition of Cdk1 in G 2 phase overrides the SAC and decouples mitotic events. Cell Cycle. 2014; 13 (9): 1400-1412.
- Волчегорский В.А., Налимов А.Г., Яровинский Б.Г. Сопоставление различных подходов к определению продуктов перекисного окисления липидов в гептан-изопропаноловых экстрактах крови. Вопросы медицинской химии. 1989; 1: 127-131.
- Андреева Л.И., Кожемякин Л.А., Кишкун А.А. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой. Лабораторное дело. 1988; 11: 41-43.
- Карпищенко А.И., ред. Медицинские лабораторные технологии: руководство по клинической лабораторной диагностике. Т. 2. М.: ГЭОТАР-Медиа; 2013. 792.
- Асатиани В.С. Ферментные методы анализа. М.; 1969: 607-610.
- Nishikimi M., Appa N., Yagi K. The occurrence of superoxide anion in the reaction of reduced phen-acinemethosulfate and molecular oxygen. Biochem. Biophys. Res. Commun. 1972; 46: 849-854.
- Anquez F., Yazidi-Belkoura I., Randoux S., Suret P., Courtade E. Cancerous cell death from sensitizer free photoactivation of singlet oxygen. Photochem Photobiol. 2012; 88 (1): 167-174.
- Saenko Y.V., Glushchenko E.S., Zolotovskii I.O., Sholokhov E., Kurkov A. Mitochondrial dependent oxidative stress in cell culture induced by laser radiation at 1265 nm. Lasers Med. Sci. 2016; 31 (3): 405-413.
- Khokhlova A., Zolotovskii I., Stoliarov D., Vorsina S., Liamina D., Pogodina E., Fotiadi A., Saenko Y., Sokolovski S., Rafailov E. Effects of high and low level 1265 nm laser irradiation on HCT116 cancer cells. Proc. SPIE. 2019; 10861: 108610L.
- DOI: 10.1117/12.2509529
- Pastore D., Greco M., Passarella S. Specific helium-neon laser sensitivity of the purified cytochrome c oxidase. Int. J. Radiat. Biol. 2000; 76 (6): 863-870.
- Eells J.T., Wong-Riley M.T., Ver Hoeve J., Henry M., Buchman E.V., Kane M.P., Gould L.J., Das R., JettM., Hodgson B.D., Margolis D., Whelan H. T. Mitochondrial signal transduction in accelerated wound and retinal healing by near-infrared light therapy. Mitochondrion. 2004; 4 (5-6): 559-567.
- Wong-Riley M.T., Liang H.L., Eells J.T., Chance B., Henry M.M., Buchmann E., Kane M., Whelan H.T. Photobiomodulation directly benefits primary neurons functionally inactivated by toxins: role of cytochrome c oxidase. J. Biol. Chem. 2005; 280 (6): 4761-4771.
- Gonzalez-Lima F., Auchter A. Protection against neurodegeneration with low-dose methylene blue and near-infrared light. Front. Cell Neurosci. 2015; 9: 179.
- Khokhlova A., Zolotovskii I., Sokolovski S., Saenko Y., Rafailov E., Stoliarov D., Pogodina E., Svetukhin V., Sibirny V., Fotiadi A. The light-oxygen effect in biological cells enhanced by highly localized surface plasmon-polaritons. Sci Rep. 2020; 10 (1): 1269.
- DOI: 10.1038/s41598-020-58159-4
- Frigo L., Luppi J.S., Favero G.M., Durnavei A.M., Penna S.C., Bjordal J.M., Bensadoun R.J., Lopes-Martins R.A. The effect of low-level laser irradiation (In-Ga-Al-AsP - 660 nm) on melanoma in vitro and in vivo. BMC Cancer. 2009; 9: 404.
- Andreeva N.V., Yegorov Y.E., Belyavsky A.V., Zotov K.V., Yusupov V.I., Bagratashvili V.N., Kalashnikova M.V. The effect of infrared laser irradiation on the growth of human melanoma cells in culture. Biophysics. 2016; 61 (6): 979-984.
- Франциянц Е.М., Солдаткина Н.В., Орловская Л.А., Дашков А.В. Некоторые показатели свободнорадикальных процессов и антиокислительной системы ткани опухоли молочной железы и ее перифокальной зоны при различных вариантах течения рака. Опухоли женской репродуктивной системы. 2008; 2: 38-44.
- Khorsandi K., Kianmehr Z., Hosseinmardi Z., Hosseinzadeh R. Anticancer effect of gallic acid in presence of low level laser irradiation: ROS production and induction of apoptosis and ferroptosis. Cancer Cell Int. 2020; 20: 18.


