Влияние низкотемпературной аргоновой плазмы на жизнеспособность и пролиферацию фибробластов in vitro
Автор: Маркевич П.С., Филиппов А.В., Долгих Р.Н., Боровкова Н.В., Макаров М.С., Сторожева М.В., Пономарев И.Н., Зеленина Т.А., Земляной А.Б.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.19, 2024 года.
Бесплатный доступ
Контролируемая генерация активных форм кислорода и азота стимулирует процессы заживления ран. Одним из источников управляемой генерации активных форм кислорода и азота является низкотемпературная аргоновая плазма (НТАП), которая активизирует различные формы клеточной активности. Однако, тонкие механизмы такой стимуляции остаются невыясненными. Таким образом, возникает необходимость подробного изучения биологического эффекта НТАП на клетки человека.Цель работы: оценить влияние НТАП на структуру и пролиферативную активность фибробластов человека in vitro.Материалы и методы. Использовали культуру фибробластов человека (линия М-21, 25 пассаж, Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова). После воздействия НТАП клетки культивировали в течение 3 суток в питательной среде ДМЕМ/F12 c добавлением 10% сыворотки эмбрионов коров «Gibco», далее проводили морфофункциональный анализ клеток с использованием витального окрашивания. Через 3 суток проводили пассирование клеток (пересев в другие чашки Петри с разведением 1:2), затем клетки культивировали в течение 3 суток, и проводили повторный морфофункциональный анализ. Все работы с культурами клеток проводили в соответствии с международным стандартом GMP.Результаты. Стимуляция пролиферативной активности фибробластов отмечена на втором пассаже после обработки НТАП с расстояния 10 см 30 и 45 с и 15 см - 45 с.Использование экрана в виде коллагеновой повязки заметно увеличивает выживаемость клеток при воздействии плазмы с расстояния 10 см в течение 15 с. На фоне экранирования снижение целостности клеточных мембран после воздействия плазмы менее выражено, чем при воздействии без экранирования. При повторном посеве клетки, обработанные в присутствии коллагенового экрана, проявляют высокую пролиферативную активность и восстанавливают целостность мембран.
Низкотемпературная аргоновая плазма, фибробласты, пролиферация
Короткий адрес: https://sciup.org/140308255
IDR: 140308255 | DOI: 10.25881/20728255_2024_19_4_51
Текст научной статьи Влияние низкотемпературной аргоновой плазмы на жизнеспособность и пролиферацию фибробластов in vitro
В настоящее время идет поиск и разработка способов положительного влияния на репарацию и регенерацию ран различного генеза. Есть данные, что контролируемая генерация активных форм кислорода и азота стимулирует процессы заживления ран [2; 3], оказывают регуляторное воздействие на баланс многих метаболических процессов [4]. Одним из источников управляемой генерации ак- тивных форм кислорода и азота является НТАП [5]. Она используется при лечении обширных и хронических ран с целью удаления патогенной флоры, клеточного и тканевого дебриса. Есть данные, что воздействие холодной плазмы стимулирует рост и дифференцировку диплоидных клеток человека [6], однако тонкие механизмы такой стимуляции остаются невыясненными. НТАП заметно повышает проницаемость клеточных мембран, что в ряде

случаев может стимулировать проникновение в клетку сигнальных молекул, активирующих ионов (в частности, ионов калия, кальция и магния), и, таким образом, запускать различные формы клеточной активности. С другой стороны, неоднократно показан токсический эффект активных форм кислорода и азота при воздействии на клетки как in vitro и in vivo [7; 8]. Возникает необходимость подробного изучения биологического эффекта НТАП на клетки человека.
Цель работы: оценить влияние НТАП на структуру и пролиферативную активность фибробластов человека in vitro.
Материалы и методы
Использовали культуру фибробластов человека (линия М-21, 25 пассаж, Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова). В чашки Петри диаметром 3,5 см вносили суспензию, содержащую 30 тыс. клеток в питательной среде ДМЕМ/F12 c добавлением 10% сыворотки эмбрионов коров «Gibco». Клетки помещали в СО2 инкубатор с содержанием углекислого газа в атмосфере 5% и температуре 37 °С и культивировали в течение 24 часов для достижения адгезии высеянных клеток. После этого клетки подвергали воздействию НТАП.
Методика обработки НТАП фибробластов человека in vitro
Плазменно-дуговую хирургическую установку после включения настраивали на режим «Б2».
До воздействия НТАП содержание клеток на дне экспериментальных чашек Петри варьировало от 15 до 21 тыс/см2. При этом во всех чашках клетки имели одинаковое значение ЦКМ, то есть структурная целостность клеток соответствовала норме.
Через 24 часа после посева все экспериментальные чашки Петри (60 образцов) обрабатывали НТАП в следующих режимах: 10 см от поверхности культуральной среды (время обработки 15, 30 и 45 с); 15 см от поверхности культуральной среды (время обработки 15, 30 и 45 с); 20 см от поверхности культуральной среды (время обработки 15, 30 и 45 с).
Объем культуральной среды в экспериментальных чашках Петри непосредственно перед обработкой плазмой составлял 1 мл. После обработки среду удаляли и добавляли новую в объеме 3 мл. Контрольные чашки Петри не обрабатывались. После воздействия плазмы контрольные и экспериментальные чашки Петри культивировали в течение 3 суток в питательной среде ДМЕМ/F12 c добавлением 10% сыворотки эмбрионов коров «Gibco», далее проводили морфофункциональный анализ клеток с использованием витального окрашивания. Через 3 суток проводили пассирование клеток (пересев в другие чашки Петри с разведением 1:2), затем клетки культивировали в течение 3 суток, и проводили повторный морфофункциональный анализ.
Анализ фибробластов
Исследование структурной целостности и пролиферативной активности фибробластов проводили с помощью метода оценки клеточного компонента биотрансплантатов [1], который включает окрашивание клеток витальными флуорохромными красителями на основе трипафлавина и родамина С и анализ окрашенных клеток во флуоресцентном микроскопе (объектив х 4, Х 10, х 20, х 40). В ходе морфофункционального анализа определяли форму клеток, состояние внутриклеточных мембранных компонентов, наличие вакуолизации, зернистости и других образований цитоплазмы, адгезию клеток на дне чашек Петри. Рассчитывали индекс пролиферации (ИП3), который определяли как отношение количества клеток в лунке на 3-и сутки культивирования (в тыс/см2) к количеству клеток на 1-е сутки культивирования. Целостность клеточных мембран, (ЦКМ) определяли на основании яркости свечения цитоплазмы витально окрашенных клеток и использовали этот показатель для характеристики структурной целостности клеток, в норме ЦКМ составляет 28–32 балла.
Все работы с культурами клеток проводили в соответствии с международным стандартом GMP.
Статистическая обработка
Для статистической обработки данных вычисляли медиану (M) и квартили (25%; 75%). Для оценки различий использовали U-критерий Манна-Уитни для сравнения независимых величин и критерий Уилкоксона для оценки изменения параметров внутри одной группы. Различия значений считали достоверными при уровне значимости более 95% (р<0,05).
Результаты исследования
В процессе обработки фибробластов НТАП при расположении сопла «Плазморана» на расстоянии 10 и 15 см над чашкой Петри отмечали формирование зон высыхания среды. Такого эффекта не отмечали при удалении сопла прибора от чашки на расстояние 20 см и более. Через 24 часа после воздействия в зонах высыхания отмечали массовую гибель фибробластов.
На 3 сутки культивирования в контрольных образцах содержание клеток составило 27 [27; 28] тыс. клеток на см2, что соответствовало увеличению количества фибробластов в 1,35 раза. Значения индекса пролиферации (ИП3) при разных режимах обработки фибробластов представлены в таблице 1, микроскопическая картина показана на рис. 1. Отметим, что обработка НТАП в 6 сериях из 12 приводила к снижению числа фибробластов по сравнению с исходными значениями, наиболее выраженному в опытах при расположении сопла «Плазморана» на 10 см от чашки Петри. Резкое снижение числа фибробластов могло быть обусловлено массовой гибелью клеток при высыхании среды во время обработки, ингибированием пролиферативной активности клеток, а также нарушением их адгезии. После воздействия НТАП на расстоянии

Табл. 1. Оценка морфофункциональных свойств культуры фибробластов после воздействия НТАП и 3 суток культивирования
|
Условия обработки аргоновой плазмой |
Морфофункциональные параметры |
|||||
|
Расстояние от сопла до поверхности среды |
Продолжительность воздействия |
Содержание клеток в культуре, тыс/см2 |
ЦКМ, баллы |
ИП3 |
||
|
Через 1 сутки (до воздействия) |
Через 3 суток |
Через 1 сутки (до воздействия) |
Через 3 суток |
|||
|
контроль |
20 [17; 22] |
27 [27; 28] |
32 [32; 32] |
32 [32; 32] |
1,35 |
|
|
10 см |
15 с |
16 [16; 16] |
3 [3; 3]* |
32 [32; 32] |
23 [23; 23]* |
0,19 |
|
30 с |
17 [16; 19] |
8 [8; 9]* |
32 [32;32] |
24 [23; 24]* |
0,47 |
|
|
45 с |
18 [17; 18] |
11 [10; 12]* |
32 [32; 32] |
24 [23; 24]* |
0,61 |
|
|
15 см |
15 с |
16 [16; 17] |
20 [18; 20]* |
32 [32; 32] |
24 [23; 24]* |
1,25 |
|
30 с |
18 [15; 18] |
15 [14; 17]* |
32 [32; 32] |
24 [24; 25]* |
0,83 |
|
|
45 с |
15 [15; 17] |
16 [15; 20]* |
32 [32; 32] |
24 [24; 24]* |
1,07 |
|
|
20 см |
15 с |
17 [15; 20] |
21 [21; 29]* |
32 [32; 32] |
26 [26; 26]* |
1,23 |
|
30 с |
19 [17; 21] |
16 [15; 20]* |
32 [32; 32] |
26 [25; 26]* |
0,84 |
|
|
45 с |
17 [16; 19] |
15 [14; 15]* |
32 [32; 32] |
26 [25; 27]* |
0,88 |
|
|
25 см |
15 с |
16 [16; 17] |
28 [27; 30] |
32 [32; 32] |
28[28; 28]* |
1,75 |
|
30 с |
19 [18; 20] |
21 [21; 23]* |
32 [32; 32] |
25 [25; 26]* |
1,10 |
|
|
45 с |
17 [15; 18] |
16 [15; 17]* |
32 [32; 32] |
26 [26; 27]* |
0,94 |
|
45 сек
15 сек
30 сек
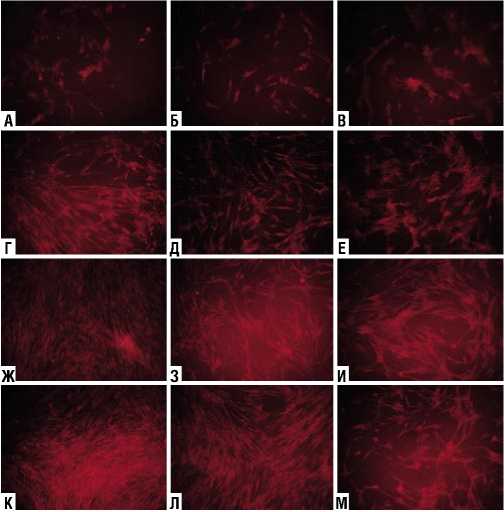

Рис. 1. Витальное окрашивание фибробластов человека после обработки НТАП через 3 суток культивирования. Увеличение х 100. А–В – обработка на расстоянии 10 см; Г–Е – обработка на расстоянии 15 см; Ж–И – обработка на расстоянии 20 см; К–М – обработка на расстоянии 25 см.
10 см в опытных чашках Петри отмечено большое количество клеток в суспензии, т.е. эти клетки полностью теряли связь с субстратом и не могли пролиферировать. Особенно интересным было выраженное (более чем в 5 раз) снижение количества фибробластов на 3 сутки культивирования при обработке НТАП с расстояния 10 см 15 с, тогда как более длительное воздействие плаз-
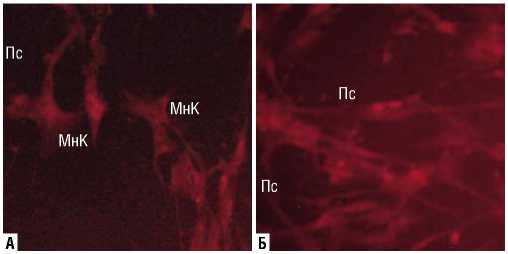
Рис. 2. Измененные клетки в культуре фибробластов человека после воздействия НТАП на расстоянии 10(А) и 15(Б) см в течение 30 с. Витальное окрашивание три-пафлавином и родамином С. Увеличение х 500 раз.
мы в течение 30 и 45 с приводило к снижению количества фибробластов только в 1,5–2 раза.
При удалении сопла на 20 и 25 см от чашек наблюдали отсутствие стимуляции пролиферации фибробластов при длительных сроках экспозиции (30–45 с). Пролиферативная активность, близкая к контролю, отмечена при режимах воздействия 15 и 20 см в течение 15 с, значения ИП3 составили 1,25 и 1,23, соответственно. При режиме обработки 25 см в течение 15 с отмечали стимуляцию пролиферации фибробластов по сравнению с контролем (ИП3– 1,75).
Целостность клеточных мембран на 3 сутки после воздействия НТАП во всех экспериментальных сериях было достоверно снижена. Наиболее выраженное нарушение ЦКМ отмечено в опытах, где фибробласты обрабатывали НТАП на расстоянии 10 и 15 см от сопла «Плазморана». В этих случаях значение ЦКМ не превышало 23–24 баллов (Рис. 2). При воздействии НТАП на расстоянии 20 и 25 см снижение ЦКМ было менее выраженным, однако в этих опытах также отмечено изменение морфологии фибробластов: многие клетки
15 сек
30 сек
45 сек
Контроль
2-го пассажа (пересев в соотношении 1:2) через 3 суток культивирования. Увеличение х100.
А–В – обработка на расстоянии 10 см;
Г–Е – обработка на расстоянии 15 см;
Ж–И – обработка на расстоянии 20 см; К–М – обработка на расстоянии 25 см.
формировали тонкие хаотично ориентированные псевдоподии (выросты цитоплазмы), которые часто перекрещивались с псевдоподиями других клеток (Рис. 2). Такая многоотросчатая форма не является характерной для фибробластов, т.е. можно говорить об изменении внутрицитоплазматической структуры клеток, а также их адгезивной активности.
В целом, можно заключить, что выбранные режимы обработки культуры фибробластов человека НТАП in vitro приводят к частичному снижению жизнеспособности клеток через 3 суток культивирования. Наименьшее повреждающее действие на клеточные мембраны оказывает воздействие НТАП в течение 15 с с расстояния 25 см, что также способствует стимуляции пролиферативной активности клеток.
После пересева в соотношении 1:2 и культивирования в течение 3 суток общее количество клеток в чашках было сопоставимо или ниже, чем в контроле (32 тыс. клеток на 1 см2, ИП3 – 2,3), однако при этом в ряде опытов отмечены довольно высокие значения ИП3. Так, в опыте с воздействием на расстоянии 10 см в течение 15 с значение ИП3 превышало 19, что говорит о чрезвычайно активной пролиферации фибробластов. При режимах облучения 10 см – 30 и 45 с, 15 см – 45 с, 25 см – 30 и 45 с, ИП3 был выше контрольных значений. В ряде опытов в культуре наблюдалось формирование конфлюентного монослоя
Табл. 2. Морфофункциональные характеристики культуры фибробластов 2-го пассажа через 3 суток культивирования (6 суток после воздействия НТАП)
|
Условия обработки аргоновой плазмой |
Морфофункциональные параметры |
||||
|
Расстояние от сопла до поверхности среды |
Продол-житель-ность воздействия |
Содержание клеток в культуре, тыс/см2 |
ЦКМ, через 3 суток культивирования, баллы |
ИП3 |
|
|
Перед посевом |
Через 3 суток |
||||
|
контроль |
13,5 |
32 [32; 32] |
31 [31; 32] |
2,4 |
|
|
10 см |
15 с |
1,5 |
29 [28; 30]* |
27 [27; 28]* |
19,2 |
|
30 с |
4 |
17 [15; 19]* |
27 [27; 28]* |
4,2 |
|
|
45 с |
5,5 |
16 [16; 17]* |
28 [28; 28]* |
2,9 |
|
|
15 см |
15 с |
10 |
16 [14; 17]* |
27 [26; 27]* |
1,6 |
|
30 с |
7,5 |
18 [17; 18]* |
27 [27; 27]* |
2,4 |
|
|
45 с |
8 |
22 [21; 22]* |
27,5 [27; 28]* |
2,7 |
|
|
20 см |
15 с |
10,5 |
19 [19; 20]* |
27,5 [27; 28]* |
1,8 |
|
30 с |
8 |
15 [15; 15]* |
26 [26; 26]* |
1,9 |
|
|
45 с |
7,5 |
16 [15; 16]* |
26 [26; 26]* |
2,1 |
|
|
25 см |
15 с |
14 |
31 [30; 31] |
29 [28; 30]* |
2,2 |
|
30 с |
10,5 |
29 [28; 29]* |
26,5 [26; 27]* |
2,7 |
|
|
45 с |
8 |
20 [19; 20]* |
26 [26; 26]* |
2,5 |
|
Примечание : * – р<0,05 относительно контроля через 3 суток культивирования.
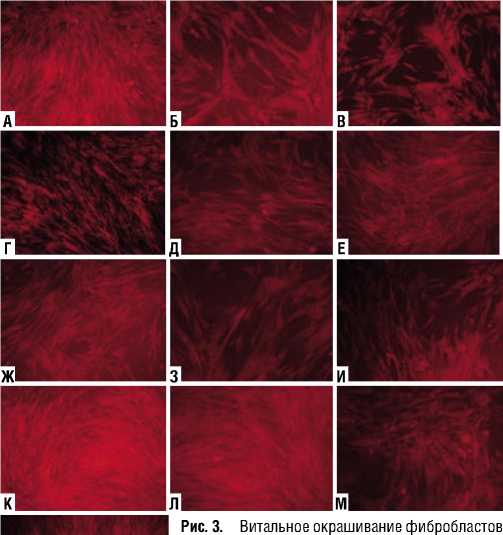
(Рис. 3), в составе которого клетки имели упорядоченную ориентацию (воздействие на расстоянии 10 см в течение 15 с, воздействие на расстоянии 25 см в течение 15 с и 30 с). В этих случаях плотность клеток составила 29–30 тыс/см2, что было довольно близко к аналогичным значениям в контроле. В остальных опытах содержание клеток варьировало от 15 до 22 тыс/см2, при котором монослой считается формирующимся. Ингибирование пролиферации фибробластов во всех опытах отсутствовало. Морфофункциональное исследование показало, что в образцах, где исходная обработка НТАП проводилась на расстоянии 10 и 15 см, отмечено достоверное повышение уровня ЦКМ до 27–28 баллов. Кроме того, повышение ЦКМ отмечено в опыте с обработкой НТАП на расстоянии 25 см в течение 15 с (до 29 баллов); в остальных опытах значения ЦКМ значимо не менялись (табл. 2). С другой стороны, во всех опытных чашках 2-го пассажа по-прежнему выявлялись клетки измененной формы с большим количеством отростков, а также были выявлены вакуолизированные и ошаренные клетки с характерными апоптотическими изменениями (Рис. 4). Таким образом, структурная целостность всей популяции фибробластов при повторном пересеве восстанавливалась лишь частично. Можно заключить, что воздействие НТАП не вызывало необратимого ингибирования пролиферативной активности фибробластов, которая реализовывалась после пересева и в итоге превышала контрольные показатели. Структурная целостность клеточных мембран частично восстанавливалась, однако при этом в культуре сохранялись поврежденные и измененные клетки.

Ош
А
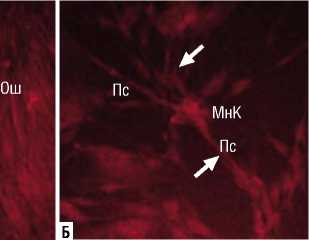
Рис. 4. Выявление измененных клеток в культуре фибробластов человека после воздействия НТАП на расстоянии 10 см в течение 30 с (А) и 15 см в течение 45 с (Б). Витальное окрашивание трипафлавином и родамином С. Увеличение х 500 раз. Условные обозначения: МнК – многоотросчатые клетки; Пс – псевдоподии, стрелками показаны пересечения псевдоподий; Ош – ошаренные клетки.
Воздействие НТАП на фоне экранирования клеток коллагеновой повязкой
В условиях in vivo в ране жизнеспособные клетки находятся на разной глубине в толще коллагеновых и эластиновых волокон, а также мигрируют в область раны в процессе репарации. При этом межклеточное вещество, с одной стороны, может предохранять клетки от прямого повреждающего действия факторов газового потока НТАП, а с другой снижать их терапевтический эффект. Поэтому предложено было использовать в качестве дополнительного эксперимента модель, где монослой клеток укрыт структурами на основе волокон межклеточного матрикса, как это имеет место in vivo. В качестве биологического экрана была предложена раневая повязка на основе коллагена человека 1-го типа. Толщина коллагеновой повязки во всех случаях составляла 100 мкм. Для подготовки эксперимента культуру фибробластов человека высаживали в чашки Петри и культивировали в течение 24 часов (как и в предыдущей серии экспериментов). Через 24 часа после посева во все чашки Петри (15 образцов) поверхность культуральной среды (1 мл на чашку) укрывали коллагеновой повязкой площадью 5–6 см2, после чего в экспериментальных чашках (11 образцов) проводили обработку низкотемпературной НТАП в следующих режимах: 10 см от поверхности культуральной среды (время обработки 15 и 45 с); 15 см от поверхности культуральной среды (время обработки 45 с). После обработки коллагеновые повязки вынимали из контрольных и опытных чашек, и анализировали во флуоресцентном микроскопе с целью оценить возможные изменения топографии коллагеновых волокон, а также интенсивность свечения отдельных волокон (в фут-канделах). По нашим наблюдениям изменение компактизации коллагена, а также его химическое разрушение сопровождается изменением автофлуоресценции коллагеновых волокон. Оценку качества фибробластов проводили по той же схеме, как и в опытах без коллагеновых повязок (морфофункциональный анализ через 3 суток культивирования после облучения, затем пересев клеток в соотношении 1:2, повторное культивирование в течение 3 суток и повторный анализ).

Рис. 5. Культура фибробластов через 2 часа после воздействия НТАП. Прохо-дящий свет. Увеличение х40. А – контрольная культура; Б – обработка НТАП на расстоянии 10 см в течение 15 с; В – обработка НТАП на расстоянии 10 см в течение 45 с; Г – обработка НТАП на расстоянии 15 см в течение 45 с.
Во всех экспериментальных чашках Петри уже через 2 часа воздействия наблюдалось локальное отслоение групп клеток от дна, потеря ими адгезивной активности, а также выраженные структурные изменения. В таких зонах также можно было видеть клеточный дебрис, т.е. скопления разрушенных и фрагментированных клеток. В контрольных чашках Петри формирование клеточного дебриса не наблюдалось, клетки были равномерно распределены по дну и имели нормальную морфологию (Рис. 5). Через 3 суток культивирования содержание клеток во всех экспериментах было ниже, чем в контроле (табл. 3); с другой стороны, в опыте с обработкой на расстоянии 10 см в течение 15 с отмечено формирование конфлю-ентного монослоя, т.е. в данном случая не наблюдалось значительной убыли клеток, как это имело место в аналогичном опыте без экранирования. Значение индекса пролиферации через 3 суток культивирования в опытах с обработкой на расстоянии 10 см в течение 15 с составило 0,94, на расстоянии 10 см и 45 с – 0,56, на расстоянии 15 см и 45 с – 0,66, что также было ниже контрольного (1,2).
Среднее значение ЦКМ в опытах с обработкой на расстоянии 10 см в течение 15 с через 3 суток культивирования составляло 28,1 баллов, на расстоянии 10 см и 45 с – 27,5 баллов, на расстоянии 15 см и 45 с – 28,2 балла, что было достоверно ниже, чем в контроле (32 балла). С другой стороны, в опытах с экранированием коллагеновой повязкой значения ЦКМ были выше, чем при аналогичном воздействии без экранирования. Наличие коллагеновой повязки заметно увеличивало общее число клеток и значение ИП3 в опытах с обработкой на расстоянии 10 см в течение 15 с.
Табл. 3. Морфофункциональные характеристики культуры фибробластов 1-го и 2-го пассажа через 3 суток культивирования после воздействия НТАП с использованием экранированием клеток с помощью коллагеновой повязки
1-й пассаж (Экранирование клеток коллагеновой повязкой – воздействие плазмы – культивирование 3 суток)
Условия обработки аргоновой плазмой
Морфофункциональные параметры
|
Расстояние от сопла до поверхности среды |
Продолжительность воздействия |
Содержание клеток в культуре, тыс/см2 |
ЦКМ, баллы |
ИП3 |
||
|
Через 1 сутки культивирования (до воздействия) |
Через 3 суток культивирования |
Через 1 сутки культивирования (до воздействия) |
Через 3 суток культивирования |
|||
|
контроль |
18,5 [17,6; 19,3] |
22 [20; 28] |
32 [32; 32] |
32 [32; 33] |
1,31 |
|
|
10 см |
15 с |
19 [18; 19,5] |
18 [14,8; 20,5] |
32 [32; 32] |
29 [26,8; 30] |
0,94 |
|
10 см |
45 с |
18,5 [17,8; 19,2] |
8 [6; 15] |
32 [32; 32] |
27 [26; 28] |
0,56 |
|
15 см |
45 с |
19 [18,7; 20,2] |
13 [9; 17,8] |
32 [32; 32] |
28,5 [27; 30] |
0,66 |
Анализ автофлуоресценции коллагена повязок не выявил видимых изменений в структуре волокон после воздействия НТАП. Во всех опытах коллагеновые волокна имели такую же топографию, как в контроле, средняя интенсивность автофлуоресценции волокон составляла 37,9 фут-кандел в контроле и 37,5–39,4 фут-кандел в опытах, т.е. декомпактизации или разрушения коллагена под действием плазмы не происходило. Морфофункциональный анализ показал, что при экранировании культуры коллагеновой повязкой нарушение структуры клеток при воздействии на расстоянии 10 см в течение 15 с было гораздо менее выраженным. При этом во всех экспериментах выявлялись зоны, где плотность клеток была резко снижена, а сами клетки имели измененную морфологию, образовывали тонкие хаотично ориентированные псевдоподии, содержали вакуоли и имели сниженную яркость цитоплазмы. Аналогичная картина отмечалась в опытах без экранирования коллагеном. Вместе с тем, доля сильно измененных или поврежденных клеток при использовании коллагенового экрана была ниже, чем при воздействии плазмы непосредственно на среду с клетками. Таким образом, наличие коллагенового экрана снижает повреждающее действие аргоновой плазмы, но не устраняет его полностью.
После пересева клеток в соотношении 1:2 и повторном культивировании в течение 3 суток наблюдалось восстановление структурной целостности фибробластов, а также целостности их мембран. Через 3 суток культивирования в опытных чашках Петри во многих зонах выявлен конфлюентный (плотный) монослой клеток, однако общее количество клеток на см2 достоверно отличалось в разных опытах. При воздействии плазмой на расстоянии 10 см в течение 15 с среднее содержание клеток в культуре составило 26,4 тыс/см2, на расстоянии 10 см в течение 45 с – 25,3 тыс/см2, на расстоянии 15 см в течение 45 с – 22,2 тыс/см2. Индекс пролиферации составил, соответственно, 3,2, 4,8 и 3,6. В то же время в контрольных чашках Петри содержание клеток через 3 суток культивирования составило в среднем 27,0 тыс/см2, индекс пролиферации – 2,2. Через 3 суток культивирования во всех опытах практически не выявлялись клетки измененной или многоотросчатой формы, общая морфология фибробластов соответствовала норме (Рис. 6). Значение ЦКМ соответствовала нормальным показателям.
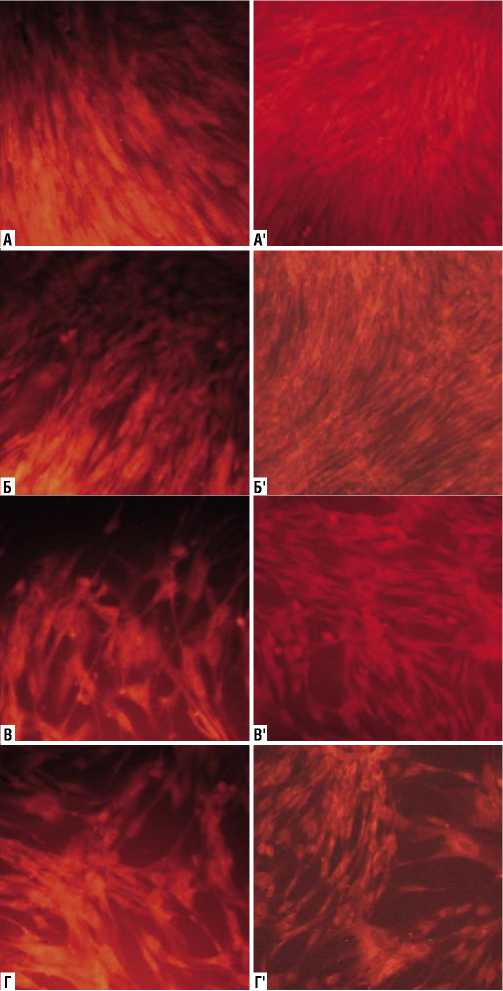
Рис. 6. Витальное окрашивание фибробластов человека после обработки НТАП через 3 суток культивирования. Увеличение х100. А, А' – контроль; Б, Б' – воздействие 10 см – 15 с; В, В' – воздействие 10 см – 45 с; Г, Г' – воздействие 15 см – 45 с.
Таким образом, после экранирования коллагеном и двухэтапного пассирования фибробласты сохраняли нормальную способность к пролиферации. Во всех опытах индекс пролиферации во втором пассаже был выше, чем в контроле. Это может быть связано с тем, что воздействие НТАП кумулятивно стимулировало рост наиболее жизнеспособных клеток в культуре.
Обсуждение результатов
НТАП используется при лечении обширных и хронических ран с целью удаления патогенной флоры, удаления клеточного и тканевого дебриса, однако тонкие механизмы такой стимуляции остаются невыясненными. Наше исследование показало, что при непосредственном действии НТАП с расстояния 10 и 15 см отмечается, при высушивании, нарушение структурной целостности клеточных мембран, что приводит к снижению адгезивных способностей клетки. Тонкие механизмы такого влияния на фибробласты человека требуют дальнейшего изучения.
Выраженная активация пролиферации фибробластов наблюдается только во 2-м пассаже, но не непосредственно после воздействия НТАП. В опытах без экранирования значительная часть клеток разрушалась, теряла связь с подложкой в течение 1–3 суток культивирования, в результате через 3 суток в опытах наблюдалась убыль клеток. С другой стороны, такая убыль не препятствовала интенсивному росту клеток во втором пассаже. Не исключено, что под действием плазмы наиболее жизнеспособная часть популяции постепенно кумулирует факторы активации, которые затем способствуют активному делению. Вместе с тем, даже на фоне интенсивного роста во 2-м пассаже многие клетки имеют измененную форму и не восстанавливают полностью структуру мембран. Наименьшее повреждение клеток отмечено при режиме обработки плазмой 15 с на расстоянии 25 см. В этом случае нарушения структурная целостность фибробластов была ближе всего к нормальной. В то же время во втором пассаже пролиферативная активность клеток была как у клеток контрольной серии. Наибольшее стимулирующее действие на пролиферативную активность фибробластов на втором пассаже отмечено при обработке культуры на расстоянии 10 см в течение 30 и 45 с и 15 см в течение 45 с. При таких режимах обработки клеток НТАП на втором пассаже также отмечали восстановление ЦКМ. После воздействия с расстояния 20 см даже на втором пассаже сохранялся низкий показатель структурной полноценности клеток на фоне невысокого пролиферативного потенциала.
Использование экрана в виде коллагеновой повязки (моделирование раны) позволило значительно повысить сохранность фибробластов в первом пассаже, как с точки зрения общего количества клеток в культуре, так и с точки зрения целостности их мембран. После пересева, клетки, обработанные на расстоянии 10 см с использованием экрана, создавали полноценный конфлюэнтный монослой, плотно заполняя практически все дно чашки Петри. Стоит отметить, что в отличие от работ in vitro, при клиническом использовании НТАП воздействие не осуществляется напрямую на монослой клеток. Не исключено, что при клиническом использовании повреждение клеток будет гораздо менее выраженным, чем in vitro. Для лучшего понимания эффекта холодной плазмы необходимо изучить процессы, происходящие в цитоплазме клетки, подверженной воздействию.
Выводы
-
1. Воздействие НТАП на культуру фибробластов человека без экранирования вызывает снижение структурной целостности клеток через 3 суток культивирования. При обработке культуры на расстоянии 10 и 15 см происходит нарушение клеточной адгезии. Наиболее щадящим для культуры фибробластов человека является режим обработки на расстоянии 25 см в течение 15 с.
-
2. При пересеве культуры фибробластов структурная целостность клеток частично восстанавливается, наблюдается нормальная пролиферативная активность клеток. При этом общая морфология многих клеток остается измененной.
-
3. Стимуляция пролиферативной активности фибробластов отмечена на втором пассаже после обработки НТАП с расстояния 10 см 30 и 45 с и 15 см 45 с.
-
4. Использование экрана в виде коллагеновой повязки (моделирование раны) заметно увеличивает выживаемость клеток при воздействии НТАП с расстояния 10 см в течение 15 с. На фоне экранирования снижение целостности клеточных мембран после воздействия НТАП менее выражено, чем при воздействии без экранирования. При повторном посеве клетки, обработанные в присутствии коллагенового экрана, проявляют высокую пролиферативную активность и восстанавливают целостность мембран.
Список литературы Влияние низкотемпературной аргоновой плазмы на жизнеспособность и пролиферацию фибробластов in vitro
- Макаров М.С., Конюшко О.И., Сторожева М.В., Боровкова Н.В., Хватов В.Б., Пономарев И.Н. Патент РФ № 2484474 от 10.06.2013.
- Sen CK, Roy S. Redox signals in wound healing Biochim. Biophys. Acta. 2008; 1780: 1348-1361. DOI: 10.1016/j.bbagen.2008.01.006 EDN: MLKPXD
- Sen CK. Wound healing essentials: let there be oxygen, Wound Repair Regen. 2009; 17: 1-18. DOI: 10.1111/j.1524-475X.2008.00436.x
- Yang B, Chen Y, Shi J. Reactive Oxygen Species (ROS)-Based Nanomedicine. Chem Rev. 2019; 119(8): 4881-4985. EDN: RMZBBJ
- Reuter S, Stephan & von Woedtke, Thomas & Weltmann, Klaus-Dieter. The kINPen - A review on physics and chemistry of the atmospheric pressure plasma jet and its applications. Journal of Physics D Applied Physics. 2018; 51. DOI: 10.1088/1361-6463/aab3ad
- Xiong Z, Zhao S, Yan X. Nerve stem cell differentiation by a one-step cold atmospheric plasma treatment in vitro. J Vis Exp. 2019; Jan 11: 143.
- Hajam YA, Rani R, Ganie SY, Sheikh TA, Javaid D, Qadri SS, Pramodh S, Alsulimani A, Alkhanani MF, Harakeh S, Hussain A, Haque S, Reshi MS Oxidative Stress in Human Pathology and Aging: Molecular Mechanisms and Perspectives. Cells. 2022; 11(3): 552. DOI: 10.3390/cells11030552 EDN: CJVEAV
- Crochemore C, Cimmaruta C, Fernández-Molina C, Ricchetti M. Reactive Species in Progeroid Syndromes and Aging-Related Processes. Antioxid Redox Signal. 2022; 37(1-3): 208-228. DOI: 10.1089/ars.2020.8242 EDN: JJXMJS


