Влияние нового ингибитора GSK-3B на процессы адгезии, активации, секреции и агрегации тромбоцитов
Автор: Сиротенко Виктор Сергеевич, Бабков Денис Александрович, Осман Элиас, Спасов Александр Алексеевич
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 3 т.20, 2023 года.
Бесплатный доступ
Тромбообразование - сложный многостадийный процесс, состоящий из последовательных фаз адгезии, активации и агрегации тромбоцитов. Рецепторный ландшафт тромбоцитов представлен множеством подтипом рецепторов и сигнальных путей, связанных с их активацией. Одним из участников этих путей является киназа GSK3P, однако ее роль и функции в регуляции активности тромбоцитов остаются сложным и не до конца выясненным вопросом. Изучение антиагрегантной активности ингибитора GSK3P соединения К-167 показало отсутствие влияния на адгезию и P2Y1-активацию тромбоцитов. В то же время К-167 ингибирует агрегацию, опосредованную GPVI и P2Y12 рецепторами с IC50 3,0 и 7,9 мкМ соответственно. Влияние на тромбоксан А2 и тромбин-индуцированную агрегацию слабое или отсутствует, что подтверждает GSK3p-опосредованный механизм действия. Показано, что важным аспектом антиагрегантной активности данного вещества является ингибирование синтеза тромбоксана А2 in vivo и подавление секреции содержимого гранул тромбоцитов.
Антиагрегантное действие, адгезия, активация, агрегация, 2-оксиндолы, gsk3fi
Короткий адрес: https://sciup.org/142238798
IDR: 142238798 | УДК: 615.273
Текст научной статьи Влияние нового ингибитора GSK-3B на процессы адгезии, активации, секреции и агрегации тромбоцитов
Сердечно-сосудистые заболевания занимают лидирующие позиции среди причин смертности во всем мире [1]. Причиной большинства сердечнососудистых заболеваний является патологический тромбоз артерий, образующийся вследствие разрыва атеросклеротической бляшки или повреждения сосуда. Стратегия лечения и профилактики атеро-тромботических состояний включает использование антиагрегантных средств. У существующих средств из данной группы препаратов описаны нежелатель- ные реакции, существенно ограничивающие их применение: резистентность, отсутствие эффективности при использовании двойных доз, а в случае применения двойной/тройной антитромбоцитарной терапии значительно возрастает риск кровотечений, гастропатий и т. п. [2]. Стадии агрегации кровяных пластинок сопровождаются реализацией множества механизмов, включающих активность рецепторного ландшафта тромбоцитов и их систему вторичных сигнальных мессенджеров. Адгезия и агрегация тромбоцитов на открытом внеклеточном матриксе требует скоординированного взаимодействия гликопротеиновых рецепторов поверхности тромбоцитов с адгезивными макромолекулами. В условиях высокого сдвига первоначальное привлечение тромбоцитов к «реактивной поверхности» опосредовано обратимым взаимодействием между гликопротеиновым рецептором тромбоцитов GP Ib и связанным с коллагеном фактором фон Виллебранда. Это взаимодействие позволяет клеткам устанавливать контакты с коллагеном посредством гликопротеинового рецептора GP VI. Такое взаимодействие приводит к запуску outsidein механизма активации и распространения сигнала с участием комплекса PI3K-Akt-GSK-3β и ведущего к клеточной активации и высвобождению вторичных медиаторов АДФ и тромбоксана А2 (ТхА2) [3]. Эти агонисты вместе с локально продуцируемым тромбином вносят вклад в клеточную активацию, стимулируя рецепторы, связанные с гетеротримерными G-белками, которые индуцируют различные сигнальные события и действуют синергетически, вызывая полную активацию тромбоцитов [4]. В связи с этим является обязательным изучение механизма антиагрегантного действия оригинальных молекул. Согласно множественным исследованиям сигнальный комплекс PI3K-Akt-GSK-3β в тромбоцитах представляет особый интерес, как потенциальная мишень для более селективной фармакотерапии патологической активации тромбоцитарного звена гемостаза [5–7]. В ранее проведенных исследованиях было выявлено новое производное 2-оксиндола соединение К-167, проявляющее выраженную антиагрегантную активность по сравнению ацетилсалициловой кислотой, а также установлено, что соединение К-167 дозозависимо ингибирует фермент GSK-3β [8].
ЦЕЛЬ РАБОТЫ
Изучить влияние данного вещества на процессы адгезии, активации, секреции и агрегации тромбоцитов.
МЕТОДИКА ИССЛЕДОВАНИЯ
Эксперименты выполнены на 12 кроликах-самцах массой 2,5–3,0 кг и 42 нелинейных крысах-самцах (ФГБУН НЦБМТ ФМБА Росии).
3-Пиридин-2-ил-2-оксиндол К-167 синтезирован на кафедре медицинской химии и тонкого органического синтеза МГУ им. М. В. Ломоносова под руководством канд. хим. наук Н. А. Лозинской.
Исследование антиадгезивных свойств проводили в условиях in vitro при добавлении к цельной крови кроликов с помощью двухканального люмиагрегометра Chronolog-700. Образцы цельной крови получали методом свободного падения капли из ушной краевой вены кролика в пробирку, содержащую 3,8%-й раствор натрия цитрата. Активацию рецепторов адгезии тромбоцитов GP VI инициировали раствором коллагена I типа (50 мкг/мл). Об уровне адгезии тромбоцитов к микрофибриллам коллагена судили по значению импеданса [9].
Влияние на активацию тромбоцитов кроликов изучали в условиях in vitro методом малоуглового светорассеяния с помощью лазерного анализатора Лайт-Скан (НПФ «Люмэкс», Россия) (Патент РФ № 2391665, 29.12.2008). В качестве вещества сравнения был использован селективный антагонист P2Y 1 рецепторов тромбоцитов соединение MRS-2179 (Sigma, США).
Определение влияния на секрецию АТФ из плотных гранул тромбоцитов кроликов проводили на двухканальном люмиагрегометре Chronolog-700 с использованием люциферин-люциферазы. Уровень АТФ при этом определялся количественно путем измерения биолюминисценции. В качестве стимулятора тромбоцитов использовали АДФ (5 мкМ) [10].
Антиагрегантные свойства были изучены после стимуляции растворами АДФ (5 мкМ), коллагена (4 мкг/мл), агониста тромбоксановых рецепторов U46619 (3 мкМ) и тромбина (0,5 ЕД/мл) в качестве стимуляторов процессов агрегации тромбоцитов. Исследования проводили в плазме богатой тромбоцитами (при стимуляции АДФ и коллагеном) и суспензии отмытых тромбоцитов (при стимуляции U46619 и тромбином) при помощи двухканального люмиагрегометра Chronolog-700. Для получения суспензии отмытых тромбоцитов производили забор цельной крови кроликов с последующим центрифугированием (250 g, 10 мин). Полученный супернатант (богатая тромбоцитами плазма) повторно центрифугировали (850 g, 20 мин) для осаждения кровяных пластинок. Осадок подвергали ресуспензированию с использованием Tyrode буфера состава: 12,0 мМ NaHCO 3 , 138,0 мМ NaCl, 0,1 мМ CaCl 2 5,5 мМ глюкоза, 2,9 мМ KCl, 2,0 мМ MgCl 2 , 0,4 мМ NaH 2 PO 4 , 10,0 мМ HEPES (pH 7,4) [11].
Определение уровня синтеза TxB 2 в тромбоцитах осуществляли методом ИФА при стимуляции тромбоцитов арахидоновой кислотой (50 мкМ). Исследуемое соединение и препарат сравнения ацетилсалициловую кислоту вводили внутрижелудочно однократно за 2 часа до забора крови из брюшной аорты крыс в дозах ED50 антиагрегантной активности in vivo . Образцы цельной крови получали после наркотизации животных хлоралгидратом (400 мг/кг). Забранную кровь стабилизировали 3,8%-м цитратом натрия (9 : 1). Для исследования получали плазму, богатую тромбоцитами, путем центрифугирования цельной крови крыс при 250 g в течение 10 мин.
Исследование одобрено региональным этическим комитетом IRB 00005839 IORG 0004900 (OHRP) протокол № 2021/10 от 15.02.2021.
Статистическую обработку данных проводили с использованием встроенных функций MS Excel 2019 (расчет значений M, SEM и IC 50 методом линейной регрессии) и программы GraphPad Prism 8.0. Анализ достоверности проводили с применением критерия множественного сравнения 1-сторонний ANOVA с поправкой Тьюки. Данные считали достоверными при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
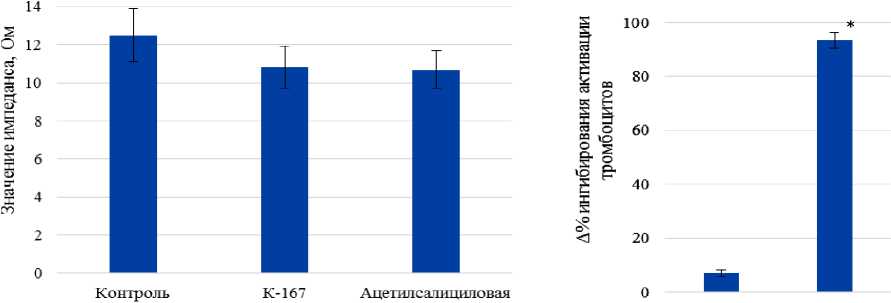
Первоначальная адгезия тромбоцитов к месту повреждения опосредуется связыванием коллагена, экспонированного на стенке поврежденного сосуда, с поверхностным GP VI [12]. При добавлении раствора коллагена в больших концентрациях к цельной крови происходит немедленная адгезия тромбоцитов к микрофибриллам коллагена и изменение значения импеданса. В контрольных образцах крови кроликов уровень импеданса составил 12,5 Ом. При добавлении раствора соединения К-167 к цельной крови в концентрации 100 мкМ наблюдалось снижение процессов адгезии тромбоцитов на 13,6 %, сопоставимое с действием ацетилсалициловой кислоты (рис. 1 а). Изучение процессов адгезии кровяных пластинок к коллагену позволило выявить недостоверное влияние соединения К-167 на данный процесс. Наряду с адгезией тромбоцитов происходит немедленная их активация. Одним из ключевых механизмов активации тромбоцитов является стимуляция P2Y1 рецепторов [13]. Селективный антагонист P2Y1 рецепторов тромбоцитов соединение MRS-2179 способствовало достоверному подавлению активации на 93,4 % (p < 0,05), в то время как исследуемое вещество К-167 имело незначительное влияние на данный процесс (рис. 1 б).
16 120
кислота К-167 MRS-2179
а б
Рис. 1. Влияние соединения К-167 на адгезию (а) и активацию (б) тромбоцитов:
* - данные достоверны относительно контроля, критерий 1 -сторонний ANOVA с поправкой Тьюки (р < 0,05)
С целью рекрутинга циркулирующих кровяных пластинок в процесс тромбообразования активированные тромбоциты высвобождают содержимое гранул хранения (АТФ, АДФ, Ca2+, P-селектин, цитокины и др.). Так, при стимуляции интактных тромбоцитов АДФ наблюдалось увеличение секреции АТФ до 65,9 нМ. Соединение К-167 в концентрации 100 мкМ способствовало достоверному снижению уровня секретируемой АТФ до 8,9 нМ (p < 0,05), что на 86,2% ниже контрольных значений. Такой уровень эффекта позволил провести дозозависимое изучение влияния соединения К-167. В концентрациях 10 и 1 мкМ исследуемое вещество способствовало подавлению секреции тромбоцитов до 22,5 нМ (p < 0,05) и 57,1 нМ соответственно. Значение IC50 при этом составило 6,7 мкМ (рис. 2). Ацетилсалициловая кислота в этих условиях показала меньшее по размеру эффекта подавление секреции АТФ с IC50 68,2 мкМ.
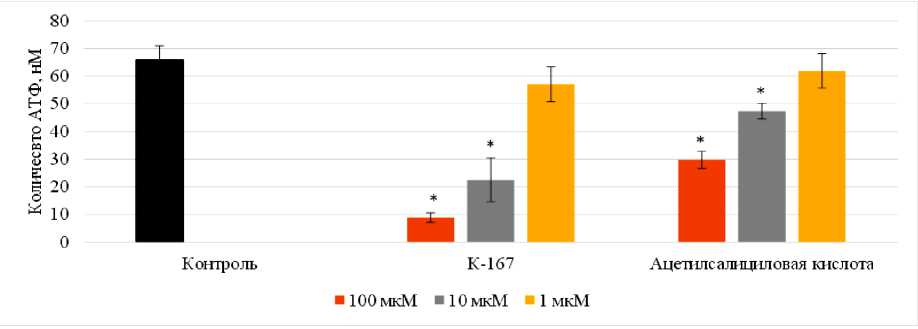
Рис. 2. Влияние соединения К-167 на секрецию АТФ из гранул тромбоцитов in vitro
Примечание: * - данные достоверны относительно контроля, критерий 1-сторонний ANOVA с поправкой Тьюки (р < 0,05)
Секрецию кровяных пластинок способны стимулировать различные агонисты, через множество путей внутриклеточного сигнального каскада. Как видно из рис. 3 наибольшую концентрационно-зависимую активность соединение К-167 проявило в отношении таких индукторов, как АДФ и коллаген. Показатели IC 50 при этом составили 7,9 и 3,0 мкМ соответственно.
В ходе исследований на суспензии отмытых тромбоцитов было установлено, что соединение К-167 дозозависимо предотвращало процессы агрегации тромбоцитов при стимуляции селективным агонистом тромбоксановых рецепторов U46619 (IC 50 43,7 мкМ). При этом вещество К-167 не способствовало снижению агрегации тромбоцитов, индуцированной тромбином.
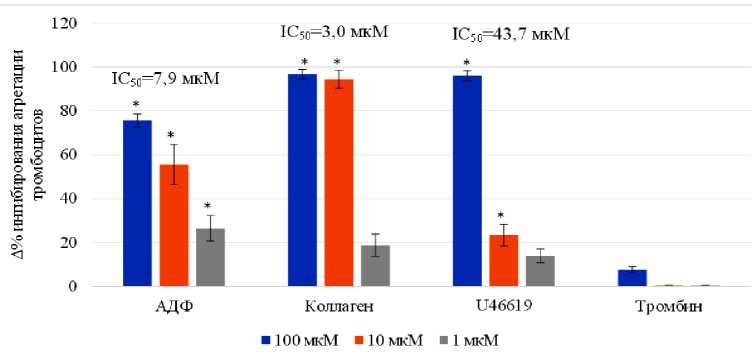
Рис. 3. Влияние соединения К-167 в концентрациях 100, 10 и 1 мкМ на агрегацию тромбоцитов, индуцированную различными агонистами: * - данные достоверны относительно контроля, критерий 1-сторонний ANOVA с поправкой Тьюки (р < 0,05)
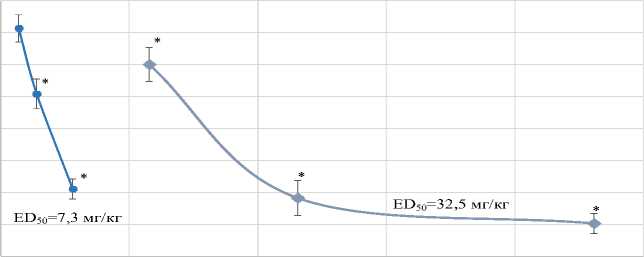
Для более полной оценки действия соединения К-167 на систему гемостаза и, в частности, на тромбоксан-простациклиновую систему, было проведено исследование в условиях целостного организма при однократном внутрижелудочном введении. При стимуляции тромбоцитов крыс контрольной группы арахидоновой кислотой среднее количество TxB 2 составило 172,8 пкг/мл. Препарат сравнения – ацетилсалициловая кислота – при однократном внутрижелудочном введении способствовала дозозависимому ингибированию синтеза TxB 2 . Так, в дозе 92,3 мг/кг наблюдалось достоверное снижение количества TxB 2 до 20,6 пкг/мл ( p < 0,05), что на 88,1% ниже значений контрольной группы. Снижение вводимой дозы до 46,2 и 23,1 мг/кг позволило установить, что уровень
TxB 2 достоверно снижался до 36,5 ( p < 0,05) и 120,1 ( p < 0,05) пкг/мл соответственно. Значение ED 50 при этом для ацетилсалициловой кислоты составило 32,5 мг/кг (рис. 4). Для исследуемого соединения К167 также была установлена способность дозозависимо ингибировать синтез TxB 2 при однократном внутрижелудочном введении. В дозе 11,2 мг/кг соединение К-167 достоверно способствовало снижению уровня TxB 2 ( p < 0,05) до 42,2 пкг/мл, что на 75,6% ниже значений контрольной группы. При снижении дозы до 5,6 мг/кг наблюдалось достоверное ингибирование уровня TxB 2 до 101,7 пкг/мл ( p < 0,05).
В дозе 2,8 мг/кг соединение К-167 способствовало снижению синтеза TxB 2 до 142,7 пкг/мл. Показатель ED 50 при этом составил 7,3 мг/кг.
140 в
а
100 m
X
80 о
20 40 60 80 100
Доза, мг/кг
К-167 Ацетилсалициловая кислота
Рис. 4. Влияние соединения К-167 на уровень TxB2 в тромбоцитах крыс при однократном внутрижелудочном введении: * - данные достоверны относительно контроля, критерий 1 -сторонний ANOVA с поправкой Тьюки (р < 0,05)
При действии на тромбоциты АДФ происходит последовательная активация семейства пуриновых рецепторов (P2Y i и P2Y 12 ) на поверхности кровяных пластинок для достижения полной, необратимой агрегации тромбоцитов [14]. Степень влияния соединения К-167 на активацию тромбоцитов позволяет сделать вывод об отсутствии Р2Ү 1 -зависимого механизма антиагрегантного действия у исследуемого вещества.
Важным этапом является дальнейшая передача сигнала внутрь клетки ( outside-in ) и активация пути PI3K-Akt-GSK3e. Результирующим эффектом активации данного комплекса является стимуляция и стабилизация экспрессии гликопротеинов на поверхности тромбоцитов (GP Ib-IX-V, GP VI и др.) [15], а также высвобождение ионов Ca2+ из внутриклеточного депо, необходимых для активности PLA 2 [16].
Коллаген является лигандом для тромбоцитарного GP VI, экспрессируемого исключительно на тромбоцитах и мегакариоцитах [17]. Сигнальный путь активации GPVI сопровождается увеличением активности PLCy2, которая, в свою очередь, катализирует образование инозитол-1,4,5-трифосфата (IP3) и диацилглицерола (DAG). Образующиеся DAG и IP3 активируют протеинкиназу C (PKC) и высвобождение Ca2+ из внутриклеточных депо соответственно [18]. При этом происходит усиление активности цитозольной PLA2, катализирующей превращение арахидоновой кислоты. Последняя, в свою очередь, подверга ется воздействию ЦОГ-1 и ТхА2-синтазы с образованием мощного проагрегантного вещества тромбоксана А2 [19].
Мы показали, что К-167 обладает различной антиагрегантной активностью в зависимости от природы использованного агониста: коллаген > АДФ >> U46619 >> тромбин. Таким образом, наиболее чувствительными к действию К-167 являются рецепторные каскады GPVI и P2Y 12 , сходящиеся в активации пути PI3K-Akt-GSK3e [20]. GSK3в-опосредованный механизм действия К-167 также подтверждается его способностью подавлять секрецию АТФ из а-гранул (рис. 5). Кроме того, АДФ и коллаген при действии на тромбоциты имеют общие, перекликающиеся пути в системе сигнальных мессенджеров, нацеленные на синтез TxA 2 . Ингибирование процессов агрегации тромбоцитов, вызванных данными агонистами, косвенно может свидетельствовать о способности соединения К-167 оказывать влияние на снижение продукции TxA 2 .
Данная способность для исследуемого соединения была подтверждена в эксперименте по определению уровня TxB 2 в плазме крови крыс методом ИФА. Кроме того, дозозависимое ингибирование агрегации отмытых тромбоцитов, стимулированных агонистом рецепторов TxA 2 U46619, может указывать на наличие антагонистического влияния соединения К-167 на тромбоксановые рецепторы, их экспрессию или сигнальный каскад этих рецепторов.
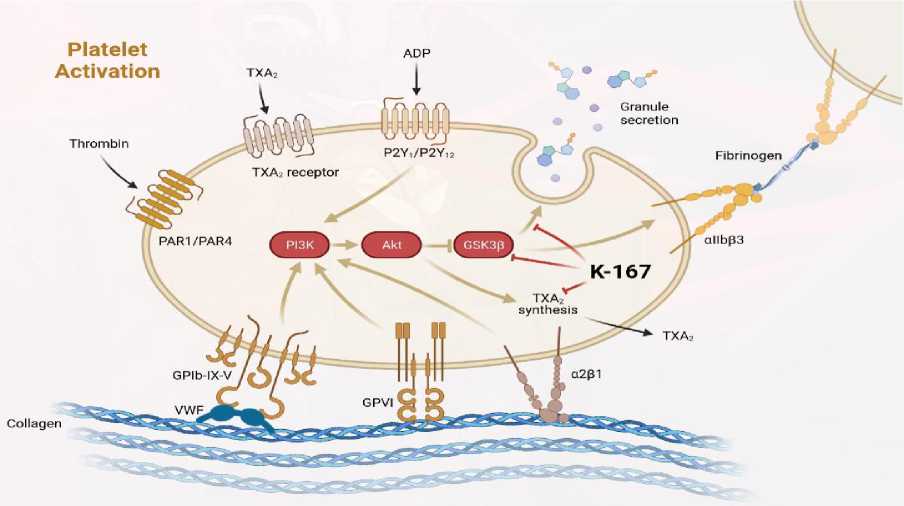
Рис. 5. Предполагаемый механизм антиагрегантного действия соединения К-167
При действии на отмытые тромбоциты раствора тромбина происходит классическая активация PARs-рецепторов на поверхности тромбоцитов, что указывает на функции этого фактора свертывания крови, выходящие за рамки коагуляционного каскада [21].
Тромбин протеолитически расщепляет часть внеклеточной петли этих рецепторов. Являясь мощным индуктором, он опосредует агрегацию тромбоцитов, мобилизацию кальция и изменение формы тромбоцитов, что в итоге приводит к активации рецептора
GP IIb/IIIa и развитию стойкой, необратимой агрегации тромбоцитов [22].
Отсутствие влияния соединения К-167 на тром-бин-индуцированную агрегацию тромбоцитов можно объяснить разнообразием сигнальных каскадов при активации разных подтипов PARs-рецепторов.
На ряду с классическим вариантом активации PAR-рецепторов, сопровождающимся передачей сигнала через G αq/11 , G α12/13 и G αi/o белки, существует дополнительный β-арристиновый путь, связанный с повышением активности Rho-киназы.
ЗАКЛЮЧЕНИЕ
Таким образом, проведенное нами исследование позволяет предположить, что соединение К-167 проявляет антиагрегантные свойства за счет подавления активности сигнальных каскадов рецепторов коллагена и АДФ, а также нарушает секрецию содержимого гранул тромбоцитов при их активации, что, вероятно, опосредовано ингибированием GSK3β. Механизм снижения продукции TxA 2 и подавления TxA 2 -зависимой активации тромбоцитов неясен и требует дополнительного изучения. Также представляется интересным изучение влияния К-167 на стабильность тромба в условиях высоких скоростей сдвига как следствие GSK3β-опосредованной активации ин-тегрина αIIbβ3.
Список литературы Влияние нового ингибитора GSK-3B на процессы адгезии, активации, секреции и агрегации тромбоцитов
- Wang, X., Ziegler, M. et al. Molecular imaging of arte-rial and venous thrombosis. British Journal of Pharmacology. 2021;178(21):4246–4269. https://doi.org/10.1111/bph.15635
- Setiabakti, N. M., Larsson, P., Hamilton, J. R. Phos-phoinositide 3-Kinases as Potential Targets for Thrombosis Prevention. International Journal of Molecular Sciences. 2022;23(9):4840. https://doi.org/10.3390/ijms23094840.
- O’Brien K. A., Stojanovic-Terpo A., Hay N., Du X. An important role for Akt3 in platelet activation and thrombosis. Blood. 2011;118(15):4215–4223. https://doi.org/10.1182/blood-2010-12-323204.
- Nieswandt B., Varga-Szabo D., Elvers, M. Integrins in platelet activation. Journal of Thrombosis and Haemostasis. 2009;7:206–209. https://doi.org/10.1111/j.1538-7836.2009.03370.x
- Chen H., Zhang S. et al.. Fruitflow inhibits platelet function by suppressing Akt/GSK3β, Syk/PLCγ2 and p38 MAPK phosphorylation in collagen-stimulated platelets. BMC Com-plementary Medicine and Therapies. 2022; 22(1):75. https://doi.org/10.1186/s12906-022-03558-5.
- Laurent P.-A., Séverin S. et al. Platelet PI3Kβ and GSK3 regulate thrombus stability at a high shear rate. Blood. 2015;125(5):881–888. https://doi.org/10.1182/blood-2014-07-588335
- Wei G., Xu X. et al. Salidroside inhibits platelet func-tion and thrombus formation through AKT/GSK3β signaling pathway. 2020;12(9):8151–8166. https://doi.org/10.18632/ ag-ing.103131.
- Lozinskaya N. A., Babkov D. A. et al. Synthesis and biological evaluation of 3-substituted 2-oxindole derivatives as new glycogen synthase kinase 3β inhibitors. Bioorganic & Me-dicinal Chemistry. 2019;27(9):1804–1817. https://doi.org/ 10.1016/j.bmc.2019.03.028.
- Perrella, G., Nagy, M., Watson, S. P., Heemskerk, J. W. M. Platelet GPVI (Glycoprotein VI) and Thrombotic Complications in the Venous System. Arteriosclerosis, Thrombosis, and Vas-cular Biology. 2021;41(11):2681–2692. https://doi.org/10.1161/ ATVBAHA.121.316108.
- Ushiki, T., Mochizuki, T. et al. Modulation of ATP Production Influences Inorganic Polyphosphate Levels in Non-Athletes’ Platelets at the Resting State. International Journal of Molecular Sciences. 2022;23(19):11293. https://doi.org/ 10.3390/ijms231911293.
- Zhao J., Xu Y. et al. Roxadustat Does Not Affect Platelet Production, Activation, and Thrombosis Formation. Arteriosclerosis, Thrombosis, and Vascular Biology. 2021;41(10):2523–2537. https://doi.org/10.1161/ATVBAHA.121.316495.
- Koltai K., Kesmarky G. et al. Platelet Aggregometry Testing: Molecular Mechanisms, Techniques and Clinical Im-plications. International Journal of Molecular Sciences. 2017;18(8):1803. https://doi.org/10.3390/ijms18081803.
- Gremmel T., Yanachkov I. B. et al. Synergistic Inhibi-tion of Both P2Y 1 and P2Y 12 Adenosine Diphosphate Recep-tors As Novel Approach to Rapidly Attenuate Platelet-Mediated Thrombosis. Arteriosclerosis, Thrombosis, and Vascular Biolo-gy. 2016;36(3):501–509. https://doi.org/10.1161/ATVBAHA. 115.306885.
- Suzuki T. Hetero-oligomerization and Functional Inter-action between Purinergic Receptors Expressed in Platelets to Regulate Platelet Shape Change. Yakugaku zasshi. 2015;135(12):1335–1340. https://doi.org/10.1248/yakushi.15-00178.
- O’Brien K. A., Gartner T. K. et al. ADP-Stimulated Ac-tivation of Akt During Integrin Outside-In Signaling Promotes Platelet Spreading by Inhibiting Glycogen Synthase Kinase-3β. Arteriosclerosis, Thrombosis, and Vascular Biology. 2012;32(9): 2232–2240. https://doi.org/10.1161/ATVBAHA.112.254680.
- Burke, J. E., Dennis, E. A. Phospholipase A2 struc-ture/function, mechanism, and signaling. Journal of Lipid Re-search. 2009;50:237–S242. https://doi.org/10.1194/jlr.R800033-JLR200.
- Qiao J., Arthur J. F. et al. Regulation of platelet acti-vation and thrombus formation by reactive oxygen species. Re-dox Biology. 2018;14:126–130. https://doi.org/10.1016/ j.redox.2017.08.021.
- Amelirad A., Shamsasenjan K. et al. Signaling Path-ways of Receptors Involved in Platelet Activation andShedding of These Receptors in Stored Platelets. Advanced Pharmaceu-tical Bulletin. 2019;9(1):38–47. https://doi.org/10.15171/apb. 2019.005.
- Lucotti, S. Cerutti, C. et al.. Aspirin blocks formation of metastatic intravascular niches by inhibiting platelet-derived COX-1/thromboxane A2. Journal of Clinical Investigation. 2019;129(5):1845–1862. https://doi.org/10.1172/JCI121985.
- Moroi, A. J., Watson, S. P. Impact of the PI3-kinase/Akt pathway on ITAM and hemITAM receptors: Haemo-stasis, platelet activation and antithrombotic therapy. Biochemi-cal Pharmacology. 2015;94(3):186–194. https://doi.org/ 10.1016/j.bcp.2015.02.004.
- Chandrabalan, A., Ramachandran, R. Molecular mechanisms regulating Proteinase‐Activated Receptors (PARs). The FEBS Journal. 2021;288(8);2697–2726. https://doi.org/ 10.1111/febs.15829.
- Nehaj, F., Sokol, J. et al. Thrombin Receptor Agonist Peptide–Induced Platelet Aggregation Is Reduced in Pa-tients Receiving Dabigatran. Clinical and Applied Throm-bosis/Hemostasis. 2018;24(2):268–272. https://doi.org/ 10.1177/1076029617713871.


