Влияние новых производных азолоазинов с потенциальной противоопухолевой активностью на энергетический обмен в культурах клеток MCF-7 и Vero
Автор: Хумаири А. Х., Удут В. В., Сперанский Д. Л., Аль-газали М. О., Новочадов В. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 4 т.37, 2022 года.
Бесплатный доступ
Введение. Работа направлена на изучение эффектов трех новых производных азолоазинов на окислительный метаболизм глюкозы, чтобы отобрать вещества с максимально приемлемыми характеристиками для дальнейшего доклинического изучения в качестве потенциальных противоопухолевых средств, в том числе для химиотерапии рака молочной железы.Цель работы: выявить метаболические свойства новых производных азолоазинов в части их влияния на метаболизм глюкозы с использованием культуры опухолевых клеток MCF-7 и неопухолевых клеток Vero.Материал и методы. В работе использованы методы клеточных культур, все тестированные соединения применены в конечных концентрациях от 2,5 мкмоль/л. Препаратом сравнения был эпирубицин в той же концентрации. Основные биохимические методики включали в себя определение продукции лактата с помощью коммерческих наборов Olvex Diagnosticum и определение поглощения клетками кислорода с помощью анализатора клеточного метаболизма Seahorse XFe24 Analyzer. Результаты обработаны статистически.Результаты. Продукция лактата в культурах MCF-7 и Vero при действии циклогексил-4-оксоимидазо[5,1-d]-[1,2,3,5] тетразин-8-N-пиперидинил-карбоксамида уменьшалась более чем вдвое, а потребление кислорода - на 19-40%, что являлось максимальным эффектом среди изученных производных азолоазинов. Действие диэтилового эфира 4-аминоимидазо[5,1-с][1,2,4]триазин-3,8-дикарбоновой кислоты и 4-Амино-8-этоксикарбонил-имидазо[5,1-с][1,2,4]триазин-3-N-(п-толуил)-карбоксамида по своим метаболическим эффектам были сходны с препаратом сравнения эпирубицином. Они снижали продукцию лактата в культуре клеток MCF-7 на треть, в культуре клеток Vero - на 21-22%. Потребление кислорода в культуре клеток MCF-7 снижалось на 14-17%, в культуре клеток Vero - на 18-24%.Заключение. Полученные данные позволяют считать 3-Циклогексил-4-оксоимидазо[5,1-d]-[1,2,3,5]тетразин-8-N-пиперидинил-карбоксамид лидером среди новых производных азолоазинов и рекомендовать его для дальнейшего доклинического изучения в качестве потенциального противоопухолевого средства.
Имидазотриазины, имидазотетразины, метаболическая активность, потребление кислорода, клеточная линия mcf7, клеточная линия vero
Короткий адрес: https://sciup.org/149141445
IDR: 149141445 | УДК: 616.1-085.28.065:616-006.6-092 | DOI: 10.29001/2073-8552-2022-37-4-139-148
Текст научной статьи Влияние новых производных азолоазинов с потенциальной противоопухолевой активностью на энергетический обмен в культурах клеток MCF-7 и Vero
Oncological morbidity is continuously increasing worldwide. This situation results in an increase in the total number of deaths from malignant neoplasms and largely determines the structure of expenditures for the diagnosis, prevention, and treatment of major human diseases [1]. According to the World Health Organization (WHO), the mortality of the world population from various malignant tumors in 2017 amounted to 13% of all causes of death, which corresponded to almost nine million cases per year. The annual number of deaths from cancer in the world is predicted to increase to 13 million during the period up to 2030 [2].
Breast cancer is one of the most common and dangerous types of malignant tumors in women. It accounts for 23% of the total number of cancer cases and 14% of cancer deaths, which makes scientific research in this area extremely relevant to overcome both economic and social problems of modern society [3].
All the above predetermines the very significant efforts of the scientific community to obtain new antitumor agents with high specific activity against different types of malignant cells. After primary screening and direct synthesis, the research using cell lines is currently the key moment for identifying the potential of new compounds in order to increase the effectiveness of treatment in modern oncology [4].
Tumor transformation of cells is a complex, multi-stage process that leads to changes in all aspects of cellular metabolism [5, 6]. In tumor cells, increased glucose uptake occurs and, as a result, lactate formation increases even in the presence of high oxygen content in the medium. It is known as the Warburg effect. The active use of glutamine and synthesis of higher fatty acids are other important features of metabolic changes in cancer cells [7, 8]. These metabolic differences between normal and cancer cells can be a biochemical basis for the development of new anticancer drugs. So, inhibition of glycolysis, changes in the processes of glutamine metabolism and fatty acid synthesis compose three possible approaches to metabolic antitumor therapy [9, 10].
New derivatives of azolo[5,1-c][1,2,4]triazines, which are similar in structure to known alkylating drugs as mitozolomide and temozolomide, may be promising and effective objects to search for possible antitumor activity may be [11]. Previously, we identified three new derivatives with the highest cytotoxic activity, which was the basis for their more detailed study [12].
The aim of the work was to identify the metabolic properties of new azoloazine derivatives in terms of their effect on glucose metabolism using a culture of MCF–7 tumor cells and Vero non-tumor cells.
Material and Methods
Three new azoloazine derivatives tested in this work were synthesized at the Yeltsin Ural Federal University [13]. Figure 1 demonstrates that substance 1 is a tetrazine derivative, and substances 2 and 3 are triazine derivatives.
Epirubicin, or [(8S-cis)-10-[(3-amino-2,3,6-trideoxy-α-L-arabinohexo-pyranosyl) oxy]-7,8,9,10-tetrahydro-6,8,11-trihydroxy-8-(hydroxyacetyl)-1-methoxy-5,12- сии Б.Н. Ельцина [13]. Рисунок 1 демонстрирует, что вещество 1 является производным тетразина, а вещества 2 и 3 – производными триазина.
naphthacendion] was used as a comparison drug, a well-studied compound with antitumor activity including against human breast cancer cells.
Производное 1
Derivative 1
Производное 2
Derivative 2
Производное 3
Derivative 3
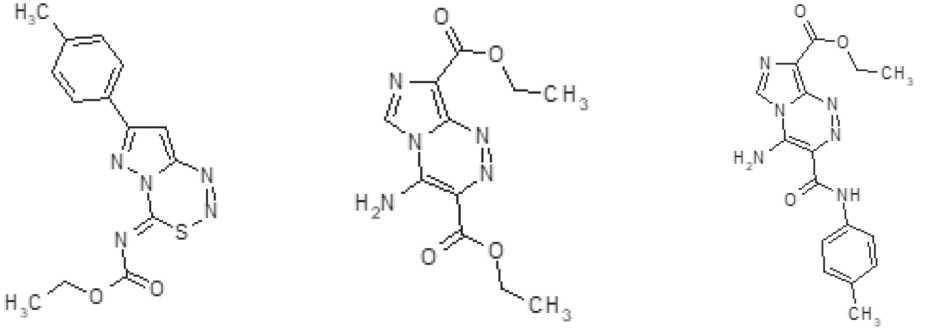
3-Циклогексил-4-оксоимидазо[5,1-d]-
[1,2,3,5]тетразин-8-N-пиперидинил-карбоксамид 3-Cyclohexyl-4-oxoimidazo[5,1-d]-[1,2,3,5] tetrazine-8-N-piperidinyl-carboxamide
Диэтиловый эфир 4-аминоимидазо[5,1-с] [1,2,4]триазин-3,8-дикарбоновой кислоты Diethyl ether of 4-aminoimidazo[5,1-c] [1,2,4]triazine-3,8-dicarboxylic acid
4-Амино-8-этоксикарбонил-имидазо[5,1-с][1,2,4]триазин-3-N-(п-толуил)карбоксамид 4-Amino-8-ethoxycarbonyl-imidazo[5,1-c] [1,2,4]triazine-3-N-(p-toluyl)carboxamide
Рис. 1. Общая характеристика тестируемых веществ – производных азолоазинов
Fig. 1. Structure and nomenclature names of the tested azoloazine derivatives
В качестве препарата сравнения был использован эпирубицин – [(8S-цис)-10-[(3-амино-2,3,6-тридезок-си-α-L-арабиногексо-пиранозил)окси]-7,8,9,10 тетра-гидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-меток-си-5,12-нафтацендион] как хорошо изученное соединение с противоопухолевой активностью, в том числе против клеток рака молочной железы человека.
Методики культивирования клеток
MCF-7 использована в работе как основная опухолевая клеточная линия для исследования метаболических эффектов изучаемых производных азолоазинов [14]. Vero – перевиваемая клеточная культура почечного эпителия африканской зеленой мартышки, была использована как сравнительная [15].
После размораживания клеток мы дважды отмывали их в растворе Хэнкса, используя для осаждения центрифугирование в течение 5 мин при 500 g. Флаконы для культивирования емкостью 10 мл содержали стандартную полную среду состава MEM/DMEM + 2 mM раствор L-глутамина + смесь 1%-го стрептомицина и 1%-го пенициллина (все реактивы производства Панэко, Россия). Для клеточной культуры MCF-7 использовали среду MEM, для культуры Vero DMEM. Размножение клеток происходило до получения необходимого их количества в термостате при температуре 37 оC при наличии 5% CO2 в газовой фазе. При необходимости производили замену питательной среды, используя в качестве критерия результаты определения жизнеспособности клеток в тесте трипано-вого синего и их морфологии при визуализации в инвертированном микроскопе Olympus.
Для определения пути окисления глюкозы клетками в начале клеточные культуры рассевали во флаконы и доращивали до монослоя. При пересеве на планшеты удаляли питательную среду и добавляли в качестве дезинтегратора
Cell Culture Technique
In the work, we used MCF-7 cell line as the main culture to study the metabolic effects of new azoloazine derivatives [14] and the Vero cell line, known transferable cell line of African green monkey renal epithelium, for comparison [15].
After defrosting the cells, we washed them twice in Hanks solution using centrifugation for 5 minutes at 500g for precipitation. The 10 mL culture vessels contained a standard MEM/DMEM + 2 mM L-glutamine solution + a mixture of 1% streptomycin and 1% penicillin; all reagents were manufactured by PanEco, Russia. MEM medium was used for MCF-7 cell culture, DMEM was used for the Vero cells. The cells multiplied until the required amount was obtained in the thermostat at a temperature of 37 °C in the presence of 5% CO2 in the gas phase. If necessary, we replaced the nutrient medium using the results of assessing the viability of cells in the Trypan blue test and their morphology when visualized by an inverted Olympus microscope as criterion.
Determination of Glucose Oxidation Pathway in Cell Cultures. To determine the metabolic activity, we initially seeded cells into vessels and grew them to a monolayer. Replating the cells onto tablets consisted in sequential removing the nutrient medium, adding 0.25% trypsin-EDTA as a disintegrator, and centrifuging for 5 min at 1000g. Then, we resuspended the cells in 2 mL of a complete nutrient medium of the following composition: MEM /DMEM + fetal calf serum (FCS) + 2 mM L-glutamine solution + a mixture of 1% streptomycin and 1% penicillin to prepare a suspension at the rate of 105 cells per 1 mL of medium. Each hole of the tablet contained 100 mL of suspension with 104 cells, and the final concentration трипсин-EDTA 0,25%, после чего центрифугировали 5 мин при 1000 g. Осадок ресуспензировали в 2 мл полной питательной среды состава MEM/DMEM + фетальная телячья сыворотка (FCS) + 2 mM раствор L-глутамина + смесь 1%-го стрептомицина и 1%-го пенициллина, готовили суспензию из расчета 105 клеток на 1 мл среды. В каждую лунку планшета помещали 100 мкл суспензии (104 клеток) и добавляли исследуемые вещества в конечных концентрациях 2,5 мкмоль/л. Помимо этого формировали отрицательный контроль и положительный контроль (10% диметилсульфоксида). Помещали планшет на 1 ч в СО2-инкубатор.
Культивирование происходило до тех пор, пока в каждой лунке не наблюдалась конфлюэнция ~ 95%. Затем производили замену сред. Культивировали планшеты в течение 24 ч. По истечении этого времени отбирали культуральную жидкость из лунок, центрифугировали в течение 3 мин при 500 g и проводили определение лактата при помощи коммерческого набора Olvex Diagnosticum в соответствии с протоколом производителя на спектрофотометре Olvex Diagnosticum против холостой пробы при длине волны 505 нм. Концентрацию молочной кислоты выражали как
C = 3,3 Ee/Ec mM, где Ee и Ec – оптические плотности опытной и калибровочной проб соответственно. Клетки снимали с лунок, в которых они находились, и проводили следующий этап исследования.
Определение поглощения кислорода клетками оценивали с помощью метода полярографии [16]. Измерение проводили с помощью анализатора клеточного метаболизма Seahorse XFe24 Analyzer (Agilent Technologies). Вначале инкубировали среду для полярографии состава 1 mM EDTA + 1,2 mM MgCl2 + 1 M таурин + 5 mM КН2РО4 + 20 mM HEPES буфер + 100 mM сахароза (рН 7,4) в водяном термостате при температуре 33 оC в течение 10 мин. Далее помещали 1 мл среды, содержащей 2 × 106 клеток MCF-7/Verо, в полярографическую ячейку.
Последовательно регистрировали скорость дыхания при таком составе содержимого ячейки после внесения 100 мкл олигомицина как ингибитора АТФ-синтазы, 100 мкл ротенона для ингибирования I комплекса и 100 мкл 2,4-динитрофенола. Клеточное дыхание в каждом случае регистрировали в течение 3 мин.
Статистический анализ результатов эксперимента проводился в пакете STATISTICA 10.0 и предусматривал сравнение показателей каждой клеточной линии в опытной и контрольной группах. Количественные показатели описывались медианами и межквартильными диапазонами Me [ Q 1 ^ Q 3 ]. Внутригрупповой сравнительный анализ воздействия т рех производных азолоазинов и эпируби-цина и контрольной подгруппы со стандартной полной средой осуществлялся по критерию Краскела – Уоллиса с апостериорными сравнениями по критерию Данна. Сравнение количественных показателей в двух независимых группах культур клеточных линий проводилось по критерию Манна – Уитни. Пороговый уровень статистической значимости при проверке гипотезы о различиях показателей в группах составлял 0,05.
Результаты исследования
Изменения продукции лактата клеточными культурами после введения тестируемых веществ представлены в таблице 1.
of tested substances was of 2.5 mM. In addition, we prepared negative control and positive control using 10% dimethyl sulfoxide. The incubation time was 24 hours. The plate was placed to CO2 chamber for one hour.
Cell culturing continued till reaching ~95% confluence in each well. After that, the medium was substituted. After incubation, we pipetted the culture fluid from the vessels, centrifuged for 3 minutes at 500 g, and determined lactate concentration using a commercial Olvex Diagnosticum kit and spectrophotometer in accordance with the manufacturer’s protocol against a blank sample at a wavelength of 505 nm. The lactic acid concentration was calculated as
C = 3,3 E e/ E c mM , where E e and E c were the optical densities of the experimental and calibration samples, respectively. The cells were removed from the wells where they were and transferred to the next stage of the study.
Determination of oxygen uptake by cells was evaluated using the polarography method [16]. We carried out the measurement using the Seahorse XFe24 Analyzer of cellular metabolism manufactured by Agilent Technologies. The polarography medium consisted of 1 mM EDTA + 1.2 mM MgCl2 + 1 M taurine + 5 mM KN2PO4 + 20 mM HEPES buffer + 100 mM sucrose and had pH-value of 7.4. The first step consisted in the incubation of this medium at a temperature of 33 °C for 10 min in water thermostat. Next, we put 1 mL of the medium containing 2 × 106 MCF-7/Vero cells into each polarographic cell.
The respiration rate was sequentially recorded with such a composition of the cell contents, after the introduction of 100 µL of oligomycin as an ATP synthase inhibitor, after the introduction of 100 µL of rotenone to inhibit the complex I, and after the introduction of 100 µL of 2,4-dinitrophenol. Record time of each cellular respiration model lasted for three minutes.
The statistical evaluation of the experimental results provided the comparison of the indicators of each cell line in the experimental and control groups. Statistica 10.0 software package was used for this procedure. The intra-group comparative analysis consisted in the estimation of Kraskel – Wallis criterion in nonparametric version of ANOVA, followed by multiple Bonferroni – Dann comparisons. The comparison between the groups was carried out according to the Mann – Whitney criterion. The differences at a confidence level of p < 0.05 were considered statistically significant.
Results
Table 1 presents changes in lactate production by cell cultures after administration of the tested substances.
In the control, lactate production by MCF-7 tumor cells significantly exceeded the value of a similar indicator when using a culture of non-transformed Vero cells.
Epirubicin caused the suppression of lactate production in MCF-7 cells by 25%, while the suppression in Vero cells was only by 8%. This fact reflected the general ability of antitumor drugs to influence metabolic processes in transformed cells to a greater extent, in comparison with non-tumor cells.
Таблица 1. Продукция лактата в культуре клеток MCF-7 и Vero после введения эпирубицина и трех новых производных азолоазинов, Me [ Q 1 * Q 3 ], ммоль/л
Table 1. Lactate production in MCF-7 and Vero cell cultures after administration of three new azoloazine derivatives comparing to epirubicin, Me [ Q 1 * Q 3 ], mM/L
|
Условия культивирования Cultivation conditions |
Культура клеток Cell culture |
|
|
MCF-7 |
Vero |
|
|
Контроль / Control |
9,75 [9,16 ÷ 10,22] |
7,58 * [7,09 ÷ 8,16] |
|
Эпирубицин / Epirubicin |
7,33 # [7,00 ÷ 7,71] |
7,01 [6,63 ÷ 7,40] |
|
Производное 1 / Derivative 1 |
4,75 # [4,41 ÷ 5,17] |
3,80 *# [3,46 ÷ 4,02] |
|
Производное 2 / Derivative 2 |
6,24 # [5,89 ÷ 6,47] |
5,89 *# [5,53 ÷ 6,24] |
|
Производное 3 / Derivative 3 |
6,40 # [6,08 ÷ 6,72] |
5,97 *# [5,60 ÷ 6,33] |
Примечание: статистически значимые различия * – между MCF-7 и Vero, # – между измененными средами и стандартной полной средой ( p < 0,05).
Note: The sigh * expresses statistically significant differences ( p < 0,05) between MCF-7 and Vero cell cultures; the sigh # expressed the analogue differences between control and tested substance action ( p < 0.05).
Таблица 2. Показатели дыхания клеток MCF-7 и Vero после введения эпирубицина и производных азолоазинов, Me [ Q 1 * Q 3 ], нмоль/с/106
Table 2. Respiration rates of MCF-7 and Vero cells after administration of three new azoloazine derivatives comparing to epirubicin, Me [ Q 1 * Q 3 ], nM/sec/106
|
Условия культивирования Cultivation conditions |
Культура клеток Cell lines |
|
|
MCF-7 |
Vero |
|
|
Интактные клетки Intact cells |
||
|
Базовое дыхание / Base respiration Олигомицин / Oligomycin 2,4-динитрофенол / 2,4-Dinitrophenol Ротенон / Rotenone |
12,05 [10,61 ÷ 13,55] 7,68 [6,80 ÷ 9,72] 12,53 [11,77 ÷ 13,94] 9,15 [8,07 ÷ 9,96] |
15,77 [14,48 ÷ 16,70] * 10,30 [9,02 ÷ 11,98] * 16,25 [14,94 ÷ 17,89] * 9,23 [8,25 ÷ 10,47] |
|
Эпирубицин Epirubicin |
||
|
Базовое дыхание / Base respiration Олигомицин / Oligomycin 2,4-динитрофенол / 2,4-Dinitrophenol Ротенон / Rotenone |
11,52 [10,30 ÷ 12,76] 7,28 [6,41 ÷ 8,16] 11,95 [10,56 ÷ 13,21] 8,62 [7,82 ÷ 9,47] |
14,68 [12,96 ÷ 16,33] * 9,75 [8,69 ÷ 10,88] * 15,26 [14,02 ÷ 17,86] * 8,91 [7,82 ÷ 10,15] |
|
Производное 1 Derivative 1 |
||
|
Базовое дыхание / Base respiration Олигомицин / Oligomycin 2,4-динитрофенол / 2,4-Dinitrophenol Ротенон / Rotenone |
8,42 [7,15 ÷ 9,92] # 5,35 [4,70 ÷ 6,06] # 9,20 [7,96 ÷ 10,38] # 6,94 [6,17 ÷ 7,69] # |
11,02 [9,86 ÷ 12,25] *# 6,50 [5,71 ÷ 7,34] *# 9,77 [8,85 ÷ 10,97] # 7,48 [6,84 ÷ 8,22] # |
|
Производное 2 Derivative 2 |
||
|
Базовое дыхание / Base respiration Олигомицин / Oligomycin 2,4-динитрофенол / 2,4-Dinitrophenol Ротенон / Rotenone |
10,04 [8,83 ÷ 11,20] # 6,40 [5,86 ÷ 7,35] 10,46 [9,21 ÷ 11,85] # 7,71 [6,89 ÷ 8,87] # |
13,01 [11,65 ÷ 14,45] * 8,23 [7,46 ÷ 9,12] *# 12,53 [11,30 ÷ 13,78] *# 8,76 [7,96 ÷ 9,53] |
|
Производное 3 Derivative 3 |
||
|
Базовое дыхание / Base respiration Олигомицин / Oligomycin 2,4-динитрофенол / 2,4-Dinitrophenol Ротенон / Rotenone |
9,84 [8,60 ÷ 11,03] # 6,28 [5,70 ÷ 7,11] # 10,26 [9,04 ÷ 11,74] # 7,60 [6,77 ÷ 8,66] # |
12,80 [11,44 ÷ 14,23] * 8,11 [7,37 ÷ 9,02] *# 12,35 [11,09 ÷ 13,56] *# 8,58 [7,79 ÷ 9,35] * |
Примечание: статистически значимые различия * – между MCF-7 и Vero, # – между измененными средами и стандартной полной средой ( p < 0,05).
Note: the sigh * expresses statistically significant differences (p < 0,05) between MCF-7 and Vero cell cultures; the sigh # expressed the analogue differences between control and tested substance action ( p < 0.05).
В контроле продукция лактата клетками опухолевой линии MCF-7 достоверно превышала величину аналогичного показателя при использовании культуры нетрасфор-мированных клеток Vero.
Cultivation of MCF-7 in the presence of derivative 1 led to a decrease in lactate production by more than half, a similar decrease was character for Vero cell culture. Derivative 2 caused a decrease in lactate production in
Эпирубицин вызывал подавление продукции лактата клетками линии MCF-7 на 25%, клетками линии Vero – только на 8%. Это отражало общую способность противоопухолевых препаратов в большей степени влиять на метаболические процессы в трансформированных клетках в сравнении с неопухолевыми.
Культивирование MCF-7 в присутствии производного 1 вызывало уменьшение продукции лактата более чем вдвое, в культуре клеток Vero зарегистрировано аналогичное снижение. Производное 2 вызывало снижение продукции лактата в культуре клеток MCF-7 на 36%, в культуре клеток Vero – на 22%. Производное 3 демонстрировало примерно ту же метаболическую активность: в культуре клеток MCF-7 продукция лактата снижалась на треть, в культуре клеток Vero – на 21%.
Результаты влияния тестируемых веществ на показатели потребления кислорода клетками MCF-7 и Vero показаны в таблице 2.
Введение эпирубицина в культуру клеток MCF-7 приводило к снижению показателей базового дыхания на 5%, остальных тестовых показателей (в присутствии олигоми-цина, 2,4- динитрофенола и ротенона) – в пределах 5–6%. Тот же препарат при введении в культуру клеток Vero вызывал снижение показателей базового дыхания, в сравнении с контролем, на 7%, остальных показателей – на 3–6%. Это отражало общее снижение числа клеток, сохранившихся после воздействия противоопухолевого препарата, и их метаболической активности. В то же время, полученную динамику следует признать весьма умеренной.
Производное 1 приводило в культуре клеток MCF-7 к снижению базового дыхания на 30%, потребления кислорода на фоне действия олигомицина – также на 30%, 2,4-динитрофенола – на 27%, ротенона – на 24%. Снижение базового дыхания в культуре клеток Vero составило 31%, остальных изучаемых показателей в пределах от 19% (ротенон) до 40% (2,4-динитрофенол).
Производное 2 приводило в культуре клеток MCF-7 к снижению базового дыхания на 14%, потребления кислорода на фоне тестовых воздействий – в пределах 16– 17%. В культуре клеток Vero снижение базового дыхания составило 18%, остальных изучаемых показателей – в пределах от 19 до 24%.
Введение производного 3 в культуру клеток MCF-7 сопровождалось снижением базового дыхания на 18%, потребления кислорода на фоне тестовых воздействий – в пределах 17–19%. Снижение базового дыхания в культуре клеток Vero составило 19%, при действии олигомицина – 22%, 2,4-динитрофенола – 24%, ротенона – только 7%.
Обсуждение
Выполняя работу, мы предполагали, что, во-первых, у опухолевых клеток продукция лактата будет выше, чем у неопухолевых в силу более высокой интенсивности метаболизма в целом и за счет эффекта Варбурга. Во-вторых, мы считали, что цитотоксическое и генотоксическое действие производных азолоазинов приведет к критическим изменениям клеточного метаболизма, в результате чего снизится продукция лактата и потребление кислорода клетками в культуре.
Первое предположение подтвердилось, и в наших опытах клетки линии MCF7 демонстрировали продукцию лактата почти на треть большую, чем клетки линии Vero. Полученные данные согласуются с теорией метаболического перепрограммирования опухолевых клеток (эффектом
MCF-7 cell culture by 36%, and in Vero cell culture by 22%. Derivative 3 showed approximately the same metabolic activity; in MCF-7 cell culture the lactate production decreased by a third, in the Vero cell culture it decreased by 21%.
Table 2 shows the results of the effect of the tested substances on the oxygen consumption of MCF-7 and Vero cells.
The introduction of epirubicin into the culture of MCF-7 cells led to a decrease in basic respiration by 5%, the remaining test parameters in the presence of oligomycin, 2,4-dinitrophenol and rotenone altered within 5–6%. The same drug, when injected into the culture of Vero cells, caused decrease in the monitored indicators of cell respiration by 7% and other parameters by 3–6% in comparison with the control. This reflected both a general decrease in the number of cells preserved after exposure to antitumor drug and their residual metabolic activity. At the same time, the resulting dynamics should be considered very moderate.
Derivative 1 in MCF-7 cell culture resulted in a 30% decrease in basic respiration, oxygen consumption against the background of the action of oligomycin also by 30%. 2,4-dinitrophenol and rotenone decreased oxygen consumption by 27% and 24%, respectively. The decrease in basic respiration in Vero cell culture was 31%, the other studied indicators ranged from 19% (rotenone) to 40% (2,4-dinitrophenol).
Derivative 2 resulted in a decrease in basic respiration by 14% in the culture of MCF-7 cells, oxygen consumption against the background of test effects decreased in the range of 16–17%. In the culture of Vero cells, the decrease in basic respiration was 18%, the other studied indicators diminished from 19% to 24%.
The introduction of derivative 3 into the culture of MCF-7 cells was accompanied by a decrease in all basic respiration by 18%. The decrease in respiration in the presence of test compounds was within 17–19%. Basic respiration in Vero cell culture decreased by 19%, by 22% in the presence of oligomycin, by 24% in the presence of 2,4-dinitrophenol, and only by 7% in the presence of rotenone.
Discussion
The first our assumption was confirmed, and in these experiments, the cells of the MCF 7 line demonstrated lactate production almost a third greater than the cells of the Vero line. The data obtained are consistent with the theory of metabolic reprogramming of tumor cells known as the Warburg effect, characterized primarily by a shift in energy supply from mitochondrial oxidative phosphorylation to aerobic glycolysis [17]. The principles
Варбурга), характеризующейся, в первую очередь, сдвигом в энергообеспечении от митохондриального окислительного фосфорилирования к аэробному гликолизу [17]. Принципы, регулирующие гликолитическую регуляцию в раковых клетках, подробно рассмотрены в обзоре [18].
Введение эпирубицина приводило лишь к незначительному снижению продукции лактата клетками линий MCF-7 и Vero. Производное 1 вызывало уменьшение продукции лактата более чем вдвое в обеих культурах. Производные 2 и 3 обладали сходными, но меньшими по амплитуде эффектами. Это отражало общую способность противоопухолевых препаратов в большей степени влиять на метаболические процессы в трансформированных клетках в сравнении с неопухолевыми.
Если проанализировать полученные результаты, исходя из современных представлений о межуточном обмене в опухолевой клетке, то им можно найти и другое объяснение. Если ранее считалось, что при злокачественной трансформации клетка помимо глюкозы сохраняет весьма ограниченное количество энергетических и синтетических субстратов, то в настоящее время эта концепция подвергается систематической критике. Эффект Варбурга приводит к накоплению промежуточных метаболитов, активно использующихся раковой клеткой для синтеза липидов, аминокислот и нуклеотидов. В качестве источников энергии в митохондриальном окислении активно применяются ацетат и другие жирные кислоты, лактат, аминокислоты с разветвленной цепью, серин и глицин. Эти предшественники дополняют метаболиты-предшественники гликолиза и необходимы для поддержки пролиферации [8, 10].
Сравнение опухолевых и неподверженных трансформации клеток показало относительно более низкое потребление кислорода в культуре с опухолевой трансформацией в среднем на 10–20%. Это согласуется с представлениями о преимущественно анаэробном энергетическом потоке в опухолевых клетках и является подтверждением адекватности примененных клеточных моделей [19].
Далее было выявлено, что базовое дыхание опухолевых клеток достаточно умеренно снижается при введении в культуру тестируемых соединений. Это может свидетельствовать о том, что культура MCF-7 использует внутренние механизмы для переключения метаболических путей в зависимости от условий окружающей среды [20].
Полученные нами данные могут быть положены в основу новых исследований, направленных на изучение механизмов метаболической перестройки опухолевых клеточных линий при изменении концентраций базовых метаболитов в культуральной среде, к примеру, исследования ингибиторов основных метаболических путей с использованием 2-дегидроглюкозы, 3-бромпирувата, аминотрансфераз и т. п. Полученные данные также можно использовать для управления системой культивирования и верификации метаболических изменений при испытании новых противоопухолевых средств in vitro .
Заключение
Полученные результаты свидетельствуют, как минимум, о двух фактах. Во-первых, воздействие тестируемых соединений на метаболизм нетрансформированных клеток несколько сильнее, чем на опухолевые. Во-вторых, из отобранных производных азолоазинов наибольший эффект на продукцию лактата и потребление кислорода клетками оказывает производное 1, а метаболические эффекты производных 2 и 3 сходны по амплитуде и заметно слабее.
governing glycolytic regulation in cancer cells are well discussed in detail in the review [18].
Epirubicin administration caused only a slight decrease in lactate production by MCF-7 and Vero cells. Derivative 1 caused a reduction in lactate production by more than half in both cultures. Derivatives 2 and 3 had similar but smaller amplitude effects. This reflected the general ability of antitumor drugs to influence metabolic processes in transformed cells to a greater extent, in comparison with non-tumor cells.
If we analyze the results obtained based on modern ideas about the oxygen-dependent metabolism in a tumor cell, then another explanation can be found for them. If it was previously believed that during malignant transformation, the cell, in addition to glucose, retains a very limited amount of energy and synthetic substrates, now this concept is being systematically criticized. The Warburg effect leads to the accumulation of intermediate metabolites that are actively used by the cancer cell for the synthesis of lipids, amino acids, and nucleotides. Acetate and other fatty acids, lactate, branched chain amino acids, serine, and glycine may actively utilized as energy sources in mitochondrial oxidation. These precursors complement glycolysis precursor metabolites and they are necessary to support proliferation [8, 10].
A comparison of tumor and non-transformed cells showed a relatively lower oxygen consumption in a culture with tumor transformation by an average of 10-20%. This is consistent with the ideas of a predominantly anaerobic energy flow in tumor cells and is a confirmation of the adequacy of the applied cellular models [19].
Further, we found that the basic respiration of tumor cells decreases moderately enough as a result of introducing the tested compounds into the culture. This may indicate for MCF-7 culture to use internal mechanisms for reprogramming metabolic pathways in defense on the environmental conditions [20].
The data obtained can be used as the basis for new studies aimed at studying the mechanisms of metabolic restructuring of tumor cell lines with changes in the concentrations of basic metabolites in the culture medium, for example, the study of inhibitors of the main metabolic pathways using 2-dehydroglucose, 3-brompyruvate, aminotransferases, etc. These data can also be used to control the cultivation system and verification of metabolic changes during testing of new antitumor agents in vitro .
Conclusion
The results obtained indicate at least two facts. Firstly, the effect of the tested compounds on the metabolism of untransformed cells is somewhat stronger than on tumor cells. Secondly, of the selected azoloazine derivatives, derivative 1 has the greatest effect on lactate production and oxygen consumption by cells, while the metabolic effects of derivatives 2 and 3 are similar in amplitude and noticeably weaker.
Lactate production in MCF-7 and Vero cell cultures decreased by more than half under the action of derivative 1, and oxygen consumption decreased by 19%-40%, which was the maximum effect among the studied
Продукция лактата в культурах клеток MCF-7 и Vero при действии производного 1 уменьшалась более чем вдвое, а потребление кислорода – на 19–40%, что являлось максимальным эффектом среди изученных производных азолоазинов. Производные 2 и 3 по своим метаболическим эффектам были сходны с препаратом сравнения эпирубицином. Они снижали продукцию лактата в культуре клеток MCF-7 на треть, в культуре клеток Vero – на 21–22%. Потребление кислорода в культуре клеток MCF-7 снижалось на 14–17%, в культуре клеток Vero – на 18–24%.
Как итог, полученные данные позволяют считать производное 1 (3-Циклогексил-4-оксоимидазо[5,1-d]-[1,2,3,5] тетразин-8-N-пиперидинил-карбоксамид) лидером среди новых производных азолоазинов и рекомендовать его для дальнейшего доклинического изучения в качестве потенциального противоопухолевого средства.
Список литературы Влияние новых производных азолоазинов с потенциальной противоопухолевой активностью на энергетический обмен в культурах клеток MCF-7 и Vero
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A. et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2021;71(3):209-249. DOI: 10.3322/caac.21660.
- Wild C.P., Weiderpass E., Stewart B.W. World Cancer Report: Cancer research for cancer prevention. Lyon, France: International Agency for Research on Cancer; 2020.
- Rositch A.F., Unger-Saldana K., DeBoer R.J., Ng'ang'a A., Weiner B.J. The role of dissemination and implementation science in global breast cancer control programs: Frameworks, methods, and examples. Cancer. 2020;126(10):2394-2404. DOI: 10.1002/cncr.32877.
- Gradishar W.J., Anderson B.O., Abraham J., Aft R., Agnese D., Allison K.H. et al. Breast Cancer, Version 3.2020, NCCN Clinical Practice Guidelines in Oncology. J. Natl. Compr. Canc. Netw. 2020;18(4):452-478. DOI: 10.6004/jnccn.2020.0016.
- Kang Y.P., Ward N.P., DeNicola G.M. Recent advances in cancer metabolism: A technological perspective. Exp. Mol. Med. 2018;50(4):1-16. DOI: 10.1038/s12276-018-0027-z.
- El-Sahli S., Wang L. Cancer stem cell-associated pathways in the metabolic reprogramming of breast cancer. Int. J. Mol. Sci. 2020;21(23):9125. DOI: 10.3390/ijms21239125.
- Gentric G., Mieulet V., Mechta-Grigoriou F. Heterogeneity in cancer metabolism: New concepts in an old field. Antioxid. Redox Signal. 2017;26(9):462-485. DOI: 10.1089/ars.2016.6750.
- Vander Heiden M.G., DeBerardinis R.J. Understanding the intersections between metabolism and cancer biology. Cell. 2017;168(4):657-669. DOI: 10.1016/j.cell.2016.12.039.
- Bhardwaj V., He J. Reactive oxygen species, metabolic plasticity, and drug resistance in cancer. Int. J. Mol. Sci. 2020;21(10):3412. DOI: 10.3390/ijms21103412.
- Park J.H., Pyun W.Y., Park H.W. Cancer metabolism: phenotype, signaling and therapeutic targets. Cells. 2020;9(10):2308. DOI: 10.3390/ cells9102308.
- Garza-Morales R., Gonzalez-Ramos R., Chiba A., Montes de Oca-Luna R., McNally L.R., McMasters K.M. et al. Temozolomide enhances triple-negative breast cancer virotherapy in vitro. Cancers (Basel). 2018;10(5):144. DOI: 10.3390/cancers10050144.
- Хумаири А.Х., Сперанский Д.Л., Садчикова Е.В. Синтез и цитоток-сическая активность новых производных азолотриазина при изучении на клеточных культурах. Химико-фармацевтический журнал. 2022;56(6):17-22. DOI: 10.30906/0023-1134-2022-56-6-17-22. Al-Humairi A.H., Speransky D.L., Sadchikova E.V. Synthesis and cytotoxic activity of new azolotriazines studied on cell cultures. Khi-miko-farmatsevticheskii zhurnal. 2022;56(6):17-22. (In Russ.). DOI: 10.30906/0023-1134-2022-56-6-17-22.
- Alexeeva D.L., Sadchikova E.V., Volkova N.N., Efimov I.V., Jacobs J., Van Meervelt L. et al. Reactivity of 3-substituted pyrazole-5-diazoni-um salts towards 3-azolyl enamines. Synthesis of novel 3-azolylpyra-zolo[5,1-c][1,2,4]triazines. ARKIVOC. 2016;(iv):114-129. DOI: 10.3998/ ark.5550190.p009.571.
- Alexandrova R., Dinev D., Gav^^^a-Valct^a I., Gavrilov I. Cell cultures as model systems in breast cancer research. Merit Res. J. Med. Med. Sci. 2019;7(2):73-79. DOI: 10.5281/zenodo.2579323.
- Andreani N.A., Renzi S., Piovani G., Ajmone Marsan P., Bomba L., Villa R. et al. Potential neoplastic evolution of Vero cells: In vivo and in vitro characterization. Cytotechnology. 2017;69(5):741-750. DOI: 10.1007/ s10616-017-0082-7.
- Traba J., Miozzo P., Akkaya B., Pierce S.K., Akkaya M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. J. Vis. Exp. 2016;(117):54918. DOI: 10.3791/54918.
- Katzir R., Polat I.H., Harel M., Katz S., Foguet C., Selivanov V.A. et al. The landscape of tiered regulation of breast cancer cell metabolism. Sci. Rep. 2019;9(1):17760. DOI: 10.1038/s41598-019-54221-y.
- Cairns R.A., Mak T.W. The current state of cancer metabolism. Nat. Rev. Cancer. 2016;16:613-614. DOI: 10.1038/nrc.2016.100.
- Ramzan R., Michels S., Weber P., Rhiel A., Irqsusi M., Rastan A.J. et al. Protamine sulfate induces mitochondrial hyperpolarization and a subsequent increase in reactive oxygen species production. J. Pharmacol. Exp. Ther. 2019;370(2):308-317. DOI: 10.1124/jpet.119.257725.
- Zambrano A., Molt M., Uribe E., Salas M. Glut 1 in cancer cells and the inhibitory action of resveratrol as a potential therapeutic strategy. Int. J. Mol. Sci. 2019;20(13):3374. DOI: 10.3390/ijms20133374.


