Влияние одностенных углеродных нанотрубок на биопленкообразование актинобактерий рода Rhodococcus и протеобактерий активного ила
Автор: Максимова Юлия Геннадьевна, Быкова Яна Евгеньевна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2022 года.
Бесплатный доступ
Исследовано влияние одностенных углеродных нанотрубок (ОУНТ) на формирование и разрушение биопленок протеобактерий активного ила и актинобактерий рода Rhodococcus. Показано, что ОУНТ не ингибирует формирование биопленок этих бактерий и не вызывает их разрушения, при этом в присутствии ОУНТ формируются значительно более массивные биопленки Alcaligenes faecalis 2 и Acinetobacter guillouiae 11h. Показано, что уровень дегидрогеназной активности, оцененный по восстановлению соли тетразолия до формазана, у клеток биопленок, формируемых в присутствии ОУНТ, превышал таковой биопленок в контроле.
Одностенные углеродные нанотрубки, родококки, протеобактерии, активный ил
Короткий адрес: https://sciup.org/147238651
IDR: 147238651 | УДК: 579.22 | DOI: 10.17072/1994-9952-2022-2-131-136
Текст научной статьи Влияние одностенных углеродных нанотрубок на биопленкообразование актинобактерий рода Rhodococcus и протеобактерий активного ила
В последние годы в связи с широким распространением наноматериалов активно изучается их воздействие на живые организмы, как на клетки эукариотов, так и на прокариотов. Малые размеры одноклеточных прокариотов обеспечивают непосредственное взаимодействие клетки с наноматериалами. Масштабное производство и применение наночастиц приводит к их попаданию в окружающую среду, сточные воды и почвы, в связи с чем возникает интерес к изучению их воздействия на микроорганизмы этих экосистем.
Одностенные углеродные нанотрубки (ОУНТ) представляют собой листы графена, свернутые в цилиндры [Iijima, Ichinashi, 1993]. Предполагается, что за счет малого диаметра повреждающее действие ОУНТ на живые организмы, по сравнению с многостенными углеродными наноматериалами, будет более выраженным [Boncel et al., 2015]. Было показано, что взаимодействие модельного организма Escherichia coli с нефункционализированными агрегатами ОУНТ в течение 60 мин. приводило к гибели 80% клеток [Kang et al., 2008]. Также наблюдалось увеличение экспрессии стресс-зависимых генов после инкубации E. coli с углеродными нанотрубками, что доказывало их цитотоксический эффект [Rodrigues, Elimelech, 2010]. При этом предполагали трехступенчатый антимикробный механизм: (1) первоначальный контакт ОУНТ с бактериями, (2) нарушение структуры мембраны, (3) окислительный стресс [Vecitis et al., 2010]. Высказано предположение, что ОУНТ действуют как «нанодротики», нарушая целостность цитоплазматической мембраны [Liu et al., 2009]. Морфологическими, физиологическими исследованиями и прямым высевом подтвердили бактерицидный эффект ОУНТ в суспензиях генно-инженерного штамма E. coli K12 TG1 (plux) с клонированным в него lux-опероном [Зарубина и др., 2009]. Антибактериальный эффект диспергированных ОУНТ как на грамотрицательные E. coli , так и на грамположитель-ные Bacillus subtilis был подтвержден методом атомно-силовой микроскопии (АСМ) [Liu et al., 2010]. Однако ряд исследователей придерживается другого мнения. Так, в работе Д.Г. Дерябина методом АСМ было показано отсутствие мембрано-повреждающего действия очищенных ОУНТ на E. coli [Дерябин и др., 2010].
В связи с попаданием наноматериалов такого типа в окружающую среду возникает вопрос об их воздействии на микробные сообщества в целом. В ряде работ было показано, что активность почвенных ферментов снижалась, а состав микробного сообщества почвы значительно изменялся под воздействием ОУНТ [Jin et al., 2013; Jin et al., 2014]. Так как в окружающей среде микроорганизмы существуют в основном в виде прикрепленных сообществ, погруженных в полимерный матрикс – биопленок, возникает закономерный вопрос о воздействии ОУНТ на такие сообщества, как на процесс их формирования, так и на зрелые биопленки. На модельной E. coli было показано, что в зрелых биопленках полимерный матрикс снижает токсический эффект ОУНТ на клетки [Rodrigues, Elimelech, 2010]. В целом, вопрос воздействия углеродных нанотрубок на бактериальные биопленки остается малоизученным. Ранее нами было показано, что многостенные углеродные нанотрубки не ингибируют биопленкообразование штаммов E. coli [Максимова, Быкова, 2021]. Цель настоящей работы – изучение биопленкообразования и разрушения биопленок некоторых видов грамотрицательных бактерий активного ила и актинобактерий рода Rhodo-coccus под действием ОУНТ.
Материалы и методы исследования
Объекты исследования и условия культивирования биопленок
Биопленки грамотрицательных бактерий Alcaligenes faecalis 2, Acinetobacter guillouiae 11h [Демаков и др., 2015], Achromobacter pulmonis ПНОС, Burkholderia dolosa БОС [Максимова и др., 2020], ранее выделенных нами из активного ила очистных сооружений, а также грамположительных бактерий R. erythropolis ИЛБИО, R. erythropolis 11-2, R. ruber gt1, ранее выделенных нами из почв Пермского края, выращивали в 96-луночном полистироловом планшете «Медполимер» (Россия) в 200 мкл среды LB «Sigma-Aldrich» (США), инокулированной 5 мкл бактериальной суспензии, содержащей 109 КОЕ/мл.
В среду вносили 200 мкг/мл ОУНТ TUBALLTM (OCSiAl, Россия). ОУНТ имели следующие характеристики: внешний средний диаметр 1.6 ± 0.4 нм, полная удельная поверхность 1311 м2/г, чистота 99.5. Перед инокуляцией бактериальными штаммами среду с ОУНТ обрабатывали УЗ в ультразвуковой ванне Elma Ultrasonic 30S (Германия) при 37 кГц 10 раз по 1 мин. Контролем служили биопленки, выращенные на среде LB без ОУНТ.
Определение массивности биопленки
После 7 сут. инкубации в термостате при 30ºС планктонные клетки удаляли из лунок декантацией, дважды отмывали биопленку 200 мкл калий-фосфатного буфера и определяли массивность образованной биопленки. Биопленку окрашивали 0.1%-ным кристаллическим фиолетовым в течение 40 мин. в темноте, удаляли краситель, отмывали 1 раз калий-фосфатным буфером и экстрагировали краситель 200 мкл 96%-ного спирта. Биопленкообразование оценивали по оптической плотности раствора красителя при λ 540 нм на планшетном ридере Infinite M1000 pro, «TECAN» (Швейцария).
Тест на разрушение биопленок
Влияние ОУНТ на разрушение биопленок оценивали по общей массивности биопленки, определенной описанным выше методом, после суточной инкубации выращенных на среде LB биопленок с 0.9%-ным NaCl, содержащим 200 мкг/мл ОУНТ. Контролем служили биопленки, инкубированные с 0.9%-ным NaCl без ОУНТ.
Определение дыхательной активности клеток биопленок
Воздействие ОУНТ на дыхательную активность биопленок оценивали колориметрическим методом с использованием набора реактивов ХТТ Cell Proliferation Assay Kit, «Roche» (Germany).
Сформированные биопленки отмывали и вносили 100 мкл 0.9% раствора NaCl с добавлением 50 мкл реактива ХТТ (2,3-бис-(2-метокси-4-нитро-5-сульфофенил)-2Н-тетразолий-5-карбоксанилид). Измерения проводили на планшетном ридере Infinite M1000 pro «TECAN» (Швейцария) при λ 480 нм через каждый час в течение 7 ч. Во второй серии экспериментов биопленки, выращенные на среде LB, отмывали, вносили 100 мкл 0.9%-ного NaCl с ОУНТ (200 мкг/мл) и добавляли 50 мкл реактива ХТТ. Контролем служил 0.9%-ный NaCl без добавок. Измерения проводили, как описано выше. Уровень влияния ОУНТ на метаболическую активность бактериальных клеток (I) определяли как отношение оптической плотности экспериментального образца к оптической плотности контрольного образца через 7 ч. инкубации. Значение > 1 свидетельствовало о повышении дыхательной активности, < 1 – о снижении дыхательной активности.
Статистическую обработку проводили с использованием t-критерия Стьюдента, различия считали значимыми при p < 0.05.
Результаты и их обсуждение
Актинобактерии рода Rhodococcus и штаммы грамотрицательных бактерий, выделенные ранее нами из активного ила, были выращены в присутствии ОУНТ на среде LB. После 7 сут. роста оценивали массивность образующихся биопленок. Было установлено, что ОУНТ не оказывали ингибирующего действия на биопленкообразование изученных бактерий: так, все грамотрицательные бактерии активного ила формировали достоверно более массивные биопленки в присутствии наноматериалов, причем массивность биопленок A. guillouiae 11h и A. faecalis 2, формируемых в среде с ОУНТ, превышала таковую на среде LB в 8.5 и 73.2 раза соответственно (рис. 1). Несмотря на то, что в ряде работ подтверждалось бактерицидное действие ОУНТ [Kang et al., 2007; Kang et al., 2008; Liu S. et al., 2010; Rodrigues, Elimelech, 2010], в нашем исследовании было показано отсутствие антибактериального эффекта в сочетании со стимуляцией биопленкообразования.
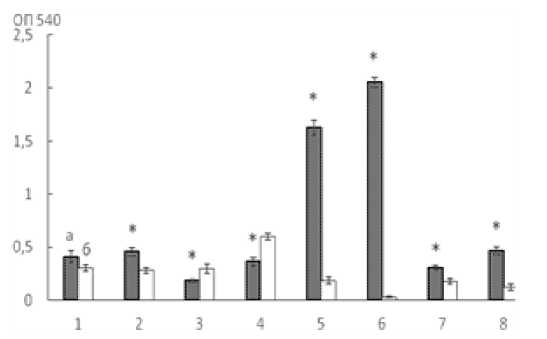
Рис. 1. Массивность биопленок при росте на среде LB с ОУНТ (а) и без наноматериалов (б) в течение 7 сут.: 1 – R. ruber gt1, 2 – R. erythropolis ИЛБИО, 3 – R. erythropolis 11-2, 4 – R. erythropolis 4-1, 5 – A. guillouiae 11h, 6 – A. faecalis 2, 7 – A. pulmonis ПНОС, 8 – B. dolosa БОС, (* p < 0.05)
[The massiveness of biofilms when growing on LB medium with OUNT (a) and without nanomaterials (b) for 7 days: 1 – R. ruber gt1, 2 – R. erythropolis ILBIO, 3 – R. erythropolis 11-2, 4 – R. erythropolis 4-1, 5 – A. guillouiae 11h, 6 – A. faecalis 2, 7 – A. pulmonis PNOS, 8 – B. dolosa BOS, (* p < 0.05)]]
Так как в биопленке микроорганизмы в большей степени защищены от неблагоприятных внешних воздействий, переход из планктонной формы существования к росту в биопленке может быть адаптивной реакцией в ответ на стрессовый фактор. Кроме того, нельзя исключать агрегацию клеток в суспензии с ОУНТ и их оседание под действием силы тяжести, способствующее адгезии клеток к поверхности полистиролового планшета как на первых этапах роста, так и в дальнейшем к формируемой биопленке. При этом в среде LB рост A. faecalis 2 в основном планктонный, а уровень биопленкообразования незначительный. У штаммов родококков не было выявлено закономерности биопленкообразования в присутствии ОУНТ: у R. erythropolis ИЛБИО формировались достоверно более массивные биопленки, у R. erythropolis 11-2 и R. erythropolis 4-1 – менее массивные.
Оценивали разрушение биопленок под воздействием ОУНТ в течение 24 ч. Как и в случае формирования биопленок, ОУНТ не только не вызывали разрушение биопленок A. guillouiae 11h и A. faecalis 2, но и способствовали их большему сохранению в среде без питательного субстрата, в отличие от варианта с физиологическим раствором без наноматериалов (рис. 2). При этом не было показано значительного влияния ОУНТ в среде на разрушение или сохранение биопленок родококков.
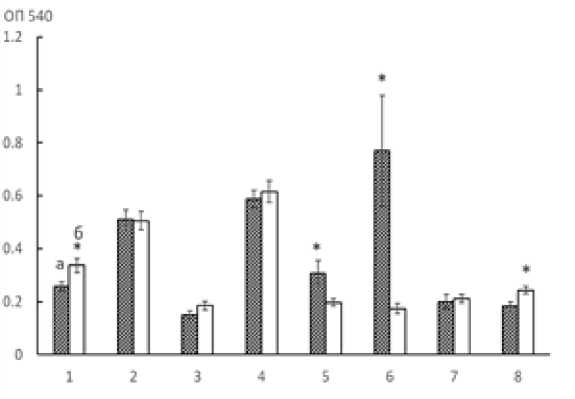
Рис. 2. Разрушение биопленок при 24 ч. инкубации в 0.9%-ном NaCl с ОУНТ (а) и без наноматериалов (б):
1 – R. ruber gt1, 2 – R. erythropolis ИЛБИО, 3 – R. erythropolis 11-2, 4 – R. erythropolis 4-1, 5 – A. guillouiae 11h, 6 – A. faecalis 2, 7 – A. pulmonis ПНОС, 8 – B. dolosa БОС, (* p < 0,05)
[Destruction of biofilms at 24 h. incubation in 0.9% NaCl with OUNT (a) and without nanomaterials (б):
1 – R. ruber gt1, 2 – R. erythropolis IL-BIO, 3 – R. erythropolis 11-2, 4 – R. erythropolis 4-1, 5 – A. guillouiae 11h,
6 – A. faecalis 2, 7 – A. pulmonis PNOS, 8 – B. dolosa BOS, (* p < 0.05)]
Оценивали дыхательную активность клеток биопленок с использованием реактива ХТТ Cell Proliferation Assay Kit. Более интенсивная оранжевая окраска реагента, связанная с восстановлением соли тетразолия до формазана, коррелирует с количеством дегидрогеназ, и, следовательно, с количеством жизнеспособных клеток. У всех изученных бактерий, за исключением R. erythropolis 11-2, было отмечено возрастание дыхательной активности клеток биопленок, формируемых в присутствии ОУНТ (рис. 3, таблица). Наибольшее возрастание дыхательной активности отмечено у клеток биопленок R. erythropolis 41, при этом общая массивность биопленок этого штамма, образованных в присутствии ОУНТ, была даже снижена. Данное противоречие может быть объяснено воздействием ОУНТ на формирование полимерного матрикса. Известно, что кристаллический фиолетовый окрашивает не только живые, но и мертвые клетки и полимерный матрикс биопленки, следовательно, снижение массивности может быть связано с меньшим количеством экзополимера. При воздействии ОУНТ на выращенные биопленки дыхательная активность A. guillouiae 11h, A. faecalis 2 и A. pulmonis ПНОС незначительно снижалась, а B. dolosa БОС, R. erythropolis ИЛБИО, R. erythropolis 11-2 и R. erythropolis 4-1 незначительно повышалась (таблица).
Индекс воздействия (I) ОУНТ на дыхательную активность биопленок [Index of the impact (I) of OUNT on the respiratory activity of biofilms]
|
Штамм |
Биопленки, выращенные в присутствии ОУНТ |
Воздействие ОУНТ на выращенные биопленки |
|
A. pulmonis ПНОС |
1.62 |
0.83 |
|
A. guillouiae 11h |
2.79 |
0.92 |
Окончание таблицы
|
Штамм |
Биопленки, выращенные в присутствии ОУНТ |
Воздействие ОУНТ на выращенные биопленки |
|
A. faecalis 2 |
0.97 |
0.70 |
|
B. dolosa БОС |
1.94 |
1.75 |
|
R. ruber gt1 |
2.54 |
- |
|
R. erythropolis ИЛ БИО |
1.84 |
1.26 |
|
R. erythropolis 11-2 |
0.61 |
1.37 |
|
R. erythropolis 4-1 |
3.49 |
1.32 |
[Respiratory activity of 7-day biofilms of R. ruber gt1 (1, 3), R. erythropolis IL BIO (2, 4), A. guillouiae 11h (5, 7), B. dolosa BOS (6, 8) grown on LB medium with OUNT (1, 2, 5, 6) and on LB medium without nanomaterials (3, 4, 7, 8), (* p < 0.05)]
Заключение
Было установлено, что ОУНТ в среде культивирования не оказывали антибактериального действия в отношении изученных актинобактерий рода Rhodococcus и протеобактерий активного ила – представителей родов Alcaligenes, Acinetobacter, Achromobacter и Burkholderia . Также эти наноматериалы не ингибировали образование биопленок изученных бактерий и значительно усиливали биопленкообразование A. guillouiae 11h и A. faecalis 2. Разрушение биопленок A. guillouiae 11h и A. faecalis 2 в физиологическом растворе с ОУНТ было гораздо менее выражено, чем в отсутствие наноматериалов. Уровень дегидроге-назной активности, оцененный по восстановлению соли тетразолия до формазана, у клеток биопленок, формируемых в присутствии ОУНТ, превышал таковой биопленок в контроле (на среде LB без наноматериалов); при этом исключением являлся R. erythropolis 11-2. Таким образом, ОУНТ не оказывает ингибирующего действия на формирование биопленок родококков и грамотрицательных бактерий активного ила, не вызывает их разрушения и не подавляет дыхательную активность клеток.
Список литературы Влияние одностенных углеродных нанотрубок на биопленкообразование актинобактерий рода Rhodococcus и протеобактерий активного ила
- Демаков В.А. и др. Бактерии активного ила биологических очистных сооружений, трансформирующие цианопиридины и амиды пиридинкарбоновых кислот // Микробиология. 2015. Т. 84, № 3. С. 369-378.
- Дерябин Д.Г. и др. Исследование взаимодействия углеродных наноматериалов с клетками Escherichia coli методом атомно-силовой микроскопии // Российские нанотехнологии. 2010. Т. 5, № 1112. С. 103-108.
- Зарубина А.П. и др. Биотестирование биологических эффектов одностенных углеродных нанотру-бок с использованием тест-системы люминесцентных бактерий // Российские нанотехнологии. 2009. Т. 4, № 11-12. С. 152-155.
- Максимова Ю.Г., Быкова Я.Е. Влияние многостенных углеродных нанотрубок на биопленкообразование Escherichia coli // Вестник Пермского университета. Сер. Биология. 2021. Вып. 2. С. 87-92.
- Максимова Ю.Г. и др. Деградация пиридина суспензиями и биопленками штаммов Achromobacter pulmonis ПНОС и Burkholderia dolosa БОС, выделенных из активного ила очистных сооружений // Биотехнология. 2020. Т. 36, № 2. С. 86-98.
- Boncel S. et al. Interactions of carbon nanotubes with aqueous/aquatic media containing organic/inorganic contaminants and selected organisms // Chemosphere. 2015. Vol. 136. P. 211-221.
- Iijima S., Ichinashi T. Single-shell carbon nanotubes of 1-nm diameter // Nature. 1993. Vol. 363. P. 603-605.
- Jin L. et al. High concentrations of single-walled carbon nanotubes lower soil enzyme activity and microbial biomass // Ecotoxicology and Environmental Safety. 2013. Vol. 88. P. 9-15.
- Jin L. et al. Single-walled carbon nanotubes alter soil microbial community composition // Science of the Total Environment. 2014. Vol. 466-467. P. 533-538.
- 10 Kang S. et al. Single-walled carbon nanotubes exhibit strong antimicrobial activity // Langmuir. 2007. Vol. 23. P. 8670-8673.
- Kang S. et al. Antibacterial effects of carbon nanotubes: size does matter! // Langmuir. 2008. Vol. 24, № 13. P. 6409-6413.
- Liu S. et al. Sharper and faster "nano darts" kill more bacteria: A study of antibacterial activity of individually dispersed pristine single-walled carbon nanotube // ACS Nano. 2009. Vol. 3. P. 3891-3902.
- Liu S. et al. Antibacterial action of dispersed single-walled carbon nanotubes on Escherichia coli and Bacillus subtilis investigated by atomic force microscopy // Nanoscale. 2010. Vol. 2. P. 2744-2750.
- Rodrigues D.F., Elimelech M. Toxic effects of single-walled carbon nanotubes in the development of E. coli biofilm // Environmental Science and Technology. 2010. Vol. 44. P. 4583-4589.
- Vecitis C.D. et al. Electronic-structure-dependent bacterial cytotoxicity of single-walled carbon nanotubes // ACS Nano. 2010. Vol. 4, № 9. P. 5471-5479.


